Riassunto
Il fumo di tabacco è uno tra i più gravi problemi di salute pubblica al mondo: risulta implicato in uno ogni dieci decessi in età adulta e rappresenta un fattore di rischio in almeno sei tra le principali otto cause di morte al mondo. Nei paesi occidentali è ormai assodato essere il capolista tra le cause di mortalità evitabile. Il fumo influisce sia sulla qualità di vita sia sulla durata della stessa: si calcola che 20 sigarette al giorno, per un giovane che inizi a fumare a 25 anni, comportino una riduzione di 4,6 anni della vita media rispetto a un non fumatore. In Italia fuma attualmente circa il 40% degli uomini e il 18% delle donne, con una prevalenza complessiva del 29%; negli ultimi 40 anni si è ridotta la percentuale di fumatori tra i maschi mentre è aumentata in modo preoccupante tra le donne e in generale tra i giovani.
Summary
Smoking and orofacial health: literature review and scientific rational
Tobacco smoke is one of the most severe public health problems in the world: it turns out to be involved in one out of ten deaths in adulthood and proves to be a risk factor in at least six out of eight main causes of death in the world. In the West Countries it is proved to be the main subject among preventable causes of death. Smoking affects both life quality and life duration: it has been calculated that 20 cigarettes per day, for a young man starting to smoke at the age of 25, may reduce as much as 4,6 years his mean life expectation compared to nonsmokers. Presently, in Italy smokers are about 40% of men and 18% of women, with an overall prevalence of 29%; during the last 40 years smokers’ percentage decreased among men while it increased in an alarming way among women and young people in general.
Luigi Paglia1
Luca Ginocchio2
Annalisa Crespi3
Rolando Crippa4
1Istituto Stomatologico Italiano - Direttore Dipartimento di Odontoiatria Materno-Infantile - Milano
2Istituto Stomatologico Italiano - Reparto di Parodontologia e Implantologia - Milano
3Master Europeo in Medicina Estetica presso l’A.S.P.E.M.
4Istituto Stomatologico Italiano - Direttore Dipartimento di Patologia Orale e Laserterapia - Milano
“No smoking be happy” è la campagna di lotta al fumo di sigaretta della Fondazione Umberto Veronesi finalizzata a educare e sensibilizzare la popolazione sull’importanza della prevenzione e sui danni che il fumo provoca al corpo umano. Il progetto nasce nel 2008 e si articola in attività di comunicazione rivolte ai giovani, alle donne e ai fumatori in generale (Nosmokingbehappy).
Dal 2013 il progetto No smoking be happy, attraverso una partnership con Fondazione ISI (Istituto Stomatologico Italiano - Milano) e Fondazione ANDI (Associazione Nazionale Dentisti Italiani), declinerà il suo messaggio di sensibilizzazione sui danni che il fumo provoca al cavo orale rivolgendosi anche agli operatori odontoiatrici e, quindi, ai loro pazienti. Questo aggiornamento vuole portare un iniziale contributo a questo “percorso”. Il fumo di tabacco è uno dei più gravi problemi di salute pubblica al mondo1. Secondo l’Organizzazione mondiale della sanità, ogni anno, sono 6 milioni le persone che muoiono per malattie correlate al fumo2. Questa cifra è destinata a crescere in assenza di rigide misure di controllo: per il 2030 si parla di oltre 8 milioni di morti, di cui l’80% nei paesi economicamente avanzati. Il fumo è implicato in uno ogni dieci decessi in età adulta, manifestando i suoi danni nel lungo periodo, data la latenza tra l’inizio dell’abitudine e l’insorgenza della malattia. Per i fumatori si stima infatti una riduzione dell’aspettativa di vita di circa 10 anni e un aumento del rischio di malattie pneumologiche, cardiovascolari e oncologiche tanto maggiore quanto più è anticipata l’età di inizio dell’abitudine. Fumare è il risultato di scelte individuali, spesso influenzate da fattori sociali e culturali. Oltre al sesso e all’età, altri fattori che incidono in maniera significativa sulla frequenza di tabagismo sono la classe sociale e il livello di istruzione: l’abitudine al fumo risulta più diffusa tra le persone con diploma di scuola media inferiore e con difficoltà economiche. Anzi, a fronte della riduzione complessiva verificatasi a partire dagli anni Ottanta, nel tempo si è ampliato il divario tra classi sociali, con una maggiore incidenza nelle categorie più svantaggiate. Inoltre è di comune riscontro che i figli di genitori fumatori facilmente pratichino la stessa abitudine. All’interno della popolazione dei fumatori si possono individuare alcune categorie di soggetti che richiedono un’attenzione particolare come gli adolescenti, le donne in età fertile e i soggetti esposti al fumo passivo. Negli ultimi quarant’anni è diminuita la percentuale di fumatori tra i maschi, mentre è aumentata tra le donne (fino a raggiungere in alcune zone valori simili a quelli maschili) e i giovani. Nelle statistiche dei decessi e delle patologie fumo-correlati, oltre ai fumatori bisogna considerare anche le oltre 600 mila persone che muoiono ogni anno a causa del fumo passivo, particolarmente pericoloso perché non controllabile. A livello globale, solo l’11% della popolazione mondiale è protetto da leggi smoke free nazionali e il 40% dei bambini ha almeno un genitore che fuma. Per quanto riguarda il continente europeo, secondo i dati riferiti dall’Oms Europa, la prevalenza dei fumatori all’interno della Regione si stima sia intorno al 28,6% con una grande differenza di genere (40% tra gli uomini e 18,2% tra le donne). Emerge inoltre che in Europa in media il 24% dei giovani di 15 anni fuma ogni settimana. Il fumo di tabacco è responsabile del 21% dei decessi della Regione e di 12-20 anni di vita persi in buona salute. I dati della Comunità europea pubblicati nel 2009 su Eurobarometro3 mettono in evidenza che tre cittadini europei su dieci, sopra i 15 anni di età, fumano: il 26% quotidianamente, il 5% occasionalmente, il 22% ha smesso di fumare e la metà circa dichiara di non avere mai fumato. I Paesi europei con più fumatori sono Grecia (42%), Bulgaria (39%) e Lettonia (37%). Quelli con meno: Slovenia (17%) Svezia (18%) e Finlandia (19%). L’Italia si colloca in una posizione intermedia, con una prevalenza del 29%. Secondo i dati riferiti dal ministero della Salute, si stima che in Italia siano attribuibili al fumo di tabacco dalle 70 mila alle 83 mila morti l’anno. Oltre il 25% di questi decessi riguarda persone tra i 35 e i 65 anni di età e oltre un milione sono gli anni di vita in buona salute persi. Questi dati fanno del fumo di tabacco la principale causa prevenibile di mortalità anche nel nostro paese, come nel resto del mondo occidentale. In Italia, secondo i risultati dell’indagine Iss-Doxa 20124, sono 10,8 milioni i fumatori adulti al di sopra dei 15 anni di età (20,8% della popolazione). Di questi, 6,1 milioni sono uomini (24,6%), 4,7 milioni sono donne (17,2%). Tra il 2011 e il 2012 si registra un decremento della prevalenza del fumo di sigarette che è passato dal 22,7% al 20,8%. La fascia d’età con la più alta percentuale di fumatori è quella compresa tra i 25-44 anni, dove si registra un 33,7% per gli uomini e un 24,1% per le donne. Per i giovani fumatori (15-24 anni) si ha una prevalenza del 20,9% per i maschi e del 16% per le donne; per gli ultra 65 enni del 10,9% per gli uomini e del 5,6% per le donne. La percentuale dei fumatori che ha iniziato prima dei 15 anni è diminuita negli ultimi anni passando dal 18,8% nel 2009 al 13,3% nel 2012.
Fumo e salute generale
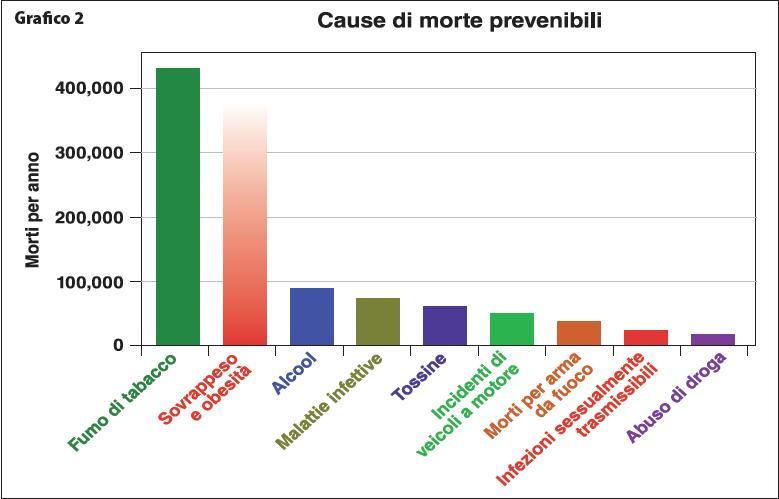
È ormai disponibile e facilmente consultabile una grandissima mole di lavori scientifici che hanno dimostrato l’influenza del fumo di tabacco sulla salute, muovendo inizialmente da osservazioni epidemiologiche che mettevano in evidenza, fin dai primi studi, un’incidenza significativamente più alta di problemi sanitari gravi nei soggetti fumatori5. L’assunzione costante e prolungata del tabacco è in grado di incidere sulla durata della vita media, oltre che sulla qualità della stessa6: 20 sigarette al giorno riducono di circa 4,6 anni la vita media di un giovane che inizia a fumare a 25 anni. Ovvero per ogni settimana di fumo si perde un giorno di vita. Si stima che di 1.000 maschi adulti che fumano uno morirà di morte violenta, sei moriranno per incidente stradale, 250 saranno uccisi dal tabacco per patologie a esso correlate. Gli organi colpiti dal fumo di tabacco sono molteplici: l’apparato broncopolmonare e quello cardiovascolare sono i più bersagliati. Il “Center for Disease Control and Prevention” (CDC) degli Stati Uniti ha identificato 27 malattie fumo-correlate7. Ogni malattia ha un particolare rischio correlato al fumo8. Il fumo di tabacco rappresenta un fattore di rischio in almeno sei tra le otto principali cause di morte (Grafico 1). Il numero totale di decessi attribuibili al fumo di tabacco e correlati allo sviluppo di varie patologie quali la cardiopatia ischemica, la cerebropatia vascolare (ictus), la broncopneumopatia cronica ostruttiva (BPCO) e molte altre patologie è destinato ad aumentare da 5,4 milioni nel 2004 a 8,3 milioni nel 2030, con approssimativamente un 10% in più di decessi in tutto il mondo. È tuttavia nei paesi in via di sviluppo che si concentrerà l’80% dei decessi. Secondo alcune stime, il fumo causa ogni anno più di 440 000 morti negli Stati Uniti e circa 80.000 in Italia ed è capolista tra le cause di mortalità evitabile9 (Grafico 2). Tra le quasi 4.000 sostanze isolate nel fumo di sigaretta ne sono state classificate, al 2006, 69 cancerogene tra cui 10 specie di idrocarburi policiclici aromatici (IPA), l’acroleina, 10 specie di N-nitrosammine e 11 composti (tra cui alcuni radiogenici come il Polonio-210) appartenenti allo IARC group I dei carcinogeni umani. La classificazione delle sostanze cancerogene per l’uomo a cura dello IARC (International Agency for Research on Cancer) suddivide le sostanze analizzate in 5 gruppi (1-2A-2B-3-4) in base alle evidenze sperimentali (e quindi al grado di certezza) della loro azione cancerogena10. Il gruppo 1 comprende i composti sicuramente cancerogeni per l’uomo (Complete list of agents evaluated and their classification, IARC 2006). Diversi composti sono bioattivi secondo differenti modalità, essendo cancerogeni certi, cancerogeni sospetti, irritanti o diversamente interagenti con i nutrienti assunti. I prodotti della combustione incompleta di tabacco e carta e le sostanze volatili (per la elevata temperatura che ne consegue) comprendono:
- catrame, prodotto da combustione incompleta e condensazione di sostanze altobollenti;
- VOC (Volatile Organic Compounds) tra cui il cancerogeno benzene;
- idrocarburi policiclici aromatici (IPA), provenienti dalla combustione di carta e tabacco, comprendenti i cancerogeni benzopireni; la loro ossidazione produce epossidi mutageni per la loro capacità di alchilare il DNA; aumentano il rischio di tumore al polmone in quanto responsabili di una proliferazione cellulare incontrollata;
- particolato o polveri fini, e principalmente il particolato carbonioso, anch’esso derivante dalla combustione incompleta, fonte diretta di problemi cardiovascolari e substrato su cui si adsorbono alcuni IPA tra cui il benzopirene, così veicolati direttamente negli alveoli polmonari;
- nicotina, contenuta nelle foglie di tabacco e volatilizzata col calore; ha effetti neurologici ed è la principale responsabile della dipendenza in quanto aumenta il livello di dopamina nei circuiti cerebrali del piacere. Il fumo di tabacco inibisce le monoammina ossidasi, responsabili della degradazione nel cervello dei neurotrasmettitori monoamminergici, tra cui la dopamina11. Questo genera una sensazione di piacere con meccanismi analoghi a quelli innescati da alcaloidi contenuti in alcune droghe. La dipendenza da nicotina è quindi legata anche alla necessità biochimica di mantenere elevati livelli di dopamina. È inoltre possibile che anche altri composti del fumo di tabacco concorrano a creare questo effetto. La nicotina è inoltre un potente tossico, anche se, per le modalità e le dosi di assunzione (l’assorbimento per via respiratoria è ovviamente parziale), gli effetti tossici da avvelenamento nicotinico non sono tra i principali imputati nei danni del fumo. Ha effetti sulla pressione sanguigna e provoca vasocostrizione arteriosa periferica: riducendo il flusso ematico distale limita l’afflusso di sangue alla pelle contribuendo all’invecchiamento precoce della stessa. In genere il corpo umano impiega 3 settimane per eliminare completamente la nicotina presente nell’organismo12;
- monossido di carbonio, prodotto dalla combustione incompleta; riduce la capacità respiratoria e “deossigena” il sangue legandosi all’emoglobina più stabilmente dell’ossigeno13. È reputato anche responsabile dell’invecchiamento precoce, della caduta dei capelli e dell’ingiallimento della pelle, conseguenze della minore ossigenazione;
- sostanze irritanti: provocano danni alla mucosa respiratoria specialmente nei bronchi e in particolare alle cellule ciliate che si oppongono all’entrata di polveri, germi e sostanze tossiche nel polmone; questa continua azione irritante può provocare tosse e aumentata produzione di muco. Sono possibili conseguenti enfisemi e bronchiti croniche. Tosse e catarro, nel fumatore, sono il primo sintomo di questi effetti14. Tra queste sostanze spiccano:° aldeidi (acroleina, acetaldeide), conseguenti a una combustione incompleta ma a maggior livello d’ossidazione, irritanti per le mucose; formaldeide e acroleina15 sono cancerogeni,
° acidi organici carbossilici (acido formico), fenoli (fenolo, cresoli),
° ammine e ammoniaca,
° idrocarburi non aromatici di varie tipologie (principalmente alcani C12-C15) che contribuiscono a intaccare lo strato lipidico protettivo di organi e cellule, predisponendo all’aggressione di altri composti; - altre sostanze ossidanti. In questa sede verrà posto l’accento sull’influenza del fumo di tabacco sulle patologie di interesse odontostomatologico e sulle sue conseguenze riguardo l’estetica del viso. Si rimanda ad altra sede la trattazione approfondita della grave e peraltro ben assodata influenza del fumo sulle patologie neoplastiche (primo fra tutti il carcinoma polmonare), cardiovascolari (tra cui l’angina pectoris, l’infarto del miocardio, lo stroke e l’aneurisma aortico) e sui disturbi riguardanti le funzioni riproduttive dell’uomo e della donna.
Fumo e patologie orali
Nei fumatori abituali sono state osservate varie modificazioni della mucosa orale. Questi cambiamenti sono molto probabilmente il risultato dell’esposizione ai numerosi agenti irritanti, tossine e prodotti cancerogeni derivati dalla combustione delle foglie di tabacco, ma possono anche essere la conseguenza dell’effetto essiccante dell’aria calda inspirata, delle alte temperature intraorali, dei cambiamenti di pH intraorale, dell’alterazione locale delle membrane cellulari e della risposta immunitaria o di un’alterata resistenza a infezioni virali o micotiche16,17. Qui di seguito riportiamo le più significative modificazioni mucose rilevate nei fumatori.
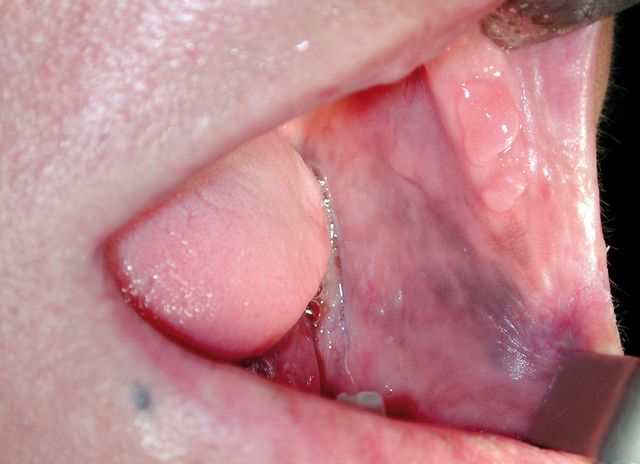
Melanosi del fumatore
Il fumo è in grado di stimolare i melanociti della mucosa orale a produrre un eccesso di melanina, al punto di determinare la comparsa di chiazze di pigmento brunastro sulla gengiva o sulla mucosa orale buccale nel 5-22% dei forti fumatori di pipa o di sigarette18(Figura 1). Tale condizione è più frequente nella donna; il numero e l’intensità sono dose-correlati e il fenomeno sembra regredire completamente in un periodo di 6-36 mesi dopo la cessazione del fumo. In vitro è stato dimostrato che la stessa nicotina è in grado di attivare uno degli step nella produzione della melanina. Sino a oggi non sono stati descritti casi di degenerazione in carcinoma o melanoma e la lesione non è mai stata osservata in utilizzatori di tabacco non da fumo. Occasionalmente si può osservare una melanosi con sovrapposizione di una leucoplachia: la lesione viene indicata con i termini di melanoleucoplachia o di leucomelanosi e si prevede che l’aspetto ipercheratosico si comporti esattamente come qualunque altra leucoplachia senza melanosi.
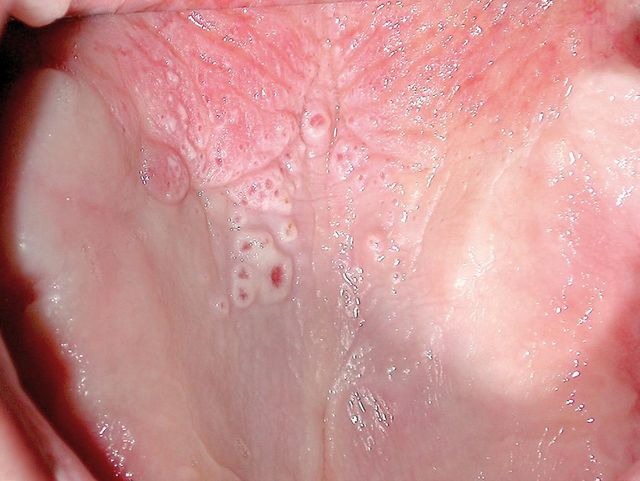
Leucocheratosi nicotinica
Quest’alterazione mucosa del palato duro era un tempo di frequente riscontro, ma è divenuta più rara da quando il fumo di sigaro e di pipa ha perso popolarità. La mucosa appare biancastra e si osservano numerose piccole aree rilevate con il centro arrossato: queste zone rossastre sono ghiandole salivari minori irritate il cui dotto escretore è infiammato dal fumo di tabacco (Figura 2). Già prima che divenisse infrequente erano comunque già chiari la benignità e il carattere non precanceroso di questa lesione. Anche se essa è determinata da un intenso e frequente contatto del fumo di tabacco con la mucosa palatina, tale da produrre una risposta ipercheratosica, non ha potenziale di degenerazione maligna ed è considerata più una risposta al calore elevato che non ai prodotti chimici del fumo16. La leucocheratosi è completamente reversibile in pochi mesi dopo la cessazione del fumo, anche nei casi in cui il soggetto abbia fumato per alcune decadi. Oggi si osserva occasionalmente in forti fumatori di sigarette (più di due pacchetti al giorno) ed è comunque d’intensità minore rispetto alle lesioni riscontrate alcuni decenni fa.
Cheratosi da tabacco non da fumo
Questo tipo di cheratosi, analogamente alla leucocheratosi nicotinica, non è più considerato una vera leucoplachia19. È sempre una placca biancastra ipercheratosica ma, a differenza di questa, ha un tipico aspetto semitraslucente piuttosto che un colore bianco diffuso e una diversa ultrastruttura microscopica. Si localizza unicamente nelle aree di diretto contatto con il tabacco da masticare o da fiuto ed è spesso completamente reversibile dopo che il paziente affetto abbandona la sua abitudine. Mentre non vi è alcun dubbio che sia una lesione precancerosa, la sua frequenza di degenerazione maligna è di un ordine di grandezza inferiore a quella della leucoplachia (0,4% contro 4% delle leucoplachie). Cheratosi da tabacco di un bianco più intenso e con superficie più ruvida sono considerate lesioni di grado più severo, anche se non è dimostrata una maggiore probabilità di degenerazione maligna. L’unica caratteristica che comporta un provato aumento dell’insorgenza di carcinoma orale è la mancata scomparsa della lesione dopo almeno due mesi dalla cessazione del tabacco non da fumo. Queste lesioni irreversibili dovrebbero essere considerate vere e proprie leucoplachie20.
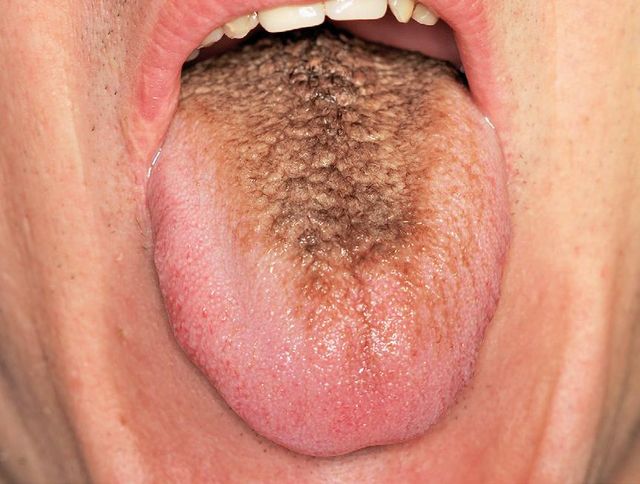
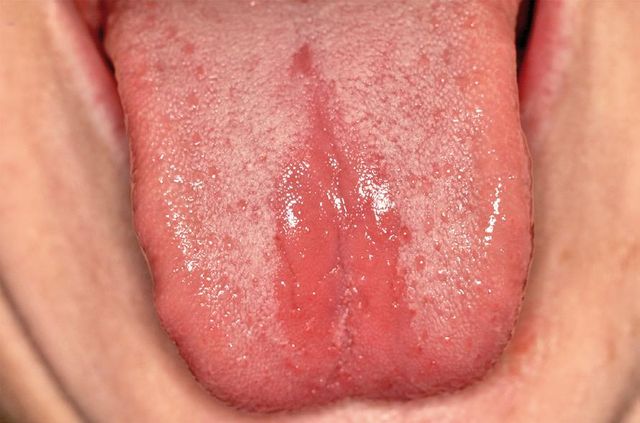
Lingua villosa
La condizione mucosa di papille filiformi allungate che mimano la presenza di peluria sul dorso linguale è osservata frequentemente nei forti fumatori (Figura 3). Teoricamente il fumo di tabacco ostacola la normale desquamazione delle cellule epiteliali, le quali si accumulano così a formare uno strato molto spesso e bianco (finché sovra infezioni di batteri cromogeni non gli conferiscono una pigmentazione bruna o nerastra, fenomeno indicato come lingua nigra villosa) che si estende come lunghi “villi” all’apice delle papille. Non esistono ricerche cliniche che permettano di associare definitivamente fumo e lingua villosa ma il fenomeno generalmente regredisce o si risolve dopo la cessazione dell’abitudine20. Si ritiene che anche il tabacco da masticazione possa contribuire a questa condizione, ma non esiste evidenza scientifica di quest’associazione.
Fibrosi sottomucosa
La fibrosi della sottomucosa orale è una condizione precancerosa caratterizzata dal progressivo indurimento della mucosa orale fino al punto che i soggetti affetti hanno difficoltà ad aprire la bocca. Un tasso di degenerazione maligna a dieci anni dell’8% è stato osservato in India, dove i masticatori di tabacco normalmente mischiano al tabacco anche foglie di betel e noci di areca21-23. Questa lesione, che spesso mostra sovrapposizione di una leucoplachia, è riscontro molto raro negli Stati Uniti e in Europa ma interessa lo 0,4% degli abitanti dei villaggi indiani.
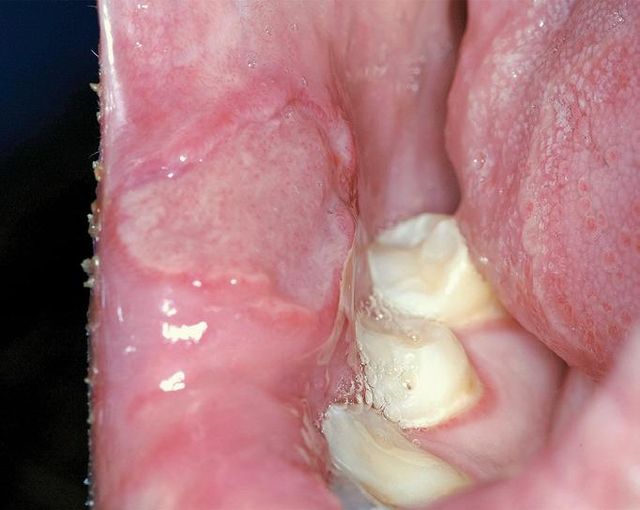
Leucoedema
Una modificazione bilaterale della mucosa orale dal contorno poco definito, di colore bianco-grigiastro e opalescente è stata osservata frequentemente in soggetti con carnagione scura24. Di natura sempre benigna e solitamente considerata una semplice variazione anatomica, può nel fumatore presentare un colore più bianco e dimensioni maggiori. Axell e Henricsson hanno riscontrato il leucoedema nel 60% dei fumatori adulti svedesi e soltanto nel 36% dei non fumatori25.
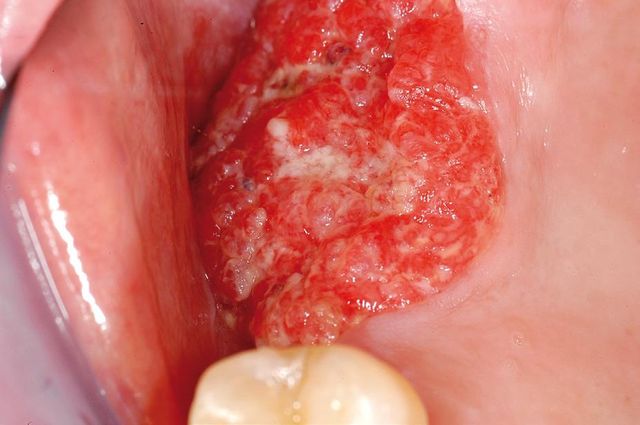
Leucoplachia
Mentre l’esatta eziologia della lesione rimane tuttora ignota, il fumo di tabacco resta tuttora il fattore eziologico più largamente accettato26. Approssimativamente l’80% dei pazienti affetti da leucoplachia sono fumatori, e qualora si prendano in esame ampi gruppi di adulti si potrà riscontrare come i fumatori abbiano una probabilità maggiore di essere affetti da leucoplachia rispetto ai non fumatori (23% contro 4%). I fumatori di pipa e i forti fumatori di sigarette mostrano lesioni più numerose e di dimensioni maggiori rispetto agli altri fumatori, specialmente dopo molti anni di abuso (Figura 4). Circa il 60% delle leucoplachie fumo-indotte, inoltre, scompare completamente in 6-12 mesi dopo la cessazione del vizio. La leucoplachia nel fumatore appare solitamente come una ben definita chiazza biancastra sulla mucosa orale; il paziente tipo è un maschio di 50-60 anni di età, mentre la lesione ha in media un diametro di 1,4 cm ed è presente da 2-4 anni al momento della diagnosi. Il potenziale medio di degenerazione in cancro delle leucoplachie è approssimativamente del 4%, ma alcune forme di leucoplachia comportano un potenziale più elevato: le eritroleucoplachie (“speckled leukoplakia”) raggiungono un potenziale del 25% e in alcuni studi addirittura del 41%. Seppure i dati riguardanti la probabilità di degenerazione maligna di leucoplachie in fumatori e non fumatori siano carenti, pare che le lesioni dei non fumatori o quelle dei pazienti che hanno cessato il fumo comportino un rischio maggiore di degenerazione27. In altre parole, i fumatori sarebbero interessati da un numero maggiore di leucoplachie ma le loro lesioni sembrerebbero essere meno aggressive.
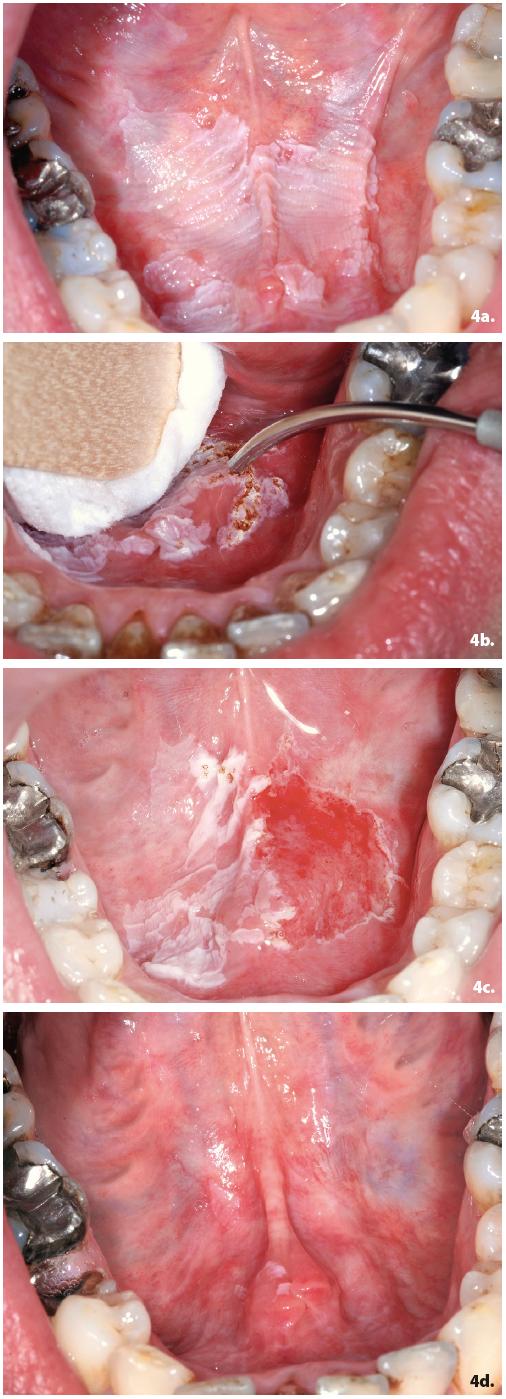
Caso clinico
Paziente di sesso maschile, di anni 32, forte fumatore (40 sigarette/die), portatore di un’ampia area leucoplasica del pavimento orale, quasi completamente occupato dalla lesione, ispessitasi negli ultimi mesi, per via dell’enorme quantità di sigarette consumate dal paziente (Figura 4a). Il rapporto tra la comparsa della lesione e il suo peggioramento dovuto all’incremento del consumo di sigarette è stato notato dal paziente stesso che si è rivolto alla nostra attenzione preoccupato dell’estensione sempre più cospicua dell’area nei mesi precedenti la visita. Dopo un lungo colloquio preliminare sul motivo di questa importante dipendenza dal fumo, si è deciso di procedere al trattamento della lesione che è stata dapprima biopsiata incisionalmente con laser a diodi 980 nm (Figura 4b) e poi vaporizzata completamente con laser a CO2 10600 nm (Figura 4c). Quest’ultimo intervento si è dimostrato efficace e viene mantenuto uno stretto monitoraggio quadrimestrale dell’area trattata. L’esame istologico aveva dimostrato già l’esistenza di una displasia lieve del tessuto esaminato. Il VNS (Valutazione numerica verbale del dolore post-operatorio ) del paziente è stato ottimo (Valore 1). Nonostante le raccomandazioni il paziente non ha smesso di fumare completamente (5-6 sigarette al giorno) ma l’obiettivo resta quello di dissuaderlo completamente dall’uso del fumo.
Carcinoma orale
Il carcinoma a cellule squamose è ovviamente la più drammatica modificazione della mucosa orale osservabile nel fumatore. Sono state sopra menzionate alcune lesioni precancerose, ma è sufficiente osservare che il ruolo del tabacco nello sviluppo di carcinoma squamoso della mucosa orale, laringea e faringea è assolutamente ben definito28,29. Almeno l’80% dei pazienti affetti da carcinoma orale sono fumatori; quelli con cancro orale trattato che continuano a fumare dopo la guarigione presentano una più alta probabilità di sviluppare un nuovo cancro di testa e collo; studi condotti su diversi animali hanno dimostrato la possibilità di indurre cancro orale mediante esposizione forzata al fumo di sigaretta; studi caso-controllo su umani hanno invece consentito di evidenziare come il fumatore abbia una probabilità sette volte maggiore di contrarre il cancro rispetto al non fumatore (Figura 5). È importante ricordare che il cancro orale si sviluppa mediante un processo di carcinogenesi, nel quale sono solitamente coinvolti multipli fattori29. Un’eccessiva assunzione di alcool, da sola, ha un ridotto impatto sulla prevalenza del carcinoma orale, ma l’alcool è un potente agente promotore in grado di alterare le cellule della mucosa orale e renderle molto più suscettibili alla trasformazione maligna per effetto dei cancerogeni del tabacco. Anche i soggetti che fanno uso di tabacco non da fumo sembrano presentare un rischio quattro volte maggiore di sviluppare carcinoma orale rispetto a chi non assume tabacco, sebbene gli studi sull’argomento siano piuttosto
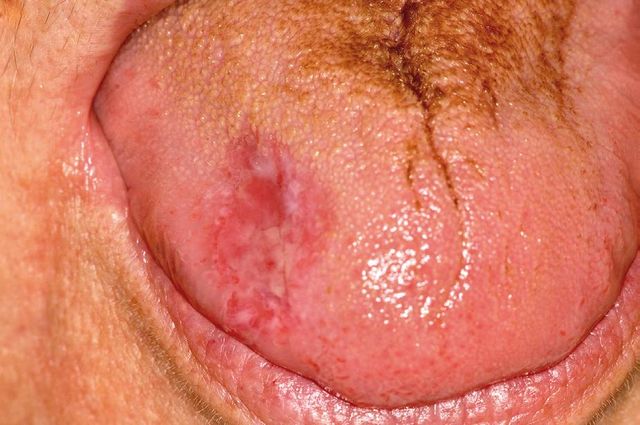
modesti (Figura 6). Una forma particolare di cancro orale a basso grado di aggressività, il carcinoma verrucoso, è così raro nei soggetti che non masticano tabacco da essere definito “cancro del tabacco da fiuto”: questo carcinoma si localizza tipicamente nell’esatta sede ove è cronicamente posto il tabacco21,22. Il carcinoma verrucoso differisce dal più comune cancro orale per la sua crescita molto lenta, il comportamento non metastatizzante e la presenza di cellule epiteliali molto differenziate (con cioè un basso grado di displasia). Il tasso di mortalità per carcinoma verrucoso è tra i più bassi tra tutti i cancri umani, ma purtroppo rappresenta una percentuale infinitesima di casi nei soggetti che fanno uso di tabacco da masticazione. Il cancro di gran lunga più frequente nei soggetti che fanno uso di tabacco sia da fumo sia non da fumo è infatti il carcinoma invasivo a cellule squamose.
Gengivite
Numerosi studi hanno concluso che i fumatori hanno maggiore probabilità di mostrare arrossamento, emorragia ed edema gengivale rispetto a non fumatori con equivalenti abitudini di igiene orale. Altri studi invece hanno dimostrato un ridotto sanguinamento gengivale nei fumatori, probabilmente determinato dall’effetto vasocostrittore prodotto dalla nicotina30(Figura 7). Gli
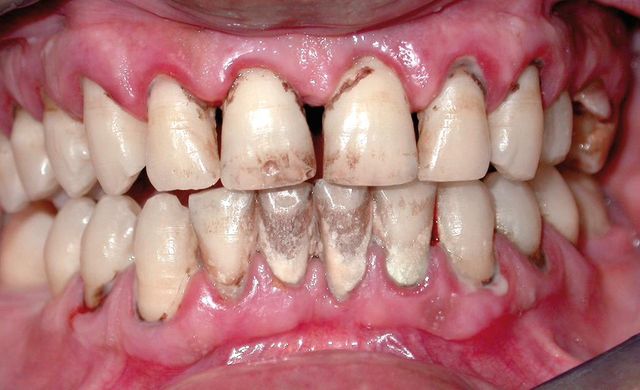
utilizzatori di tabacco da masticazione non sembrano predisposti alla gengivite bensì a una perdita indolore di tessuto gengivale nell’area di applicazione del tabacco che si traduce in recessione; questo fenomeno si ritiene dovuto a una combinazione di abrasione meccanica e rilascio locale di collagenasi e altri enzimi proteolitici indotti dal tabacco21,22,31-33. Un’altra evidenza clinica e statistica è che i fumatori hanno una quantità di tartaro considerevolmente maggiore rispetto ai non fumatori, e i forti fumatori maggiore rispetto ai fumatori moderati34-36 (Figura 8).
Parodontite
La letteratura ha dimostrato che il fumo costituisce un fattore di rischio fondamentale della parodontite cronica, della parodontite aggressiva nonché della parodontite refrattaria alla terapia37. I fumatori hanno una probabilità approssimativamente 3 volte maggiore di soffrire di parodontite grave rispetto ai non fumatori e mostrano all’incirca il 50% di miglioramento dopo terapia parodontale rispetto ai non fumatori38. Dopo aver controllato altre variabili quali le differenti abitudini d’igiene orale, età, sesso e condizioni socio-economiche del paziente, i fumatori mostrano ancora tasche più profonde, maggiore perdita ossea, maggiore mobilità dentale e maggiore perdita di elementi dentari rispetto ai non fumatori39. Solomon e colleghi hanno determinato che le condizioni parodontali del fumatore sono almeno quindici anni più avanzate dello stato parodontale dei non fumatori della stessa età anagrafica40. Anche in individui al di sotto dei 40 anni di età, i fumatori mostrano parodontite e perdita di denti con incidenza doppia rispetto ai non fumatori. Data la disarmante evidenza dell’impatto negativo del tabacco sulla salute parodontale e sulla risposta a terapia parodontale, i Parameters of Care dell’American Academy of Periodontology raccomandano una terapia di cessazione dell’uso di tabacco per il paziente parodontale quando indicato41. È incoraggiante constatare che la progressione della malattia parodontale rallenta dopo la cessazione del fumo e questi pazienti hanno una risposta a terapia parodontale simile a quella dei pazienti che non hanno mai fumato. Questi fattori devono spingere l’odontoiatra a includere un’azione di counseling per la cessazione del tabacco all’interno del suo piano di trattamento42. Per comprendere l’influenza del fumo sui tessuti parodontali occorre valutare il modo in cui esso influenza da un lato la componente batterica orale (fattore eziologico primario di parodontite e perimplantite) e dall’altro la risposta dell’ospite all’infezione batterica, micotica e all’ingiuria chirurgica43. È dimostrato da numerosi studi che non esistono differenze significative nella quantità di placca presente in fumatori e non fumatori. Quello che differisce nei due gruppi è piuttosto la qualità della flora batterica. La tensione di ossigeno nella tasca parodontale o perimplantare del fumatore è significativamente minore nel fumatore, fattore che può favorire specie anaerobie più parodontopatogene44. Dati di uno studio nella contea di Erie dimostrano che il fumatore abituale ha una probabilità 3,1 volte maggiore di presentare infezione da Actinobacillus actinomycetemcomitans e 2,3 volte maggiore di essere infettato da Bacteroides forsythus rispetto a soggetti che abbiano cessato il fumo o non abbiano mai fumato45-47. Un altro studio dimostra che i soggetti fumatori rispondono undici volte più frequentemente dei non fumatori alla reazione BANA (idrolisi di benzoil-DL-argininanaftilamide), che dimostra la presenza di Porphyromonas gingivalis, Treponema denticola o Bacteroides forsythus48,49. Altri studi ancora dimostrano come nel fumatore queste specie siano più difficili da eliminare dopo terapia parodontale chirurgica o non chirurgica. Per quanto riguarda la risposta dell’ospite all’ingiuria chirurgica o batterica, esistono forti evidenze di come l’effetto vasocostrittore della nicotina ostacoli la rivascolarizzazione dell’osso e dei tessuti molli50,51, evento che può avere un notevole impatto negativo sulla guarigione delle ferite, specialmente dopo chirurgia resettiva, rigenerativa, mucogengivale e implantare. È stato dimostrato come la nicotina assorbita fumando una sigaretta possa produrre un effetto di vasocostrizione periferica rilevabile (flusso sanguigno ridotto del 40%) della durata di 30-50 minuti52. Pertanto, i fumatori pack-per-day sviluppano un’ipossia tissutale per un considerevole numero di ore ogni giorno53. In parte conseguenza del ridotto apporto sanguigno, è stato provato che il fumatore presenta una ridotta risposta infiammatoria e un minor volume di fluido crevicolare rispetto al non fumatore. I neutrofili sono la prima linea di difesa contro le infezioni batteriche, e nonostante i fumatori abbiano un numero di neutrofili circolanti significativamente più elevato dei non fumatori nel distretto periferico54, la loro funzione è ridotta: in particolare, sono emersi in differenti studi minori livelli di chemiotassi, di adesione e di fagocitosi55-57 (Figura 9). In vitro, l’esposizione di neutrofili stimolati a nicotina o al fumo di tabacco può inibire la produzione di superossido e perossido d’idrogeno58,59, così inficiando i meccanismi di uccisione dei batteri; al contrario, l’esposizione al fumo di neutrofili non stimolati pare aumentare lo stress ossidativo, così aumentando il danno tessutale attraverso meccanismi diretti e indiretti. La produzione di anticorpi è un altro meccanismo di difesa dell’ospite alterato dal fumo. È stato dimostrato che il fumo di tabacco riduce la concentrazione di IgG seriche, e tra queste in particolare anche di alcune IgG specifiche contro alcuni microorganismi parodontopatogeni60-62. Questo si verifica perché il fumo inibisce la proliferazione dei linfociti T e così indirettamente la funzione dei linfociti B e la produzione di anticorpi63. Un altro meccanismo attraverso cui il fumo ostacola la guarigione delle ferite è l’effetto sui fibroblasti tessutali: è stato dimostrato in vitro come alcuni componenti volatili del fumo (acroleina e acetaldeide) e la stessa nicotina riducano la produzione di fibronectina e collagene, mentre la sintesi di collagenasi è implementata64-67.
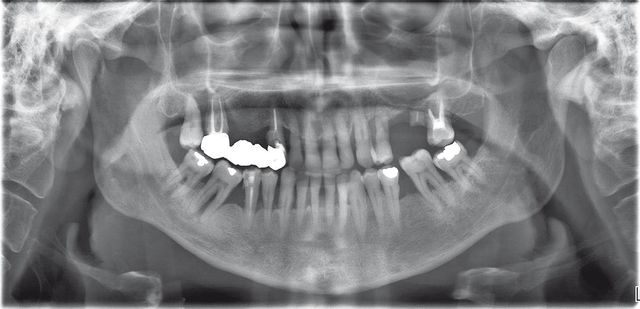
Gengivite ulcero-necrotizzante acuta (ANUG)
Questa patologia è strettamente correlata all’uso di tabacco68. Il 98% dei pazienti colpiti da ANUG è costituito da fumatori e i soggetti che fumano più di dieci sigarette al giorno mostrano una prevalenza di ANUG dieci volte maggiore rispetto ai non fumatori69,70. La precisa eziologia del fenomeno è naturalmente sconosciuta, ma insorge più frequentemente in adolescenti e giovani adulti e può essere determinata da una ridotta risposta dei granulociti neutrofili all’invasione batterica e probabilmente anche virale (citomegalovirus) dei tessuti gengivali. L’effetto vasocostrittore del tabacco pare contribuire fortemente alla necrosi e ulcerazione dolorosa che si osserva in questa patologia, ma lo stress emotivo e la scarsa igiene orale sembrano giocare un ruolo quasi altrettanto importante.
Guarigione ritardata delle ferite
Il fumatore mostra in generale una tendenza a una ritardata guarigione delle ferite orali, siano esse estrazioni dentali o riguardino chirurgia parodontale, implantare o chirurgia orale di routine. Questo può essere dovuto, come abbiamo visto, al diretto contatto dei costituenti del fumo con una ferita aperta, al ridotto flusso ematico, a una depressione della funzione leucocitaria, a una ridotta attività fibrinolitica o, ancora, all’effetto essiccante dell’aria calda respirata o alla rottura del coagulo ematico dovuta alla pressione intraorale negativa prodotta durante l’inalazione del fumo16. Per quanto riguarda le estrazioni dentali in particolare, i fumatori mostrano un riempimento ematico marcatamente ridotto dell’alveolo post-estrattivo ed evidenziano un’incidenza di alveolite secca cinque volte maggiore rispetto ai non fumatori. In generale, è stato dimostrato che il fumo nel periodo postestrattivo si associa allo sviluppo di alveoliti con un odd ratio di 3,5. Meechan e colleghi71 hanno valutato l’incidenza di alveolite dolorosa in 3541 estrazioni condotte in 2417 pazienti: i fumatori mostrano una più marcata tendenza a ridotto riempimento ematico dell’alveolo che pare associata allo sviluppo di dolore72 e si è dimostrato che i forti fumatori (20 o più sigarette al giorno) mostrano più elevata incidenza di alveolite dolorosa rispetto ai non fumatori. Lopez Carriches e colleghi nel loro studio osservano come dopo estrazione di terzi molari, i fumatori sono più esposti al rischio di sviluppare trisma rispetto ai non fumatori73. Per quanto riguarda in particolare gli effetti del fumo in implantologia, gli studi presenti in letteratura fanno riferimento ad alcuni parametri:
- sopravvivenza implantare: si riferisce alla presenza di un impianto con o senza complicanze. Se riportato, la perdita dell’impianto può essere precoce (prima del carico) o tardiva (dopo il carico);
- successo implantare: presenza di un impianto in assenza di complicanze di natura sia biologica sia tecnica. Vari autori hanno proposto numerosi criteri di successo;
- insorgenza di perimplantite;
- evidenza radiografica di perdita ossea marginale perimplantare.
I processi biologici coinvolti nell’osteointegrazione e nel mantenimento dei livelli ossei perimplantari sono influenzati dal fumo di tabacco e forniscono quindi una spiegazione del minor tasso di sopravvivenza e successo implantare nei fumatori74. Mentre il fumo di sigaretta non è una controindicazione assoluta al posizionamento di impianti, con la maggioranza degli studi che riportano un range di sopravvivenza implantare tra l’80 e il 96%, i fumatori dovrebbero essere avvisati che esiste un rischio maggiore di perdita degli impianti e di perimplantite: il rischio di fallimento implantare è descritto da un odd ratio tra 1,70 e 4,09 rispetto ai non fumatori a seconda delle varie metanalisi prese in esame (e dopo procedure di aumento osseo, l’odd ratio di insuccesso implantare nel fumatore oscilla tra il 2,26 e 5,77 rispetto al non fumatore). Il fattore di rischio o odd ratio per la perimplantite varia da 3,6 a 4,6 in letteratura. Bain e Moy75, nel 1993, furono i primi a valutare l’influenza del fumo sulla percentuale di fallimento degli impianti dentali: se quella complessiva si attestava intorno al 5,92, in accordo con altri studi, i fumatori facevano registrare un tasso di fallimenti dell’11,28 contro il 4,76 dei non fumatori. Successivamente altri studi ancora indicarono il fumo come una tra le principali cause di fallimento implantare76,77. Lo studio di Gorman e colleghi78 riporta invece un tasso di fallimento implantare nel fumatore del 6,50%, mentre un ulteriore studio retrospettivo di coorte di Moy e colleghi79 indica addirittura una percentuale di fallimento del 20 nel fumatore. Tutti gli studi confermano un maggior effetto negativo del fumo sugli impianti mascellari rispetto a quelli mandibolari, probabilmente a causa della maggior influenza sull’osso mascellare di qualità più scadente rispetto alla mandibola. L’insuccesso implantare precoce (nella fase precedente al carico) interessa dal 6,5 al 9% dei casi nel fumatore a seconda dei diversi studi, e dall’1 al 3,5% nel non fumatore. La perdita dell’impianto in fase precoce è in media del 31% nel fumatore e del 4% nel non fumatore. Sono necessari ulteriori studi per stabilire l’influenza di dose e durata del fumo di sigaretta sul successo implantare. Lo studio di Carcuac e Jansson80 dimostra che l’incidenza di perimplantite nei pazienti implantari non fumatori è del 64% mentre tale valore sale al 78% nei fumatori. Gli odd ratio per fumo e perimplantite riportati oscillano tra 3,6 e 4,6. La percentuale di successo a 5 anni degli impianti osteointegrati si aggira tra il 94 e il 97,5% a seconda dei vari studi. Il paziente fumatore deve preventivamente essere messo al corrente che il fumo aumenta da 4 a 6 volte il rischio di un insuccesso.
Carie
I clinici del diciannovesimo secolo erano convinti che il fumo di tabacco proteggesse dalla carie e ancora nel 1968 Schmidt fu in grado di affermare che la riduzione della carie dentale era l’unico vantaggio del fumo81. Gli studi più recenti hanno invece rilevato la presenza di una forte associazione tra fumo di sigaretta e un’aumentata incidenza di carie, anche se una vera e propria relazione di causaeffetto non è ancora stata dimostrata. I fumatori mostrano un numero di superfici dentali cariate o otturate significativamente più alto rispetto ai non fumatori, e i forti fumatori risultano più colpiti dei fumatori moderati. È stato suggerito che il gruppo dei fumatori abbia uno standard di igiene orale inferiore e minori capacità tecniche, faccia più rari controlli dal dentista e presenti in generale una minore attenzione alle proprie condizioni di salute. Questi fattori non sono stati messi sotto controllo negli studi precedenti ma potrebbero essere la reale spiegazione dell’aumentata incidenza di carie. Anche il tabacco da masticazione sembra incrementare l’insorgenza di carie, forse come conseguenza del fatto che più di un quinto del contenuto di alcune marche di tabacco non da fumo è costituito da zucchero, e alcune di esse sono addirittura in grado di svolgere il ruolo di terreno di coltura per alcuni ceppi batterici cariogeni82.
Abrasione
L’abrasione dentale consistente in una perdita di tessuto duro sul margine incisale o all’apice delle cuspidi, talvolta associata a migrazione degli elementi interessati, è un evento classicamente collegato all’uso di una pipa mantenuta sempre nella stessa posizione. I fumatori di sigarette non sembrano mostrare un incremento dell’abrasione dentale, mentre questa è certamente dimostrata nei soggetti che fanno uso di tabacco non da fumo da molti anni, specialmente se vivono o lavorano in ambienti molto polverosi.
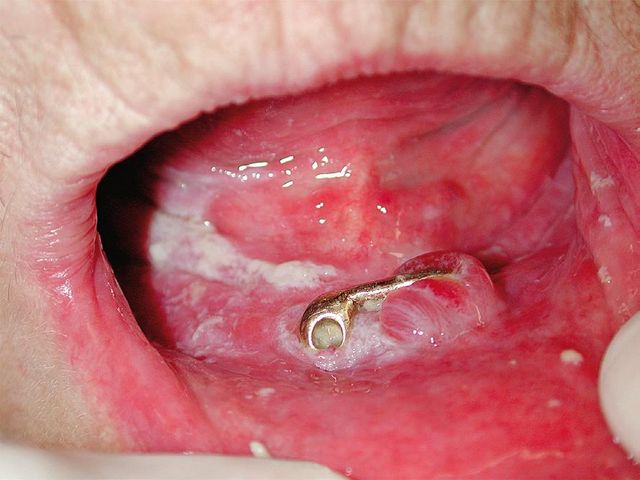
Candidosi orale
La maggior parte dei pazienti affetti da candidosi orale (83%) è da moderata a forte fumatrice di sigarette (Figura 10). Candida albicans, un normale saprofita della mucosa orale di circa il 50% degli individui normali sani (non portatori di protesi), può essere diversamente influenzata dal fumo di tabacco e variabilmente aumentare o ridurre la sua crescita in differenti individui83 (Figura 11).
Sinusite
I fumatori di tabacco sono più interessati da sinusite mascellare rispetto ai non fumatori e questa condizione si risolve del tutto o si riduce significativamente dopo la cessazione del vizio84. Questo effetto è probabilmente imputabile a un edema tabacco-correlato della mucosa sinusale e a ridotta mobilità ciliare dell’epitelio respiratorio sinusale. L’edema tende a ridurre l’ampiezza degli osti meato-antrali mentre l’indebolito movimento ciliare inficia la clearance sinusale di muco e batteri.
Alterazione del gusto
Gli individui hanno soglie predeterminate per la percezione di sensazioni olfattive e gustative. È ben noto che il fumo di tabacco innalza fortemente queste soglie, riducendo perciò la nostra abilità di percepire vari gusti e odori. Per quanto riguarda il gusto, è stata dimostrata un’associazione dose-dipendente per il gusto amaro, e in misura minore per il salato, ma pare esservi lieve cambiamento nella percezione delle sostanze dolci o acide nel fumatore85. La ridotta acuità gustativa peggiora progressivamente con ogni addizionale anno di uso di tabacco. Il tabacco da masticazione sembra avere poca o nessuna influenza sull’acuità gustativa.
Ulcere aftose
La stomatite aftosa ricorrente è sicuramente dolorosa e molto comune; colpisce circa il 10-20% della popolazione generale e fino al 50% dei professionisti sanitari. Piuttosto che determinare o indurre questo disturbo ulcerativo, il fumo di tabacco sembra prevenire la sua insorgenza o ridurne gli effetti86. Le afte spesso compaiono o ri-compaiono in individui che smettono di fumare e quasi tutti i soggetti colpiti (96%) sono non fumatori (Figura 12). Le ragioni di questa “protezione” non sono chiare, ma potrebbero essere legate all’aumento della cheratinizzazione degli epiteli orali o a una minore risposta immunitaria dell’ospite agli antigeni batterici.
Alitosi
Sia il tabacco da fumo che quello da masticazione producono alito cattivo. Per quanto riguarda il fumo, l’alitosi è prevalentemente determinata dal fumo trattenuto nei polmoni e poi espirato. A prescindere dal metodo di assorbimento, comunque, numerosi composti nocivi penetrano nell’organismo dai polmoni a livello dell’interfaccia aria/sangue. Il tabacco da pipa e quello da sigaro contengono più zolfo rispetto a quello delle sigarette, perciò chi ne fa uso presenta una più accentuata alitosi rispetto ai fumatori di sigarette.
Pigmentazione dei denti e di protesi dentarie
La macchia di tabacco, una pigmentazione estrinseca marrone/nera, è tipicamente individuabile sulla superficie smaltea di fumatori e utilizzatori di tabacco da masticazione. Essa è specialmente pronunciata nelle zone cervicali e sull’aspetto linguale degli elementi frontali. La sua intensità dipende più dalla quantità di placca e tartaro presenti che non dalla quantità di tabacco usato, ma come osservazione generale i fumatori mostrano il doppio delle macchie rispetto ai non fumatori. La pigmentazione delle protesi con il tabacco da fumo è un grosso problema perché queste sono talvolta così profondamente imbevute di pigmento da non poter essere deterse mediante prodotti di pulizia per protesi mobili. Questo fenomeno è particolarmente accentuato nei soggetti con scarsa igiene orale, probabilmente a causa del rammollimento delle plastiche prodotto dagli acidi secreti dalla placca batterica87. Il fumo è stato accertato accentuare anche le proprietà pigmentanti delle soluzioni e gel di clorexidina.
Fumo ed estetica facciale
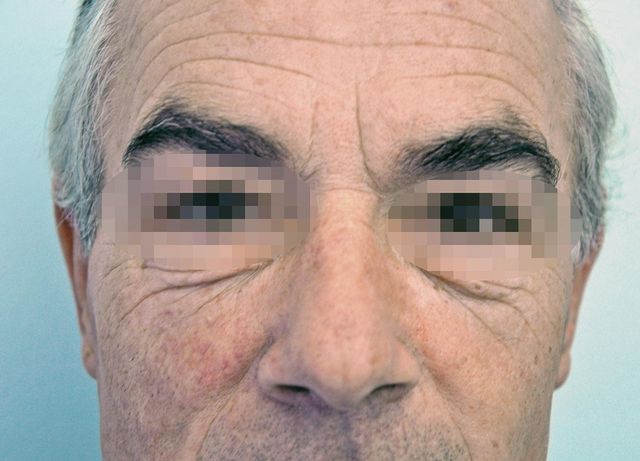
I primi studi che hanno documentato gli effetti del fumo sulla pelle risalgono alla metà del secolo scorso: furono osservati sia la comparsa di rughe sia la perdita di elasticità della pelle, che conferiscono al fumatore incallito un aspetto tipico, codificato nel 1985 come “faccia da fumatore” dal dr. Douglas Model, che coniò il termine per un articolo pubblicato dal British Medical Journal. Il viso del fumatore, tipicamente, è scavato, ponendo in risalto le prominenze ossee dello scheletro facciale e il rivestimento cutaneo appare cosparso di macchie e di colorito giallo-grigiastro, a volte soffuso da un costante eritema. La superficie è solcata da una miriade di rughe, che ricordano quelle tipiche del fotoinvecchiamento, ma insorgono a parità di esposizione solare, in netto anticipo rispetto ai non fumatori. Sono tipiche quelle intorno alla bocca, accentuate dai movimenti di mimica labiale indotti dall’atto del fumare (Figura 13). È ormai chiaro il legame tra fumo e invecchiamento cutaneo: i fumatori intorno ai 50 anni hanno molte più rughe dei loro coetanei che non fumano, ma già prima dei 30 la differenza può essere evidente88,89. I danni legati a questa abitudine non sono visibili subito poichè il processo è lento e sono necessari ben 10 anni per poter notare quello che dermatologicamente viene descritto come smoker’s face e che, ovviamente, non coinvolge soltanto la pelle del viso90. Ultimamente le donne sembrerebbero esserne più consapevoli, specialmente le quarantenni, mentre le giovanissime sembrano ancora incuranti del problema estetico legato al fumo91. L’uomo sembrerebbe meno preoccupato da questa evenienza, dal momento che nella società occidentale l’aspetto della pelle del viso maschile non pare essere ancora un fattore di centrale importanza, per quanto molti uomini inizino a usare creme e cosmetici per il volto nonché a metodiche biorivitalizzanti e iniettive per aumento volumetrico dei difetti facciali. Fumare significa aumentare il processo di ossidazione della pelle e rallentare la microcircolazione dermica. Questi fenomeni portano a effetti ben manifesti dopo 10 anni.
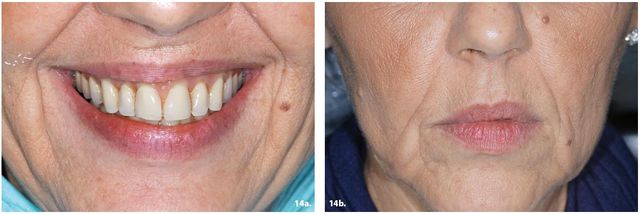
Aumento delle rughe
La produzione di radicali liberi subisce un incremento e compromette la sintesi di collagene ed elastina. Contemporaneamente si osserva un’aumentata attività delle metalloproteinasi, enzimi deputati alla degradazione dello stesso collagene; si riduce la quantità d’acqua transepidermica e quindi lo spessore della cute92,93. Tutto ciò determina un incremento delle cosiddette “zampe di gallina”, delle rughe perioculari e naso labiali, mentre le guance perdono tono e appaiono flaccide o scavate (Figura 14a e 14b).
Colorito spento
La vasocostrizione cutanea riduce l’apporto di nutrienti e ossigeno, determinando un caratteristico colorito spento, disomogeneo, pallido o arrossato.
Couperose
I capillari perdono elasticità e la cute è più soggetta a eritema e irritazione94.
Rischio cellulite
L’alterazione della microcircolazione favorisce il ristagno dei liquidi e provoca una riduzione del metabolismo95.
Minori difese
Gran parte delle molecole antiossidanti dell’organismo viene consumata per contrastare l’azione tossica sistemica della sigaretta e si riduce la concentrazione di vitamina A, responsabile del mantenimento della corretta differenziazione degli epiteli; la cute pertanto subisce maggiormente lo stress degli agenti ambientali96. Anche i gesti rituali che accompagnano ogni sigaretta accesa favoriscono una serie di inestetismi: il continuo movimento delle labbra per aspirare il fumo accentua le rughe in questa zona già molto fragile. Il fumo che si innalza dopo ogni aspirazione è nocivo quanto il fumo aspirato: l’irritazione degli occhi provoca frequenti lacrimazioni e contrazioni palpebrali che favoriscono la formazione di microrughe97,98. La nicotina provoca inoltre macchie antiestetiche in punti sensibili: dita, unghie e, naturalmente, denti. Per quanto riguarda in particolare le unghie, quelle delle dita che sorreggono la sigaretta presentano una colorazione giallastra tanto evidente che, se si interrompe bruscamente di fumare, si sviluppa una distinta linea di demarcazione sulle unghie che scompare con la crescita completa.
Acne
Uno studio dell’ospedale San Gallicano di Roma ha recentemente individuato l’insorgenza di una nuova forma d’acne di difficile trattamento legata alla dipendenza da tabacco fra le donne92. Questa lesione, definita Acne Comedogena Post Adolescenziale (CPAA), può estendersi talvolta a tutto il volto e determinare un forte impatto psicologico. Il campione, oggetto di rilevazioni lungo un arco di tempo di 8 anni, ha visto la partecipazione di 226 donne acneiche di età compresa tra i 25 e i 50 anni e la CPAA è stata riscontrata nell’85% delle pazienti esaminate, le quali infatti presentano una maggioranza di lesioni non infiammatorie, con numerosi comedoni, distribuite uniformemente su tutto il volto. Comedoni chiusi, dalle dimensioni di piccole cisti o aperti e dilatati, cicatrici a punteruolo e lievi fenomeni infiammatori sono i tipici segni dell’acne da fumo. Sono soprattutto le donne fra i 25 e i 50 anni a soffrirne, e le probabilità aumentano di 4 volte in coloro che hanno già avuto problemi di acne giovanile. A convincere i medici della correlazione della patologia con la dipendenza da tabacco è l’aver constatato che ben il 71,4% di queste donne fuma abitualmente. Dallo studio citato è emersa una differenza tra le donne affette da acne insorta in età adolescenziale e quelle che l’hanno contratta dopo i 25 anni. Nel primo gruppo le fumatrici rappresentano il 65%, mentre la cifra sale all’83,3 nelle donne che hanno sviluppato acne in età adulta. Ciò potrebbe indicare che il fumo ha un ruolo di induzione dell’acne a esordio tardivo. Gli effetti ipercheratinizzanti del fumo di sigaretta sono noti da tempo e, uniti alle proprietà vasocostrittive e anti-infiammatorie della nicotina, potrebbero spiegare la natura delle lesioni caratteristiche della CPAA.
Relazioni con la calvizie
A livello del cuoio capelluto si riscontra un aumento della produzione di radicali liberi; la minore ossigenazione e il minor apporto di nutrienti si riflettono anche sulla forza e vitalità della fibra capillare, che appare spenta, senza corpo e più fragile. Smettere di fumare, già dalla prima settimana contribuisce, invece, a rendere i capelli più luminosi, puliti e vitali; quando vi sia caduta dovuta all’atrofia dei bulbi capillari la cessazione del fumo può contribuire ad arrestarla. Per quanto riguarda invece in particolare la calvizie androgenetica, uno studio effettuato alla Harvard School of Public Health99 mostra che il fumo incrementa quasi tutti i maggiori ormoni androgeni, inclusi DHEA, androstenedione, testosterone e di-idrotestosterone (DHT, l’ormone maggiormente responsabile della calvizie androgenetica). Lo studio interessa 1241 uomini di mezza età, comparando i livelli ormonali di fumatori e non fumatori. Lo studio mostra come il DHEA è più alto del 18% nei fumatori, il DHEAS è del 13%, l’androstenedione del 33%, il testosterone del 9% e il DHT del 13%. È ben noto che livelli più alti di testosterone e DHT sono associati a livelli più alti nella caduta dei capelli. Fumare non farà cadere i capelli a chi non è predisposto geneticamente, ma smettere di fumare aiuterà a prevenire la caduta in chi è predisposto. Fumare inoltre può peggiorare una calvizie androgenetica già in atto. Uno studio del Far Eastern Memorial Hospital di Taipei (Taiwan) condotto su un campione di 740 uomini ha appurato che le sigarette nel lungo periodo compromettono il microcircolo, alterando il modo in cui il sangue irrora i follicoli del cuoio capelluto e aumentando così la gravità di un principio di calvizie100.
Prevenzione
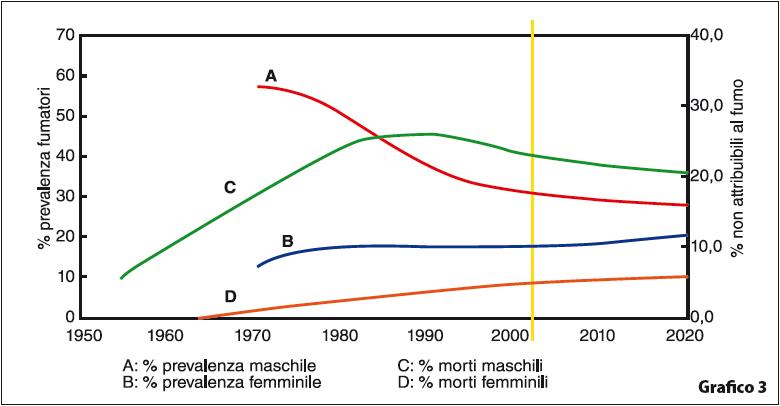
A oggi, la sola nazione al mondo ad aver completamente bandito la vendita e la pratica del fumo di tabacco è il Buthan. Lo stato della California è stato il primo a vietare il fumo nei luoghi di lavoro, nel 1994, e in tutti gli spazi chiusi nel 1998. In Europa, l’Irlanda è stata la prima nazione a proibire il fumo in tutti i luoghi di lavoro chiusi, nel 2004; nel Regno Unito tale normativa è entrata in vigore il 1º luglio 2007; in Danimarca il fumo è vietato in bar, club e ristoranti dal 15 agosto 2007; in Olanda e Romania dal 1º luglio 2008; attualmente la nazione più popolosa ad aver completamente bandito il fumo negli spazi chiusi è la Francia, ove la normativa è entrata in vigore il 1º gennaio 2008. Il 2 gennaio 2011 anche la Spagna ha introdotto tale normativa. In Italia il 10 gennaio 2005 è entrata in vigore la legge proposta dal Ministro della Salute Girolamo Sirchia che decreta il divieto di fumare nei locali pubblici, a eccezione dell’introduzione di apposite sale fumo. Le sale fumatori sono soggette a pesanti restrizioni: devono essere ventilate separatamente, con specifici valori circa il tasso di ricambio dell’aria; la pressione atmosferica in tali sale deve essere costantemente più bassa di quella delle sale adiacenti; devono essere munite di porte scorrevoli a chiusura automatica. Al momento solo l’1% dei locali pubblici ha introdotto una sala fumatori a causa dell’elevato costo degli adeguamenti. Se da un lato la legge Sirchia nel 2005 ebbe un impatto molto forte sui fumatori incalliti che intesero la nuova normativa antifumo come una privazione della propria libertà, a distanza di anni tale decreto si è rivelato importantissimo per ridurre l’incidenza di tumori e malattie provocate dal fumo (Grafico 3).
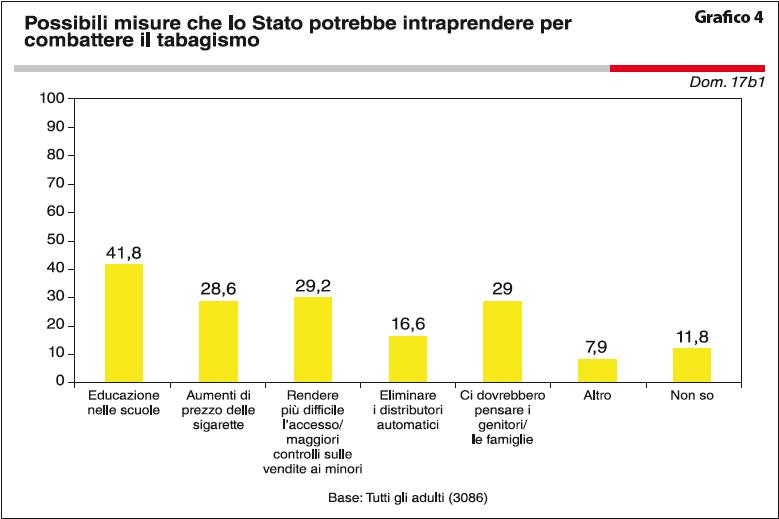
Le statistiche confermano che con l’entrata in vigore della legge antifumo molti fumatori hanno quantomeno tentato di smettere di fumare avvalendosi dei più disparati metodi, dai più efficaci ai meno efficaci, dai più convenienti ai più dispendiosi. Basti pensare che dal 2005 a oggi solo in Italia l’uso di pastiglie alle erbe, cerotti alla nicotina o trattamenti farmacologici mirati per smettere di fumare è aumentato ben del 39%. A distanza di 5 anni dall’approvazione della legge Sirchia, la vendita delle sigarette è calata del 7,2% e i 98,9 milioni di chili di sigarette vendute nel 2004 si sono ridotti a 92,7 milioni. L’ultima campagna nazionale contro il tabagismo promossa dal Ministero della Salute risale al 2010 e si è avvalsa di uno spot radiofonico, uno spot televisivo e uno cinematografico. Chi voglia smettere di fumare e non trovi adeguata motivazione per farlo autonomamente può avvalersi in Italia di differenti metodi che includono consulenza psicologica, terapia farmacologica sostitutiva mirata, uso di bocchini inalatori, di sigarette elettroniche, di agopuntura e di cerotti e gomme a base di nicotina. Sono ormai numerosi i centri antifumo attivi in tutto il territorio nazionale, molti dei quali operanti presso le Aziende Sanitarie Locali (ASL), le Aziende Ospedaliere, oppure sotto l’egida della Lega Italiana per La Lotta contro i Tumori (LILT), della Fondazione IRCCS Istituto Nazionale dei Tumori o della Lega Italiana Anti Fumo (LIAF). È attivo anche un servizio gratuito di consulenza telefonica: l’Istituto Superiore di Sanità (ISS) svolge attività di consulenza, supporto e informazione sulle  problematiche legate al tabagismo attraverso il Telefono Verde contro il Fumo 800 554088 dell’Osservatorio Fumo, Alcol e Droga. Presso la LILT è invece attivo il numero verde 800 998877, unica Quit-Line presente in Italia, un servizio telefonico condotto da figure professionali, medici e psicologi della Lega Tumori per aiutare “a distanza” quei fumatori che non hanno la possibilità di seguire direttamente, in un servizio territoriale, un programma di supporto per smettere di fumare. Tuttavia, sulla base dell’indagine annuale DOXA 2012 sul fumo commissionata dall’Istituto Superiore di Sanità, Istituto di Ricerche Farmacologiche Mario Negri e Osservatorio Fumo Alcool e Droga (OSSFAD)4, ben il 96% di ex-fumatori dichiara di aver cessato il vizio del fumo autonomamente e senza alcun supporto (Tabella 1). Dalla stessa indagine è tratto anche il seguente Grafico 4 le possibili misure che lo Stato potrebbe incrementare, secondo il parere del campione intervistato, per potenziare la lotta al fumo.
problematiche legate al tabagismo attraverso il Telefono Verde contro il Fumo 800 554088 dell’Osservatorio Fumo, Alcol e Droga. Presso la LILT è invece attivo il numero verde 800 998877, unica Quit-Line presente in Italia, un servizio telefonico condotto da figure professionali, medici e psicologi della Lega Tumori per aiutare “a distanza” quei fumatori che non hanno la possibilità di seguire direttamente, in un servizio territoriale, un programma di supporto per smettere di fumare. Tuttavia, sulla base dell’indagine annuale DOXA 2012 sul fumo commissionata dall’Istituto Superiore di Sanità, Istituto di Ricerche Farmacologiche Mario Negri e Osservatorio Fumo Alcool e Droga (OSSFAD)4, ben il 96% di ex-fumatori dichiara di aver cessato il vizio del fumo autonomamente e senza alcun supporto (Tabella 1). Dalla stessa indagine è tratto anche il seguente Grafico 4 le possibili misure che lo Stato potrebbe incrementare, secondo il parere del campione intervistato, per potenziare la lotta al fumo.
Negli ultimi mesi si è assistito a un vero e proprio boom di vendite della sigaretta elettronica. Se fino a pochi anni fa era un fenomeno limitato a pochi utenti della rete che acquistavano dispositivi e liquidi dalla Cina, l’intuizione del business legato al fumo elettronico ha portato al fiorire di catene e negozi specializzati, che sono oggi più di mille in Italia. Gli amanti di questi dispositivi ne fanno uso ovunque, dai bar ai ristoranti e alle biblioteche. Quanto ai dati statistici, facciamo ancora riferimento all’indagine Doxa: il 20% dei fumatori italiani usa o intende usare la sigaretta tecnologica. Tradotto in numeri assoluti, oltre due milioni di nostri connazionali sono potenziali consumatori di questo prodotto. E, stando all’Osservatorio fumo, alcol e droga dell’Istituto, il sondaggio non registra “l’impressionante boom degli ultimi mesi”. Per quanto riguarda i potenziali pericoli per la salute, l’Osservatorio sottolinea che si tratta di prodotti sicuramente molto meno tossici delle tradizionali sigarette a combustione. Nonostante ciò, non vi sono ancora studi autorevoli che dimostrino la totale atossicità del fumo elettronico, e a ciò si aggiunge la preoccupazione legata alle miscele nicotiniche vendute su internet, non sottoposte a efficaci controlli ed esposte al rischio di contraffazione. Il Grafico 5, tratto dal quotidiano La Repubblica, sintetizza la struttura e il funzionamento di una sigaretta elettronica. Il Governo ha recentemente presentato un emendamento alla legge di Stabilità che equipara la sigaretta elettronica alle normali sigarette: se sarà approvato questi dispositivi verranno assimilati ai tabacchi lavorati e sottoposti alle stesse disposizioni in materia di distribuzione, detenzione e vendita. Diventeranno fuorilegge nei locali pubblici, non potranno essere venduti nei negozi ma soltanto nelle tabaccherie. Ovviamente questo emendamento ha sollevato forti proteste da parte della neonata associazione di categoria (ANAFE) e delle associazioni per la lotta al fumo, prima fra tutte la LIAF, che vedono nella e-cigarette un valido rimedio alla ben più pericolosa dipendenza dal fumo di tabacco.
Conclusioni
Come abbiamo visto, il fumo rappresenta uno dei principali fattori di rischio per i carcinomi del cavo orale. Si tratta di un problema di notevole rilevanza: il cancro orale e della faringe è fra i più importanti nell’uomo, occupando infatti l’ottavo posto fra i tumori più frequenti al mondo. Si tratta di un dato preoccupante poiché è paradossale che un tumore che “si vede”, come appunto quello che si sviluppa all’interno della bocca, in realtà non venga individuato e diagnosticato tempestivamente. Il fumo produce il suo effetto negativo anche sui risultati delle nostre terapie, in particolare in campo parodontale e implantare. In un piano di trattamento implantare ad esempio, il ruolo del fumo diventa estremamente importante in quanto espone a un maggior rischio di insuccessi terapeutici. In particolare, si stima che le percentuali di fallimento dell’impianto nei fumatori siano intorno all’11,3%, contro il 4,8 dei non fumatori. Entrambi questi aspetti, cioè la correlazione fra fumo e malattia parodontale e fra fumo e implantologia, rappresentano un ottimo spunto di dialogo fra l’odontoiatra e il paziente sull’opportunità di smettere di fumare. Dal momento che la placca e il fumo costituiscono i due principali fattori di rischio della malattia parodontale e perimplantare, è contraddittorio intervenire per rimuovere la placca, consentendo però al paziente di continuare a fumare in tutta tranquillità. Il fumo genera inoltre pigmentazioni sui denti e ciò rende meno efficaci le tecniche di sbiancamento; analogamente, affrontare il problema dell’alitosi significa migliorare l’estetica del respiro: è indubbio che il fumatore abbia un alito peggiore rispetto al non fumatore e rientra fra i compiti dell’odontoiatra affrontare anche questo problema. Alcuni studi su un vastissimo numero di bambini hanno inoltre dimostrato che in caso di convivenza con genitori che fumano si osserva una maggiore incidenza di carie. Tutte le condizioni che conducono a un indebolimento delle difese immunitarie devono pertanto essere considerate con attenzione per i risvolti negativi che presentano nel tempo. Lo studio dentistico può quindi a ragion veduta diventare un punto di riferimento nella lotta contro il fumo, promuovendo così stili di vita positivi. Gli studi odontoiatrici sono infatti le prime strutture sanitarie in cui è possibile riconoscere il paziente fumatore e incentivarne la propensione a smettere: un punto di partenza estremamente importante per conquistare uno stato di maggiore salute. Nello studio dentistico i danni causati dal fumo sono facilmente dimostrabili, e mettere il paziente fumatore di fronte alle conseguenze tangibili delle proprie abitudini di vita può costituire uno stimolo efficace a modificarle. Pertanto, promuovere e responsabilizzare lo studio odontoiatrico come polo di orientamento nella lotta contro il fumo risulta una valida scommessa, un gradino importante per proporre e conquistare un maggiore benessere complessivo del nostro paziente. Oltre agli ormai inconfutabili problemi di salute legati al fumo di sigaretta, non appare poi così tanto immotivato parlare di bellezza. Oggi più che mai diventa importante una visione diversa, una medicina diversa capace di prevenire le intossicazioni e curarne i disturbi. La bellezza della pelle, dei capelli e dei tessuti del corpo dipende dalla salute e dall’energia vitale. Un corpo energico e vitale risulta bello indipendentemente dall’età, così come un viso è bello anche se anziano se rimane elastico e con un colorito sano. Anche le emozioni e l’atteggiamento mentale sono decisivi per perseguire un benessere a 360 gradi. Si è visto come il fumo conduca a un invecchiamento precoce e oltretutto non fisiologico, e che gli atteggiamenti posturali del fumatore e i suoi gesti rituali provochino fastidiosi inestetismi, rigidità e contratture del volto difficili da rimediare. Un comportamento sbagliato dunque e che non deve appartenerci, condizionato e senza vantaggi alcuni, e che purtroppo colpisce sempre più frequentemente la giovane popolazione, che cerca di trovare nel fumo “respiro” al disagio che sta vivendo… un “respiro” che uccide.
Corrispondenza
Luigi Paglia
Fondazione ISI
Tel. 02.54176300 (Ilaria Bombelli)
Nota
Il presente lavoro è stato supportato dalla Fondazione ISI, dalla Fondazione Veronesi e dalla Fondazione Andi Onlus.
Bibliografia
1.Balaji SM. Tobacco smoking and surgical healing of oral tissues: A review. Indian J Dent Res 2008;19:344-8.
2. World Health Organization. WHO Report on the Global Tobacco Epidemic, 2011.
3. European Commission. Eurobarometer. Survey on Tobacco-Analytical report, March 2009.
4. Istituto Superiore di Sanità. Indagine Doxa: Il fumo in Italia, 2012.
5. Wynder EL, Hoffmann D. Tobacco and tobacco smoke. Semin Oncol 1976 Mar;3(1):5-15.
6.Ministero del Lavoro, della Salute e delle Politiche Sociali. I danni derivati dal consumo di sigarette, 5 febbraio 2009.
7.Surgeon General’s Report . Executive summary. The Health Consequences of Smoking, tabella 1.1 (pp. 2-6). Centers for Disease Control and Prevention, 2004.
8.Mokdad AH, Marks JS, Stroup DF, Gerberding JL. Actual causes of death in the United States. The Journal of the American Medical Association 2004;291(10):1238-1245.
9. Mokdad AH, Marks JS, Stroup DF, Gerberding JL. Actual causes of death in the United States, 2000. JAMA 2004;291(10):1238-45.
10. International Agency for Research on Cancer. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, 2004;83:59-60 e seguenti (Tobacco smoke - composition).
11.Herraiz T, Chaparro C. Human monoamine oxidase is inhibited by tobacco smoke: beta-carboline alkaloids act as potent and reversible inhibitors. Biochem Biophys Res Commun 2005;326(2):378-86.
12.Hughes JR. Effects of abstinence from tobacco: valid symptoms and time course. Nicotine Tob Res 2007;9(3):315-27.
13. Haldane J. The action of carbonic oxide on man. J Physiol 1985;18:430-462.
14. Quello che fa male delle sigarette. Corriere della Sera.
15. Feng Z, Hu W, Hu Y, Tang M. Acrolein is a major cigarette-related lung cancer agent: Preferential binding at p53 mutational hotspots and inhibition of DNA repair. Proceedings of the National Academy of Sciences 2006;103(42):15404-15409.
16. 48. Fritz HG, Schwenzer N. Thermal damage to the oral mucosa due to smoking. Quintessenz. 1984;35(4):777-89.
17. Bouquot J, Schroeder K. Oral Effects of Tobacco Abuse. Journal of the American Dental Institute for Continuing Education 1992;43:3-17.
18.Axéll T, Hedin CA. Epidemiologic study of excessive oral melanin pigmentation with special reference to the influence of tobacco habits. Scan J Dent Res 1982;90:434-442.
19. Bouquot JE, Schroeder KL, Glover ED. Leukoplakia and smokeless tobacco keratosis: two separate and distinct precancers. In: Varma AD (ed). Oral oncology. Delhi: MacMillan India, Ltd, 1991;2:67-69.
20.Christen AG, McDonald JL Jr, Christen JA. The impact of tobacco use and cessation on nonmalignant and precancerous oral and dental diseases and conditions. Indianapolis, Indiana: Indiana University 1989:1-74.
21. Christen AG. The four most common alterations of the teeth, periodontium and oral soft tissues observed in smokeless tobacco users: a literature review. J Indiana Dent Assoc 1985;64:15-18.
22.Glover ED, Schroeder KL, et al. An interpretive review of smokeless tobacco research in the United States: Part I. J Drug Educ 1988;16:285-310.
23.Bhonsle RB, Murti PR, Daftary DK, et al. Regional variations in oral submucous fibrosis in India. Community Dent Oral Epidemiol 1987;15:225-229.
24. Van Wyk CW. An investigation into the association between leukoedema and smoking. J Oral Pathol 1985;14:491-499.
25. Axéll T, Henricsson V. Leukoedema - an epidemiologic study with special reference to the influence of tobacco habit. Comm Dent Oral Epidemiol 1981;9:142-146.
26. Bouquot JE. Reviewing oral leukoplakia; clinical concepts for the 1990s. JADA 1991;122:80-82.
27. Bouquot JE, Weiland LH, Kurland LT. Leukoplakia and carcinoma in situ synchronously associated with invasive oral/pharyngeal carcinoma in Rochester, Minnesota, 1935-1984. Oral Surg Oral Med Oral Pathol 1988;65:199-207.
28. Tabor MP, Brakenhoff RH, Ruijter-Schippers HJ, et al. Multiple head and neck tumors frequently originate from a single preneoplastic lesion. Am J Pathol 2002;161:1051-60.
29. Scully C, Boyle P, Chiesa F, Lefebvre JL, Macfarlane GJ, Blot WJ, Mano Azul A, De Vries N. European School of Oncology advisory report to the European Commission for the Europe against cancer programme: oral carcinogenesis in Europe. Oral Oncol, Eur J Cancer 1995;31(2):75-85.
30. Bergstrom J, Senkel H. Influence of smoking on gingival bleeding in periodontal patients. J Dent Res 1988;67:687.
31.Robertson PB, Walsh M, Greene J, Ernster V, Grady D, Hauck W. Periodontal effects associated with the use of smokeless tobacco. J Periodontol 1990;61:438-43.
32.Greer RO Jr, Poulson TC. Oral tissue alterations associated with the use of smokeless tobacco by teen-agers. Part I. Clinical findings. Oral Surg Oral Med Oral Pathol 1983;56:275-84.
33.Poulson TC, Lindenmuth JE, Greer RO Jr. A comparison of the use of smokeless tobacco in rural and urban teenagers. CA Cancer J Clin 1984;34:248-61.
34.Linden GJ, Mullally BH. Cigarette smoking and periodontal destruction in young adults. J Periodontol 1994;65:718-23.
35.Feldman RS, Bravacos JS, Rose CL. Association between smoking different tobacco products and periodontal disease indexes. J Periodontol 1983;54:481-7.
36.Bergstrom J. Tobacco smoking and supragingival dental calculus. J Clin Periodontol 1999;26:541-7.
37.Tonetti MS. Cigarette Smoking and Periodontal Diseases: Etiology and Management of Disease. Ann Periodontol 1998 Jul;3:88-101.
38.Johnson GK, Hill M. Cigarette smoking and the periodontal patient. J Periodontol 2004 Feb;75(2):196-209.
39.Ahlqwist M, Bengtsson C, Hollender L, et al. Smoking habits and tooth loss in Swedish women. Comm Dent Oral Epidemiol 1989;17:144-147.
40.Solomon HA, Priore RL, Bross ID. Cigarette smoking and periodontal disease. J Am Dent Assoc 1968 Nov;77(5):1081-4.
41.American Academy of Periodontology. Parameters of Care. J Periodontol 2000;71:i-ii,847-83.
42. Terrades M, Coulter WA, Clarke H, Mullally BH, Stevenson M. Patients’ knowledge and views about the effects of smoking on their mouths and the involvement of their dentists in smoking cessation activities. Br Dent J 2009 Dec 12;207(11):E22; discussion 542-3.
43.Johnson GK, Slach NA. Impact of tobacco use on periodontal status. J Dent Educ 2001 Apr;65(4):313-21.
44.Hanioka T, Tanaka M, Takaya K, Matsumori Y, Shizukuishi S. Pocket oxygen tension in smokers and non-smokers with periodontal disease. J Periodontol 2000;71:550-4.
45.Zambon JJ, Grossi SG, Machtei EE, Ho AW, Dunford R, Genco RJ. Cigarette smoking increases the risk for subgingival infection with periodontal pathogens. J Periodontol 1996;67:1050-4.
46.Grossi SG, Zambon JJ, Ho AW, et al. Assessment of risk for periodontal disease. I. Risk indicators for attachment loss. J Periodontol 1994;65:260-7.
47.Grossi SG, Genco RJ, Machtei EE, et al. Assessment of risk for periodontal disease. II. Risk indicators for alveolar bone loss. J Periodontol 1995;66:23-9.
48. Loesche WJ, Bretz WA, Kerschensteiner D, et al. Development of a diagnostic test for anaerobic periodontal infections based on plaque hydrolysis of benzoyl-DL-arginine-naphthylamide. J Clin Microbiol 1990;28:1551-9.
49. Kazor C, Taylor GW, Loesche WJ. The prevalence of BANA-hydrolyzing periodontopathic bacteria in smokers. J Clin Periodontol 1999;26:814-21.
50. Riebel GD, Boden SD, Whitesides TE, Hutton WC. The effect of nicotine on incorporation of cancellous bone graft in an animal model. Spine 1995;20:2198-202.
51. Mosely LH, Finseth F, Goody M. Nicotine and its effect on wound healing. Plast Reconstr Surg 1978;61:570-5.
52. Sessler DI. Non-pharmacologic prevention of surgical wound infection. Anesthesiol Clin2006 Jun;24(2):279-97.
53. Jensen JA, Goodson WH, Hopf HW, Hunt TK. Cigarette smoking decreases tissue oxygen. Arch Surg 1991 Sep;126(9):1131-4.
54.Noble RC, Penny BB. Comparison of leukocyte count and function in smoking and nonsmoking young men. Infect Immun 1975;12:550-5.
55.Kraal JH, Kenney EB. The response of polymorphonuclear leukocytes to chemotactic stimulation for smokers and non-smokers. J Periodontal Res 1979;14:383-9.
56.Kenney EB, Kraal JH, Saxe SR, Jones J. The effect of cigarette smoke on human oral polymorphonuclear leukocytes. J Periodontal Res 1977;12:227-34.
57.MacFarlane GD, Herzberg MC, Wolff LF, Hardie NA. Refractory periodontitis associated with abnormal polymorphonuclear leukocyte phagocytosis and cigarette smoking. J Periodontol 1992;63:908-13.
58.Pabst MJ, Pabst KM, Collier JA, et al. Inhibition of neutrophil and monocyte defensive functions by nicotine. J Periodontol 1995;66:1047-55.
59. Ryder MI, Fujitaki R, Johnson G, Hyun W. Alterations of neutrophil oxidative burst by in vitro smoke exposure: implications for oral and systemic diseases. Ann Periodontol 1998;3:76-87.
60. Quinn SM, Zhang JB, Gunsolley JC, Schenkein JG, Schenkein HA, Tew JG. Influence of smoking and race on immunoglobulin G subclass concentrations in early-onset periodontitis patients. Infect Immun 1996;64:2500-5.
61.McSharry C, Banham SW, Boyd G. Effect of cigarette smoking on the antibody response to inhaled antigens and the prevalence of extrinsic allergic alveolitis among pigeon breeders. Clin Allergy 1985;15:487-94.
62.Haber J. Cigarette smoking: a major risk factor for periodontitis. Compendium 1994;15:1002, 1004-8 passim; quiz 1014.
63.Barbour SE, Nakashima K, Zhang JB, et al. Tobacco and smoking: environmental factors that modify the host response (immune system) and have an impact on periodontal health. Crit Rev Oral Biol Med 1997;8:437-60.
64.Raulin LA, McPherson JCD, McQuade MJ, Hanson BS. The effect of nicotine on the attachment of human fibroblasts to glass and human root surfaces in vitro. J Periodontol 1988;59:318-25.
65.Tanur E, McQuade MJ, McPherson JC, Al-Hashimi IH, Rivera-Hidalgo F. Effects of nicotine on the strength of attachment of gingival fibroblasts to glass and non-diseased human root surfaces. J Periodontol 2000;71:717-22.
66.Cattaneo V, Cetta G, Rota C, et al. Volatile components of cigarette smoke: effect of acrolein and acetaldehyde on human gingival fibroblasts in vitro. J Periodontol 2000;71:425-32.
67.Tipton DA, Dabbous MK. Effects of nicotine on proliferation and extracellular matrix production of human gingival fibroblasts in vitro. J Periodontol 1995;66:1056-64.
68. Kowolik MJ, Nisbet T. Smoking and acute ulcerative gingivitis: a study of 100 patients. Brit Dent J 1983;154:241-242.
69. Pindborg J. Statistical examination of the significance of tobacco in the development of ulceromembranous gingivitis and in the formation of calculus. J Dent Res 1947;26:261-4.
70. Pindborg J. Tobacco and gingivitis. II. Correlation between consumption of tobacco, ulceromembranous gingivitis and calculus. J Dent Res 1949;28:460-3.
71.Meechan JG, Macgregor ID, Rogers SN, Hobson RS, Bate JP, Dennison M. The effect of smoking on immediate post-extraction socket filling with blood and on the incidence of painful socket. Br J Oral Maxillofac Surg 1988;26:402-9.
72. Larrazábal C, García B, Peñarrocha M, Peñarrocha M. Influence of oral hygiene and smoking on pain and swelling after surgical extraction of impacted mandibular third molars. J Oral Maxillofac Surg 2010 Jan;68(1):43-6.
73. López-Carriches C, Gómez-Font R, Martínez-González JM, Donado-Rodríguez M. Influence of smoking upon the postoperative course of lower third molar surgery. Med Oral Patol Oral Cir Bucal 2006;11:E56-60.
74.Cavagna S, Leghissa GC. Correlazione tra patologia parodontale, terapia, impianti e abitudine al fumo. Implantologia Orale 2000;1:38-42.
75. Bain CA, Moy PK. The association between the failure of dental implants and cigarette smoking. Int J Oral Maxillofac Implants 1993;8:609-15.
76. De Bruyn H, Collaert B. The effect of smoking on early implant failure. Clin Oral Implants Res 1994;5:260-4.
77.Jones JK, Triplett RG. The relationship of smoking to impaired wound healing. J Oral Maxillofac Surg 1992;50:237-40.
78.Gorman LM, Lambert PM, Morris HF, Ochi S, Winkler S. The effect of smoking on implant failure at second stage surgery. Implant Dent 1994;3:165-8.
79.Moy PK, Medina D, Shetty V, Aghaloo TL. Dental implant failure rates and associated risk factors. Int J Oral Maxillofac Implants 2005;20:569-77.
80.Carcuac O, Jansson L. Peri-implantitis in a specialist clinic of periodontology. Clinical features and risk indicators. Swed Dent J 2010;34(2):53-61.
81.Schmidt HJ. The influence of tobacco smoke on the oral soft and hard tissues. Zahnartztl Mitt 1968;58:841-844.
82.Schroeder KL, Rosen S, Ramamurthy NS, Strayer M. Root caries, associated microflora and collagenase from smokeless tobacco users. J Dent Res 1989;68:390.
83.Arendorf TM, Walker DM. The prevalence and intraoral distribution of candida albicans in man. Arch Oral Biol 1980;25:1-10.
84.Balaji SM. Tobacco smoking and surgical healing of oral tissues: A review. Indian J Dent Res 2008;19:344-8.
85.Nilsson B. Taste acuity of the human palate. III. Studies with taste solutions on subjects in different age groups. Acta Odont Scan 1979;37:235-252.
86.Axéll T, Henricsson V. Association between recurrent aphthous ulcers and tobacco habits. Scan J Dent Res 1985;93:239-242.
87.Asmussen E, Hansen EK. Surface discoloration of restorative resins in relation to surface softening and oral hygiene. Scan J Dent Res 1986;94:174-177.
88.Redaelli A. La Medicina Estetica. Firenze: See Edizioni 2009.
89. Massirone A. Trattato di Medicina Estetica. Padova: Ed. Piccin 2010.
90. Krug M, Wünsche A, Blum A. Addiction to tobacco and the consequences for the skin. Hautarzt 2004 Mar;55(3):301-15; quiz 316.
91.Journal of Cosmetic Dermatology/Journal Drugs in Dermatology/Giornale Agorà. Articoli 2008-2012 trimestrale.
92. Capitanio B, Sinagra JL, Bordignon V, Cordiali Fei P, Picardo M, Zouboulis CC. Underestimated clinical features of postadolescent acne. J Am Acad Dermatol 2010 Nov;63(5):782-8.
93. Terranova F, Romanelli F, Riondino G, Bartoletti E. Medicina Anti-Aging. Roma: Salus Internazionale 2011.
94. Fratter A. La scienza della bellezza - Le basi biochimiche e formulative in medicina estetica. Firenze: Officina Editoriale Oltrarno 2012.
95. Terranova F. Fisiopatologia dell’idratazione cutanea. Roma: Salus Internazionale 2006.
96. Bellino F, Scesa C, Bartoletti CA, Bartoletti E. Cosmetologia medica. Roma: Salus Internazionale 2009.
97. Contini R. Anatomia, fisiopatologia e psicosomatica nella pratica estetica. Milano: BCM Editrice 1987.
98. Ricci D. Dieci anni di meno. Tutto quello che dovreste sapere per la cura del viso, collo e décolleté e i segreti per conservare la bellezza anche senza ricorrere al bisturi. Milano: Dalai Editore 2003.
99. Ield AE, Colditz GA, Willett WC, Longcope C, McKinlay JB. The relation of smoking, age, relative weight, and dietary intake to serum adrenal steroids, sex hormones, and sex hormone-binding globulin in middle-aged men. The Journal of Clinical Endocrinology & Metabolism 1994;79(5): 1310-1316.
100.Su LH, Chen TH. Association of androgenetic alopecia with smoking and its prevalence among Asian men: a communitybased survey. Arch Dermatol 2007 Nov;143(11):1401-6.