Ancor prima che alla diagnosi precoce, mirata al trattamento di una patologia ormai già instauratasi, la moderna odontoiatria dovrebbe dedicarsi all’identificazione non della sola popolazione malata, ma anche e soprattutto della cosiddetta popolazione «a rischio». Questo perché è ora possibile, sulla base di nuove conoscenze e di nuovi strumenti e materiali presenti sul mercato, ricercare chi presenta quelle caratteristiche – chimiche, fisiche o anche batteriologiche – tali da esporlo in maniera significativa al rischio di contrarre una patologia. Vengono qui presentati alcuni protocolli, accorgimenti e sussidi diagnostici che si possono rivelare molto utili durante tutto l’iter diagnostico e terapeutico al fine di affrontare la pratica clinica da un punto di vista prevalentemente preventivo e, in fin dei conti, minimamente invasivo.
Minimum intervention as new diagnostic and preventive approach
Prior than early diagnosis, aimed to a treatment for a present pathology, the modern dentistry should reach the identification of the ill population, as well as of the population «at risk». In fact, due to new acknowledgements and new instruments and materials, now is possible to look for who presents chemical, physical or bacterial characteristics which can expose significantly a patient to risks for his oral health. In this discussion are presented some protocols, ideas and diagnostic tools which can be useful during all the diagnostic clinical path and either therapies, in order to afford clinical practice starting from a point of view widely preventive and, at last, minimally invasive
• Matteo Basso
• Joanna Nowakowska
• Luca Francetti
Università degli Studi di Milano, Dipartimento «Tecnologie per la Salute», IRCCS Istituto Ortopedico «Riccardo Galeazzi», Clinica Odontoiatrica, Direttore: professor Roberto Weinstein
Secondo quello che dovrebbe essere un paradigma affermato, la medicina moderna dovrebbe puntare decisamente ad affrontare le patologie sul piano della prevenzione. Tuttavia, è oggi ritenuto un gran successo che la medicina moderna ricerchi la diagnosi precoce più che una reale prevenzione, puntando quindi all’intercettamento di patologie, anche gravi, nelle fasi iniziali, rendendole di fatto curabili. E questo è già un grande passo avanti rispetto al passato. Purtroppo, ancora molti aspetti della medicina moderna riguardano la cura tardiva di patologie ormai a volte incurabili.
Eppure non si può dire che la ricerca e l’industria non abbiano messo a disposizione del medico, e dell’odontoiatra, quanto possa essere veramente utile, non solo per diagnosticare precocemente una patologia, ma anche per identificare quello che potremmo cominciare a definire un paziente «a rischio». È possibile definire un paziente «a rischio» quando, in determinate circostanze, un soggetto si dimostra in grado di ammalarsi più di altri di una certa patologia.
Molto spesso, infatti, nella pratica clinica, l’odontoiatra affronta pazienti che, a parità di accumulo di placca o di abitudini alimentari e di igiene orale, sviluppano quadri clinici diversi. La ricerca ha identificato un insieme di fattori, definiti «fattori di rischio», che espongono il paziente all’insorgenza di alcune patologie1-4. Tra questi si possono identificare alcuni fattori di rischio eliminabili, come l’abitudine al fumo di sigaretta o un’igiene orale scadente e fattori di rischio non eliminabili, come malattie infettive croniche, diabete, fattori genetici.
Alcuni frequenti fattori di rischio e le patologie orali potenzialmente correlate5-11 sono elencati in tabella 1. Compito dell’odontoiatra è quindi presentarsi responsabilmente all’appuntamento con il paziente, garantendogli cure adeguate e di alto livello, ma anche un programma di prevenzione, che oggi non può basarsi solo su un programma di richiami periodici.
Minimum intervention
Il concetto di minimum intervention esprime una nuova filosofia di approccio al paziente, dove l’obiettivo principale non è tanto essere meno invasivi nelle procedure, quanto piuttosto prevenire la necessità di qualsiasi intervento, anche se conservativo e poco invasivo, e quando questo si dimostri essere un obiettivo perseguibile12.
I principi della minimum intervention sono molto semplici:
- identificare ogni potenziale fattore di schio;
- eliminare o ridurre al minimo i fattori di rischio;
- quando un trattamento è necessario, contenere la distruzione di porzioni di tessuto sano, conservando quanto più possibile le strutture dentali del paziente.
Non necessariamente, con minimum intervention, si intendono quindi procedure da eseguirsi con l’ausilio di sistemi di ingrandimento, microstrumenti o materiali, purtroppo generalmente più costosi. Sicuramente tutto questo è utile quando ormai è necessario intervenire per curare una patologia già evidente, ma in questa fase è andata persa la possibilità della prevenzione pura.
Questo nuovo approccio, invece, si scontra con quello che rimane il classico approccio interventistico: dove a seguito di una patologia, per lo più sintomatica e/o dolorosa come una carie, la terapia attuata è, spesso, quella del drilling and filling (fresaggio e riempimento) e del sacrificio di molto tessuto che, con un programma adeguato come accade nella minimum intervention, poteva essere risparmiato13. Ma come si può attuare, in termini pratici, questo nuovo concetto? Nel presente lavoro, oltre alla descrizione dei meccanismi patogenetici di alcuni comuni patologie orali come carie e parodontopatie, vengono descritti alcuni semplici e rapidi ausili diagnostici che possono risultare utili per identificare il paziente a rischio e per realizzare protocolli studiati ad hoc per la prevenzione dell’insorgenze di problematiche orali.
Carie e parodontopatie
La carie e le malattie parodontali rappresentano la causa principale di perdita di elementi dentali nella popolazione mondiale. L’agente eziologico di entrambe le patologie è rappresentato dalla placca batterica che, una volta formatasi, è in grado di svolgere un’azione lesiva sui tessuti dentali e gengivali. La carie è una demineralizzazione delle strutture dentali dovuta alla produzione di metaboliti acidi da parte di alcuni microrganismi, che spesso sono dei normali organismi saprofiti del cavo orale di ogni paziente. Le specie batteriche più coinvolte nei processi cariosi sono: Streptococcus mutans, Streptococcus milleri, Streptococcus mitior, Streptococcus sanguis, Actinomyces e Lactobacillus14.
Quando si assume un alimento, questo viene assimilato anche dai batteri che, come risultato della loro attività, possono produrre sostanze acide. Se la dieta risulta particolarmente ricca di zuccheri, come glucosio o saccarosio, alcune specie, come Streptococcus mutans, producono sostanze, come acido lattico o formico, che aggrediscono le strutture del dente. Il processo di demineralizzazione si verifica se il pH della superficie dentale scende sotto il valore critico di 5,5 e, quindi, è necessario che gli idrogenioni si accumulino sulla superficie del dente, cosa che è resa possibile dalla protezione fornita dall’accumulo della placca che non è stata adeguatamente rimossa con lo spazzolamento.
Tuttavia, questo processo distruttivo risente di una serie di variabili o fattori di rischio che possono o meno favorire l’insorgenza della carie: la presenza e l’attività della saliva, le abitudini alimentari, l’igiene orale. Le alterazioni del flusso salivare, sia quelle di tipo quantitativo (in genere il flusso salivare medio è di 1.000 ml al giorno) sia quelle di tipo qualitativo (pH, alterazione delle concentrazioni dei componenti della saliva) possono determinare una maggiore incidenza della patologia cariosa3. In particolare, la saliva combatte la carie tamponando l’acidità della bocca e ha funzione sia microbicida sia immunitaria. Se vengono a mancare alcune sostanze enzimatiche e alcuni elettroliti, può risultare deficitaria la capacità tamponante, e il pH della bocca può rimanere per tempi più lunghi a livelli demineralizzanti (pH < 5,5).
Tutto questo è aggravato da altri fattori, come la presenza di anomalie della posizione dentale, che facilita la formazione della placca cariogena, o cattive abitudini di igiene orale e alimentari, come i frequenti spuntini, o l’eccessivo consumo di cibi dolci, che aumentano il rischio di carie. L’elevata frequenza di assunzione di zuccheri mantiene un pH della bocca acido e la demineralizzazione è, di conseguenza, pressoché continua. In mancanza di una continua assunzione di zuccheri, il pH orale tende a normalizzarsi dopo circa 30 minuti15.
Con il termine di malattia parodontale si intendono una serie di patologie che, secondo la più recente classificazione della Federazione Europea di Parodontologia (EFP) possono essere classificate in16:
- gengiviti;
- parodontite cronica dell’adulto (PCA);
- parodontite a insorgenza precoce;
- parodontite necrotizzante;
- parodontiti associate a malattie sistemiche.
Tutte queste malattie sono correlate all’accumulo della placca batterica che evolve da una componente con prevalenza di Gram+ aerobi, come nella gengivite, a una componente con prevalenza di Gram- anaerobi, come nelle forme di parodontite in fase attiva. È importante sottolineare, comunque, che tutte le parodontiti sono precedute da gengivite, che rappresenta una fase ancora reversibile, ma non obbligatoriamente tutte le gengiviti evolvono inevitabilmente in parodontiti, ovvero in forme la cui distruzione, spesso, non è più rimediabile.
I microrganismi più frequentemente associati alle malattie parodontali sono: Aggregatibacter actinomycetemcomitans (ex Actinobacillus), Tannerella forsythus (ex Bacteroides), Porphiromonas gingivalis, Eikenella corrodens, Treponema denticola, Fusobacterium nucleatum, Spirochete. La presenza di questi batteri, associata a una scorretta igiene orale, sostiene un’infiammazione cronica che, con il tempo, porta alla lenta distruzione dei tessuti parodontali dell’ospite.
Infatti, la presenza cronica di cellule e di mediatori dell’infiammazione come complemento, TNF, citochine, IL-1 e IL-6, genera l’attivazione di processi cellulari che portano a riassorbimento osseo da parte degli osteoclasti e alla distruzione di osso alveolare, cemento radicolare e legamento parodontale. L’elemento diagnostico principale è la formazione di tasche parodontali, con l’aumento della profondità di sondaggio oltre un valore fisiologico di 3-4 mm. Generalmente, durante il sondaggio di siti infiammati si verifica sanguinamento che, nei casi più gravi, può anche manifestarsi spontaneamente16.
Strumenti per l’identificazione del paziente a rischio
Molto spesso i fattori di rischio o la presenza di specie batteriche, come quelle descritti in precedenza, rappresentano elementi di difficile riconoscimento con un semplice esame obiettivo da parte dell’odontoiatra. D’altra parte, non è ipotizzabile che ogni singolo paziente venga sottoposto a complessi esami di laboratorio, che magari prevedono la presenza in studio di uno strumentario professionale molto costoso.
Proprio per assecondare questa esigenza, sono però oggi disponibili una serie di test, generalmente molto semplici, rapidi e poco costosi, che possono rivelarsi utili per l’identificazione di aspetti patologici che, se non noti, potrebbero anche rendere meno efficaci le terapie attuate. La messa in atto di questi sistemi spesso nasce dai risultati della ricerca moderna, e dalla sempre maggiore necessità di ricorrere a metodologie preventive per ridurre complicanze e costi terapeutici.
Presenza di placca specifica cariogena (Esecuzione del test: 4 minuti)
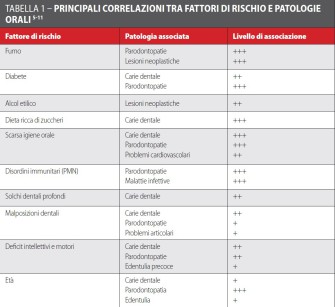
Come descritto, alcune specie batteriche sono in grado di produrre metaboliti acidi che provocano la demineralizzazione dell’idrossiapatite del dente; ma non tutte le specie batteriche sono in grado di produrre questi metaboliti. Sicuramente, Streptococcus mutans è la specie batterica più coinvolta e, maggiore è la sua concentrazione nella cavità orale, maggiore è il rischio di carie a cui è esposto il paziente; pertanto, valutare quantitativamente la presenza di Streptococcus mutans permette di identificare un importante fattore di rischio1,14. In figura 1 è presentato un test messo a punto per identificare, non un preciso valore numerico di Streptococcus mutans, ma piuttosto una conta significativa di questo microrganismo per un alto rischio di carie (Saliva Check Mutans, GC Ltd, Japan).
La durata dell’esecuzione del test, compresa la fase di stimolazione della saliva, è di circa 4 minuti. Il paziente deve masticare una compressa tipo chewing-gum, incolore e insapore, senza deglutire la saliva per circa un minuto, la saliva così stimolata deve essere raccolta con una pipetta e depositata in un apposito contenitore. Al materiale così raccolto devono essere aggiunti due reagenti, una goccia del reagente A e, dopo aver amalgamato il tutto con lievi percussioni del contenitore, altre quattro gocce del reagente B.
Il preparato deve poi essere nuovamente raccolto con la pipetta e depositato su una cartina di reazione, che darà un responso di positività o negatività a un’elevata concentrazione di Streptococcus mutans nella saliva. Il risultato è leggibile dopo circa 15 minuti, durante i quali possono essere svolte le altre procedure di visita. La lettura di un test positivo permette di identificare una popolazione di pazienti maggiormente a rischio di sviluppare carie, ed è così possibile impostare protocolli di mantenimento specifici o correggere manovre di igiene orale scorrette15,17.

Demineralizzazione e pH rilevabile (Esecuzione del test: 4 minuti)
Anche il pH della placca riveste un importante ruolo di fattore di rischio. Un valore di pH che raggiunga o persista troppo a lungo verso valori prossimi a 5 favorisce la demineralizzazione acida di smalto e dentina. Il riconoscimento di valori di pH sfavorevoli possono identificare regimi dietetici impropri e la necessità di istituire regimi alimentari più appropriati. Al contrario, la mancata identificazione del paziente a rischio non solo non permette un approccio preventivo, ma di fatto vanifica anche i programmi di richiamo e di visite periodiche. In figura 2 è rappresentato un test che permette di valutare il pH della saliva e, contemporaneamente, di valutarne la capacità tamponante, ovvero la capacità di neutralizzare la carica acida responsabile della demineralizzazione (Saliva Check Buffer, GC Ltd, Japan).
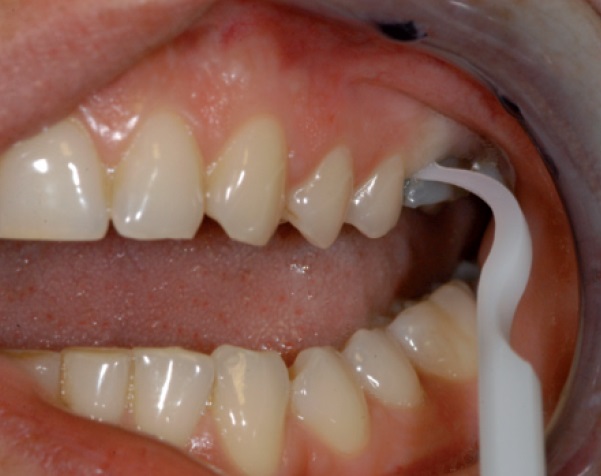
Un’altra possibilità di questo test è la valutazione del flusso salivare, basale e stimolato, in quanto nella confezione viene fornito anche un raccoglitore graduato. Quantità di saliva, pH e capacità tamponante costituiscono, infatti, un’importante chiave di lettura per identificare un paziente a rischio di carie. Il test prevede un semplice prelievo di saliva con uno strumento a pipetta in dotazione. In alternativa, se si vuole valutare anche il flusso salivare, il paziente può espettorare direttamente nel contenitore graduato.

Una cartina tipo tornasole per la valutazione del pH viene quindi immersa nella saliva. Oltre a questo, su un’altra cartina tornasole a tre settori, si applicano alcune gocce di saliva per valutare invece la capacità tamponante (figura 2). Dopo circa tre minuti, entrambe le cartine tornasole virano cromaticamente, assumendo una colorazione che trova il suo significato su una scala cromatica di riferimento compresa nel test. La lettura di pH troppo bassi identifica la presenza di una placca cariogena; anche la scarsa capacità tamponante della saliva può identificare l’incapacità di ridurre efficacemente il pH in tempi ridotti.

Pazienti con queste caratteristiche richiedono regimi alimentari e misure preventive idonee a prevenire l’insorgenza di carie, cui risultano maggiormente esposti rispetto a pazienti negativi al test. La stessa alimentazione può esporre a rischi maggiori pazienti con scarsa capacità tamponante e pH stabilmente più bassi e dannosi. Va ricordato che il test, per assumere un significato preventivo, dovrebbe essere eseguito a distanza di qualche minuto dall’assunzione di cibi, soprattutto carboidrati, la cui metabolizzazione porta a un abbassamento del pH orale, e poi andrebbe ripetuto almeno 30 minuti dopo, per valutare le successive modificazioni del pH e la capacità di «tamponamento» da parte della saliva del soggetto testato17.
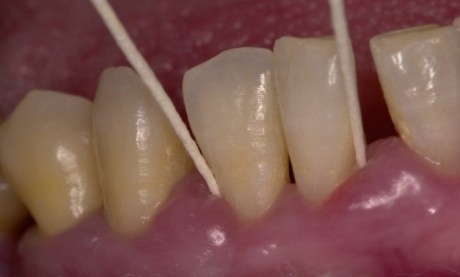
Dato che, molto spesso, la presenza di placca cariogena e l’aumento del rischio di carie si accompagnano a scarsa igiene orale, esiste in commercio un altro test specifico (Plaque Indicator Kit, GC Ltd, Japan) che, oltre al pH ottenuto come nel test precedente (anche se con un reagente liquido e con un prelievo di placca e non di saliva, figure 3 e 4), permette di identificare sulla superficie dentale anche la placca accumulata. La particolare formulazione dei reagenti del liquido rivelatore è in grado di distinguere cromaticamente la placca formatasi da meno di 48 ore (in colore blu) da quella presente da più di 48 ore (in colore rosso, figura 5).
Questo perché nella placca matura variano le componenti della matrice extracellulare e a esse si possono legare reagenti dal colore differente. Dal punto di vista motivazionale, questo riveste un importante ruolo per mostrare al paziente i difetti della tecnica di spazzolamento e quali sono i siti dove la placca tende a formarsi prima e a rimanere più a lungo, con il potenziale rischio di ledere i tessuti. Un ruolo motivazionale simile, anche se meno specifico, può essere quello delle pastiglie rivelatrici di placca, facilmente disponibili sul mercato e utilizzabili dal paziente al proprio domicilio15,17,18.

Placca specifica parodontopatogena (esecuzione del test: 1 minuto)
La presenza di alcune specifiche specie parodontopatogene è condizione necessaria perché possano insorgere le diverse forme di parodontite. La conta numerica di queste specie identifica anche un maggiore rischio potenziale di danno tissutale per il paziente. Ormai da diversi anni, esistono in commercio test che, con semplici procedure di prelievo (figura 6), permettono di ottenere, in circa sette giorni, l’identificazione delle specie batteriche patogene e anche di quantificarle numericamente19,20. Il test di identificazione delle specie batteriche parodontopatogene (per esempio Genotipe Hain Lifescience, Germany) permette di identificare un pool di cinque batteri, tra cui Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis, Tannerella forsythus Treponema denticola, Eikenella corrodens, oppure con il medesimo prelievo anche un pool di dodici microrganismi, sette in più rispetto al test base. Rilevamenti simili si possono ottenere anche con un test analogo come Meridol PerioTest (figura 7).
L’identificazione delle specie batteriche coinvolte consente di affrontare al meglio la terapia parodontale, soprattutto quando si deve accompagnare a somministrazioni di principi antibiotici che possono essere così selezionati in base al microrganismi da combattere. Già solo la conoscenza della conta batterica dei microrganismi parodontopatogeni permetterebbe, infatti, di evitare inutili somministrazioni di antibiotici e chemioterapici in pazienti dalla carica batterica piuttosto bassa. Inoltre, ripetendo il test dopo la terapia parodontale, è possibile ottenere un riscontro oggettivo sul successo della terapia e potrebbe risultare utile all’identificazione di quei pazienti ancora a rischio di progressione della malattia, qualora il test risultasse ancora positivo.
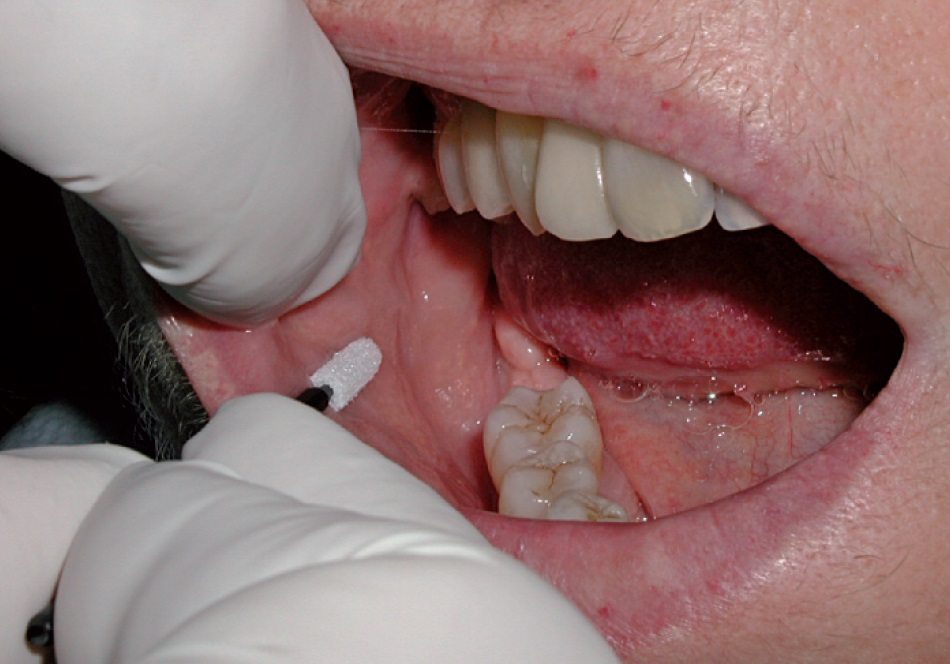
Test di rischio genetico per malattia parodontale (esecuzione del test: 1 minuto)
Come descritto in precedenza, la persistenza di infiammazione a livello gengivale e di tutti i mediatori come citochine e complemento produce risultati lesivi sulle strutture parodontali. In modo particolare, è ormai certo che un’azione anormale di alcuni mediatori, come le interleuchine, è particolarmente coinvolta in questo processo. Una di queste, IL-1, in alcuni pazienti presenta un’attività più elevata e le lesioni parodontali tendono a essere più precoci e gravi2,20. È importante, quindi, che di fronte a lesioni parodontali precoci venga identificato questo fattore di rischio, perché i programmi terapeutici e quelli dei futuri mantenimenti devono essere completamente differenti.
Il Periodontal Risk Test (PRT, Hain Lifescience, Germany) permette di eseguire un prelievo di cellule epiteliali superficiali dal lato buccale della mucosa geniena tramite semplice sfregamento di un tampone sterile fornito nella confezione (figura 8). Il campione così prelevato può essere analizzato e, dopo circa sette giorni e con costi contenuti, può essere identificata la positività per l’espressione di un gene che porta a un’azione abnorme di IL-1. Questo test dovrebbe essere eseguito di routine, soprattutto nel trattamento di forme particolarmente precoci.

Test dei solfuri per la progressione della malattia parodontale (esecuzione del test: 10 minuti)
È noto che alcune delle specie parodontopatogene sono in grado di produrre, tra i loro metaboliti, anche alcuni composti solforati, che sono tuttavia presenti in concentrazioni significative solo nella fase attiva della malattia parodontale9.
La possibilità di rilevare, quindi, la presenza di questi composti può consentire di identi care con precisione la fase di attivazione o quiescenza della malattia parodontale, suggerire la presenza di specie batteriche potenzialmente pericolose, ma anche la necessità di re-intervento, qualora una terapia iniziale fosse già stata condotta, ma la malattia continuasse a progredire ugualmente. Diamond Probe è un particolare dispositivo che consente, con una sonda del tutto simile a quella parodontale, di rilevare, grazie a un sensore, la presenza dei composti solforati quando presenti in concentrazioni compatibili con le fasi attive della malattia parodontale ( figure 9 e 10).

La presenza di composti solforati è un buon marker per suggerire con tempestività la necessità di instaurare una specifica terapia parodontale, prima che altri segni o sintomi facciano la loro comparsa in maniera clinicamente evidente, ma a volte tardiva al ne di poter ottenere buoni risultati.
Conclusioni
L’esecuzione degli specifici test presentati, o di altri che siano stati messi a punto per simili scopi, vuole contrapporsi con la semplicità e le spese contenute a procedure di laboratorio decisamente più complesse e i cui costi limiterebbero moltissimo il loro utilizzo e la loro fruibilità a scopo preventivo. Avere a disposizione strumenti di rapida esecuzione, inoltre, non appesantisce il flusso di pazienti nello studio odontoiatrico, perché i test descritti richiedono, in media, circa 2-3 minuti.
Quello che è rilevante è invece abbracciare i principi descritti della minimum intervention e offrire al paziente molta più attenzione alla prevenzione, piuttosto che alla terapia pura. D’altra parte, l’ottenimento delle maggiori informazioni ricavate da un test poco servirebbe se non ne conseguisse una modifica dell’atteggiamento terapeutico. Un paziente con scarsa capacità tamponante della saliva e pH stabilmente bassi deve ricevere un programma di richiami e mantenimento che prevedano anche sostanziali modifiche delle abitudini alimentari o degli strumenti per l’igiene domiciliare. Inoltre, tutte le procedure idonee per la prevenzione della carie, come le sigillature precoci dei solchi dentali, dovrebbero essere prese in seria considerazione.
Analogo discorso può essere svolto dopo l’identificazione di specie parodontopatogene e del rischio genetico di ammalare di parodontite. Possono essere, infatti, specificamente impostati i programmi terapeutici per:
- prescrivere o meno terapie antibiotiche sistemiche;
- utilizzare terapie farmacologiche aggiuntive a livello locale;
- mantenere o eliminare elementi dentali a rischio o compromessi;
- impostare i tempi per le sedute di richiamo.
In conclusione, adottare un atteggiamento differente in ambito diagnostico, e di conseguenza andare a ricercare anche con i test descritti alcune informazioni in più sul paziente, deve essere solo un punto di partenza per attuare i principi della minimum intervention: identificare ogni potenziale fattore di rischio, eliminare o ridurre al minimo questi stessi fattori, ridurre l’invasività del trattamento, quando questo è possibile.
Corrispondenza
Dottor Matteo Basso
Centro di Riabilitazione Orale Mininvasiva ed Estetica (Crome )
Università degli Studi di Milano
IRCCS Istituto Ortopedico Galeazzi
Servizio di Odontostomatologia
Via Riccardo Galeazzi 4, 20161 Milano
e-mail: matteo.basso@unimi.it
1. Corby PM, Lyons-Weiler J, Bretz WA, Hart TC, Aas JA, Boumenna T, Goss J, Corby AL, Junior HM, Weyant RJ, Paster BJ. Microbial risk indicators of early childhood caries. J Clin Microbiol 2005 Nov;43(11):5753-59.
2. Haffajee AD, Socransky SS, Lindhe J, Kent RL, Okamoto H, Yoneyama T. Clinical risk indicators for periodontal attachment loss. J Clin Periodontol 1991 Feb;18(2):117-25.
3. Ismail AI, Sohn W, Tellez M, Willem JM, Betz J, Lepkowski J. Risk indicators for dental caries using the International Caries Detection and Assessment System (ICDAS). Community Dent Oral Epidemiol 2008 Feb;36(1):55-68.
4. Van Dyke TE, Sheilesh D. Risk factors for periodontitis. J Int Acad Periodontol 2005 Jan;7(1):3-7 Review.
5. Aimetti M, Romano F, Nessi F. Microbiologic analysis of periodontal pockets and carotid atheromatous plaques in advanced chronic periodontitis patients. J Periodontol 2007 Sep;78(9):1718-23.
6. Bergström J. Periodontitis and smoking: an evidence-based appraisal. J Evid Based Dent Pract 2006 Mar;6(1):33-41 Review.
7. Chen YW, Umeda M, Nagasawa T, Takeuchi Y, Huang Y, Inoue Y, Iwai T, Izumi Y, Ishikawa I. Periodontitis may increase the risk of peripheral arterial disease. Eur J Vasc Endovasc Surg 2008 Feb;35(2):153-8. Epub 2007 Oct 25.
8. De Boever AL, De Boever JA. Early colonization of non-submerged dental implants in patients with a history of advanced aggressive periodontitis. Clin Oral Implants Res 2006 Feb;17(1):8-17.
9. Khaira N, Palmer RM, Wilson RF, Scott DA, Wade WG. Production of volatile sulphur compounds in diseased periodontal pockets is significantly increased in smokers. Oral Dis 2000 Nov;6(6):371-375.
10. Mustapha IZ, Debrey S, Oladubu M, Ugarte R. Markers of systemic bacterial exposure in periodontal disease and cardiovascular disease risk: a systematic review and meta-analysis. J Periodontol 2007 Dec;78(12):2289-302 Review.
11. Pucar A, Milasin J, Lekovic V, Vukadinovic M, Ristic M, Putnik S, Kenney EB. Correlation between atherosclerosis and periodontal putative pathogenic bacterial infections in coronary and internal mammary arteries. J Periodontol 2007 Apr;78(4):677-82.
12. Mount GJ, Ngo H. Minimal intervention dentistry: a new concept for operative dentistry. Quintessence Int 2000;31:527-533.
13. Burke FJ. From extension for prevention to prevention of extension: (minimal intervention dentistry). Dent Update 2003 Nov;30(9):492-8, 500, 502.
14. Young DA, Featherstone JD, Roth JR, Anderson M, Autio-Gold J, Christensen GJ, Fontana M, Kutsch VK, Peters MC, Simonsen RJ, Wolff MS. Caries management by risk assessment: implementation guidelines. J Calif Dent Assoc 2007 Nov;35(11):799-805.
15. Brostek A. Early diagnosis and minimally invasive treatment of occlusal caries: a clinical approach. Oral Health Prev Dent 2004;2 Suppl 1:313-9.
16. Lang NP, Lindhe J, van der Velden U, European Workshop in Periodontology Group D. Advances in the prevention of periodontitis. Group D consensus report of the 5th European Workshop in Periodontology. J Clin Periodontol 2005;32 Suppl 6:291-3.
17. Mount GJ, Ngo H. Minimal intervention dentistry: the early lesion. Quintessence Int 2000;31:535-546.
18. Mount GJ, Ngo H. Minimal intervention dentistry: the advanced lesion. Quintessence Int 2000;31:621-629.
19. D’Ercole S, Catamo G, Piccolomini R. Diagnosis in periodontology: a further aid through microbiological tests. Crit Rev Microbiol 2008 Feb;34(1):33-41.
20. Jervøe-Storm PM, Koltzscher M, Falk W, Dörfler A, Jepsen S. Comparison of culture and real-time PCR for detection and quantification of five putative periodontopathogenic bacteria in subgingival plaque samples. J Clin Periodontol 2005 Jul;32(7):778-83.