Diverse sindromi presentano manifestazioni a livello orale che spesso anticipano quelle sistemiche. Fra queste, la displasia immuno-ossea di Schimke, la cui diagnosi precoce e relativo inquadramento terapeutico possono risultare determinanti sulla prognosi del paziente.
Luca Viganò1, Cinzia Casu 2
1Odontoiatra, Dipartimento di Radiologia Orale, San Paolo Dental Building, Università degli Studi di Milano
2Odontoiatra, libero professionista, Cagliari
La displasia immuno-ossea di Schimke (SIOD), descritta per la prima volta nel 1971, è un disordine sistemico autosomico-recessivo causato da mutazioni bi-alleliche di SMARCAL1, gene che altera l’elicità del DNA in regioni regolative e promotrici, ostacolando o promuovendo il legame di fattori di trascrizione che regolano le risposte agli stimoli morfogenetici.
La SIOD presenta alcune caratteristiche principali, come la displasia spondilo-epifisaria, la disfunzione renale, l’immunodeficienza delle cellule T e il dismorfismo facciale (Schimke et al, 1971; Spranger et al, 1991; Boerkoel et al, 2000).
I dismorfismi comprendono una faccia tendente al triangolare, un ampio ponte nasale, fessure palpebrali ridotte, anomalie dentarie, collo corto, macule iperpigmentate, tronco sporgente e arti corti.
Un lavoro estremamente interessante è stato eseguito a livello internazionale per meglio definire le anomalie dentarie indotte della SIOD.
Questo lavoro ha esaminato pazienti affetti da SIOD, con mutazioni identificate di SMARCAL1 bi-alleliche e ha rilevato che circa i 2/3 avevano alterazioni dentali. Le analisi immunoistochimiche hanno mostrato l’espressione di SMARCAL1 in tutti i denti in via di sviluppo.
Questa osservazione ha permesso di definire che le malformazioni siano conseguenza di deficit di SMARCAL1 a livello cellulare.
È inoltre emerso che le malformazioni dentali derivino, in parte, da risposte alterate ai morfogeni deputati allo sviluppo degli elementi dentali. L’obiettivo di questa overview è quello di fornire alcuni dati epidemiologici, anamnestici e clinici per il riconoscimento delle lesioni orali da SIOD.
Materiali e metodi
La ricerca in relazione a questa sindrome si è avvalsa di lavori pubblicati su PubMed. In particolare, è stato valutato un lavoro multicentrico universitario che presenta un campione rappresentativo e significativo delle manifestazioni dentali della SIOD. Le università coinvolte nel lavoro risultano il Baylor College of Medicine (Houston, TX, USA), l’Ospedale pediatrico per bambini affetti da patologie di Toronto (Ontario, Canada) e l’Università della British Columbia (Vancouver, BC, Canada). I tessuti autoptici sono stati ottenuti secondo il protocollo approvato dalla University of British Columbia (Vancouver, BC, Canada).
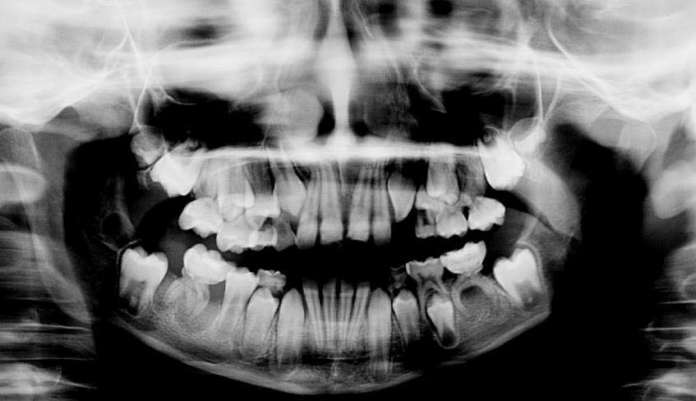
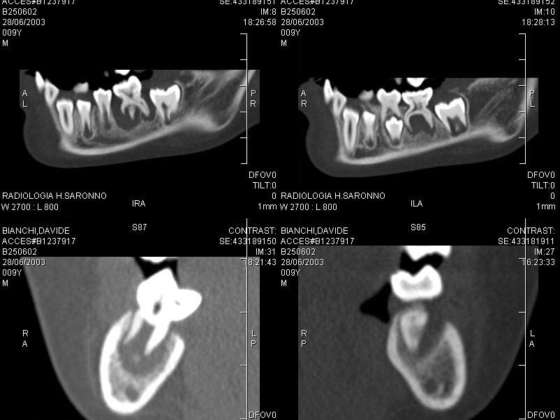
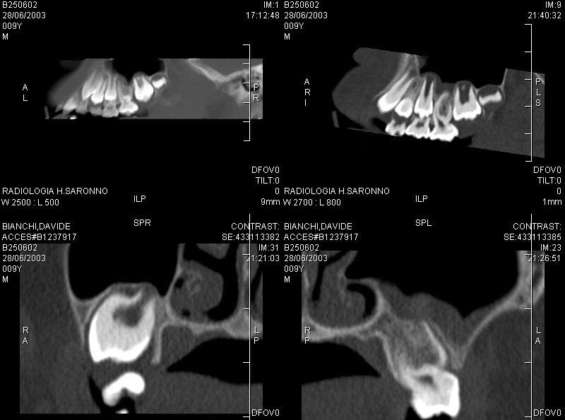
Il lavoro prende in esame diversi articoli che riportano sia le lesioni sistemiche che le manifestazioni orali. Ci siamo focalizzati principalmente sulle lesioni dentali al fine di fornire un supporto rapido al professionista orale per l’inquadramento precoce della SIOD. Il lavoro presenta immagini derivanti dagli articoli selezionati ma esplicativi delle alterazioni focali presenti a livello dentale.
Risultati
Il lavoro sinergico delle università in oggetto ha mostrato che i pazienti affetti da SIOD con mutazioni SMARCAL1 bi-alleliche nel 66,0% presentava anomalie dentali. Il 46,8% aveva microdonzia e il 52,3% aveva ipodonzia. Il numero di denti mancanti variava da 0 a 15, i premolari erano gli elementi più frequentemente assenti. Oltre ai denti piccoli o assenti, il 72,0% dei pazienti con SIOD presentava radici dei molari ipoplasiche. La sproporzione tra la corona del molare e le radici variava da quasi normale a grave. I premolari permanenti e i primi molari sono prevalentemente malformati, mentre gli incisivi e i canini di solito risultano nella norma.
La maggior parte dei denti presenta una colorazione nella norma tranne in alcuni casi in cui si evidenziano delle opacità.
Risultati autoptici di feti hanno mostrato che l’alterazione SMARCAL1 è presente in tutti gli stadi evolutivi del dente, dalla gemma alla fase definitiva. L’alterazione genetica incide particolarmente nell’epitelio dentale esterno e interno e nella formazione dello smalto, moderata nel reticolo stellato e debole nella papilla e nella lamina dentale. Osservando che i premolari e i molari erano generalmente più colpiti rispetto ai denti anteriori, si ipotizzava che SMARCAL1 non fosse espresso nei denti anteriori. Viceversa l’analisi immunoistochimica di tessuti post-mortem da un feto di 98 giorni ha mostrato che SMARCAL1 era fortemente espresso anche nell’anatomia incisale e canina, così come nel germoglio del premolare permanente, ma non si manifestava clinicamente come a livello dei molari.
La funzione di SMARCAL1 nella riparazione e nella replicazione del DNA suggerisce che il suo deficit o la sua alterazione possano indurre alla morte delle cellule coinvolte o alla loro ridotta proliferazione.
Sebbene microdonzia, ipodontia e molari con ipoplasia della radice siano stati segnalati anche per la sindrome di Rothmund-Thomson, l’anemia di Fanconi, la sindrome di Seckel e la discheratosi congenita, le alterazioni presenti nella SIOD hanno caratteristiche distintive. Il lavoro di ricerca dei vari ospedali coinvolti ipotizza che le anomalie dentali osservate nella SIOD potrebbero non essere dovute principalmente alla riparazione del DNA compromessa o al rallentamento del ciclo cellulare.
Poiché SMARCAL1 interagisce con la cromatina trascrizionale attiva e modula l’espressione genica (Baradaran-Heravi et al, 2012), è espresso nei principali centri di segnalazione che coordinano lo sviluppo dei denti (Jernvall e Thesleff, 2000). Inoltre è stato ipotizzato che la carenza della proteina codificata dal gene SMARCAL1 alteri le risposte trascrizionali ai morfogeni che agiscono o secernono da questi centri.
Discussione
I lavori nella letteratura scientifica su questo argomento hanno mostrato che i pazienti affetti hanno molto spesso anomalie dei denti e dimostrano che la proteina codificata da SMARCAL1 è altamente espressa nel dente umano in via di sviluppo.
Come suggerito da Fonseca (2000), il fenotipo dentale in SIOD assomiglia a quello della dentinogenesi imperfetta (DI) di tipo II, che è caratterizzato da denti opalescenti o traslucidi con alterazione cromatica, superficie abrasa, radici corte ristrette e obliterazione delle camere pulpari (Shields et al, 1973). Inoltre, come la SIOD, il tipo DI II interessa sia la dentizione decidua che quella permanente (Sclare, 1948). Tuttavia, a differenza del tipo DI II, i denti SIOD presentano raramente decolorazione, ipoplasia dello smalto e dentina morbida. I denti di tutti i pazienti SIOD oggetto della ricerca presentavano una opacità tendenzialmente normale. In base alle nostre attuali conoscenze il fenotipo dentale di SIOD è unico.
Il motivo per cui l’alterazione di SMARCAL1 influenza principalmente i molari rispetto ai denti anteriori non è ancora chiarito. Una possibile ipotesi è che lo sviluppo più complesso di molari richieda l’induzione di nodi secondari e terziari di smalto (Jernvall e Thesleff, 2000, Luukko et al, 2003), il che rende il molare più suscettibile alle conseguenze di questa alterazione genica sulle risposte trascrizionali ai morfogeni del dente. Studi futuri metteranno alla prova queste ipotesi e definiranno la dipendenza differenziale dai molari in via di sviluppo dalla funzione di SMARCAL1. Questi pazienti presentano frequentemente altre espressioni sistemiche e difficoltà terapeutiche. Ad esempio, l’ormone della crescita supplementare non riesce a migliorare il tasso di crescita e la statura del 93% dei pazienti SIOD (Boerkoel et al, 2000). Il 40-50% dei pazienti hanno una risposta ridotta all’ormone stimolante la tiroide e richiedono l’integrazione di levotiroxina (Boerkoel et al, 2000).
Dato che la malattia interessa vari sistemi, la gestione richiede un approccio terapeutico multidisciplinare. Nella maggior parte dei pazienti, le aspettative di vita si limitano all’infanzia o alla prima adolescenza, a causa degli ictus, delle infezioni, dell’insufficienza del midollo osseo e dell’insufficienza renale che spesso induce alla dialisi. Le complicanze variano in base alla espressione della malattia e pazienti affetti da forme più lievi o a esordio tardivo manifestano le complicanze sistemiche in età adulta.
Conclusioni
È vero che la patologia qui descritta risulta molto rara, infatti la prevalenza della SIOD è stimata in circa un caso ogni 1-3 milioni di neonati, ma la conoscenza delle complicanze orali derivanti da stati sindromici, può, in alcuni casi, essere la prima fase diagnostica e permettere una maggiore velocità nella terapia e quindi un miglioramento della prognosi.
Fondamentale, in presenza di alterazioni che supportino l’ipotesi di un quadro sindromico, l’approccio genetico.
Inoltre riconoscere queste lesioni nel cavo orale riporta l’odontoiatria all’interno della disciplina medica e rafforza l’idea che il cavo orale possa essere fondamentale per le diagnosi precoci di molte patologie sistemiche.
- Clewing JM, Fryssira H, Goodman D, et al. Schimke Immunoosseous Dysplasia: Suggestions of Genetic Diversity . Human Mutation 2007;28(3):273-283.
- Hunter KB , Lücke T, Spranger J, et al. Schimke immunoosseous dysplasia: defining skeletal features Eur J Pediatr 2010;169:801-811.
- Morimoto M, Kérourédan O, Gendronneau M, et al. Dental abnormalities in Schimke immuno-osseous dysplasia. J Dent Res 2012 Jul;91(7 Suppl):29S-37S.
- Wang W, Song H, Wei Met al. SMARCAL1 gene analysis of 2 Chinese Schimke immuno-osseous dysplasia children Zhonghua Er Ke Za Zhi 2015 Jan;53(1):45-50.
- Gendronneau M, Kérourédan O, Taque S, et al. Dental abnormalities and preventive oral care in Schimke immuno-osseous dysplasia. Eur Arch Paediatr Dent 2014 Jun;15(3):217-21.
- da Fonseca MA. Dental findings in the Schimke immuno-osseous dysplasia. Am J Med Genet 2000 Jul 17;93(2):158- 60.