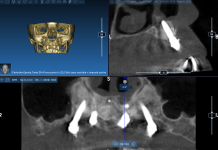
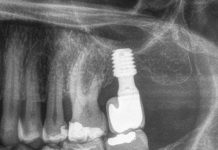
Riassunto
Attraverso alcuni casi esemplificativi vengono presentate le principali tecniche
di ricostruzione ossea oggi in uso per la il trattamento di difetti localizzati
del processo alveolare. Viene inoltre affrontato il tema della prevenzione dei difetti ossei post-estrattivi con riferimenti alle tecniche di preservazione crestale ed alla loro razionale programmazione.
Summary
The study present some of the most popular techniques of bone reconstruction by showing some typical clinical case of localized alveolar bone atrophy.
Furthermore, the authors highlights the importance of prevention of post-extractive alveolar bone defects by discussing the ridge preservation techniques.
Alcune delle principali cause che provocano severe atrofie dei mascellari sono i processi di riassorbimento osseo che seguono l’estrazione dentale. Un presupposto clinico che limita tali gravi riassorbimenti è un’estrazione che lasci integre le pareti ossee alveolari: ne consegue che è importante identificare il piano di clivaggio tra osso e radice dentale, cioè lo spazio alveolo-dentale, che rappresenta appunto il piano di clivaggio per eseguire l’estrazione. In caso di elementi pluriradicolati, è consigliabile separare le radici: sia per facilitare l’estrazione stessa sia per salvaguardare i picchi ossei mesiali e distali alle radici stesse evitando di far leva sui versanti vestibolari e palatali/linguali. La presenza di eventuali frammenti apicali radicolari dovrebbe essere risolta ricorrendo a una fenestrazione ossea vestibolare, spingendo poi il frammento in direzione coronale, evitando così di danneggiare la parte più cervicale dell’osso alveolare. È estremamente importante favorire la formazione del coagulo all’interno dell’alveolo. Tale coagulo può essere stabilizzato e protetto tramite l’impiego di diversi materiali tra cui spugne di collagene e innesti di tessuti duri.
Prevenzione del riassorbimento post-estrattivo
Le gravi perdite di osso alveolare, che si determinano in seguito a estrazioni traumatiche, a grave malattia parodontale, a traumi o a infezioni periapicali, spesso riducono la possibilità di inserimento di impianti1-8. Nel caso in cui queste deformità ossee siano localizzate in aree anteriori si aggiunge anche un problema estetico. Nel caso di protesi tradizionali, il protesista deve affrontare il deficit dei tessuti molli ed è costretto ad alterare la forma dei pontic per portarli a contatto con la cresta, non uniforme, o ricorrere all’utilizzo di porcellana rosa al fine di mascherare i difetti. In questi casi, per migliorare l’estetica senza ricorrere all’utilizzo di impianti, si possono correggere le deformità crestali tramite chirurgia muco-gengivale, ossia con un innesto di tessuto connettivo. In presenza di profonde deiscenze ossee del processo alveolare dopo estrazione è preferibile utilizzare tecniche rigenerative. Numerose tecniche sono state proposte al fine di garantire il mantenimento volumetrico degli alveoli post-estrattivi e un’ampia varietà di materiali sono stati utilizzati per la loro capacità di indurre formazione ossea negli alveoli post-estrattivi9-11. È stato, inoltre, suggerito l’utilizzo di membrane, riassorbibili e non riassorbibili, al fine di preservare l’alveolo12,13. Attualmente, nelle procedure di rigenerazione ossea, è preferibile l’utilizzo di membrane riassorbibili, che presentano il vantaggio di evitare una seconda chirurgia altrimenti necessaria in caso di utilizzo di membrane non riassorbibili. Utilizzando membrane non riassorbibili (in e-PTFE), molti autori hanno, inoltre, riscontrato un’alta percentuale (41%) di esposizione e infezione delle membrane, con conseguenti complicazioni, tali da richiedere la rimozione delle membrane con la frequente compromissione del processo di rigenerazione12. Queste considerazioni hanno portato allo sviluppo e all’utilizzo di membrane riassorbibili. Si è visto che sia le membrane in acido polilattico sia quelle in collagene hanno riportato risultati clinici simili a quelli ottenuti con le membrane non riassorbibili13. Tali membrane non dovrebbero riassorbirsi fin quando non avviene la differenziazione e la maturazione del tessuto di granulazione di derivazione ossea all’interno dell’alveolo e sono spesso utilizzate in associazione con riempitivi ossei14,15. Il clinico deve determinare la morfologia del difetto che rimane dopo un’estrazione e decidere se tale difetto sarà in grado di guarire spontaneamente. Il processo di guarigione è strettamente correlato alla morfologia del difetto osseo e, in generale, quanto maggiore sarà il numero, lo spessore e la densità delle pareti ossee residue, tanto migliore sarà la guarigione dell’alveolo e, di conseguenza, minore la necessità di ricorrere a procedure rigenerative16.
Nel caso di alveoli perfettamente integri e in condizioni anatomiche favorevoli è chiaro che può essere indicato l’inserimento immediato di un impianto.
Nel caso in cui sia presente un deficit dei tessuti duri, la guarigione spontanea risulterà alterata e si potrebbe verificare il collasso dei tessuti molli all’interno del difetto.
Estrusione ortodontica
Un’altra procedura per trattare aree con deficit dei tessuti duri e molli prima del trattamento implantare è l’estrusione ortodontica. Questa tecnica è stata per la prima volta riportata per descrivere miglioramenti dell’altezza ossea durante le fasi iniziali della terapia parodontale17. La terapia comprendeva istruzioni di igiene orale e trattamento parodontale non-chirurgico seguite da un movimento ortodontico del dente in direzione coronale. Se i segni dell’infiammazione e il trauma da occlusione erano tenuti sotto controllo, durante la terapia si evidenziava un miglioramento dell’altezza ossea. Tale approccio può essere applicato nei casi in cui sia stata pianificata l’esecuzione di impianti post-estrattivi immediati. A tale fine, un ruolo fondamentale nella buona riuscita del trattamento risulta essere il controllo dell’igiene orale associato al trattamento della superficie radicolare, che può essere eseguito ricorrendo o meno alla chirurgia parodontale. Le chiavi del successo comprendono l’eliminazione di ogni contatto occlusale del dente durante la sua estrusione e il pieno controllo dell’infiammazione marginale. È importante che il dente sia guidato nell’estrusione lungo il suo asse verticale. Errori di traiettoria possono portare la radice in direzione buccale o palatale con conseguenti deiscenze, che dovranno poi essere corrette durante l’inserimento implantare. La maggior parte degli ortodontisti preferisce far estrudere il dente di circa di 1 mm al mese, con un periodo finale di stabilizzazione di circa tre mesi. Se le premesse vengono rispettate, un miglioramento dei tessuti molli e duri risulta altamente predicibile.
Trattamento delle creste edentule riassorbite
Spesso, occorre trattare siti guariti, dove cioè gli elementi dentali mancano da parecchio tempo, che presentano deficit ossei. Piccoli difetti possono essere trattati simultaneamente all’inserimento dell’impianto, mentre per grandi difetti l’inserimento di impianti deve essere preceduto da un aumento osseo. Questi difetti spesso richiedono l’utilizzo di membrane18-20 e/o riempitivi ossei che agiscano da supporto alle membrane stesse e che presentino un’azione osteoconduttiva21-26. La ricostruzione ossea pre-implantare può essere effettuata con diversi tipi di materiali e le tecniche che in questa serie di casi clinici vogliamo illustrare sono le seguenti:
- innesti ossei per apposizione;
- rigenerazione ossea guidata (GBR, guided bone regeneration);
- split crest.
Innesti ossei per apposizione
L’osso autologo rappresenta il gold standard dei materiali da innesto27-29. Se, clinicamente, è necessario ottenere ampi aumenti volumetrici, i siti donatori privilegiati sono la cresta iliaca e la calvaria; a differenza, i siti intra-orali (ramo mandibolare e sinfisi mentoniera) vengono scelti come siti donatori in caso di deficit crestali volumetricamente contenuti. Innesti di osso autologo presentano tempi di guarigione e di rimodellamento di gran lunga minori rispetto agli altri biomateriali. Tuttavia, esiste qualche svantaggio nell’utilizzo dell’osso autologo quali la necessità di un sito donatore aggiuntivo che incrementa la morbilità per il paziente; in un 10-35% dei casi possono permanere fastidiosi sintomi per un periodo di tempo anche lungo. Il ricorso a siti donatori extra-orali, come per esempio la calvaria, la tibia o la cresta iliaca, è la principale causa di discomfort del paziente nel post-operatorio e, nella maggior parte dei casi, questa pratica non risulta necessaria. Presenta, inoltre, diversi svantaggi: costi elevati, alterazioni della deambulazione e la frequente necessità di un’anestesia generale e conseguente ospedalizzazione. Siti donatori intra-orali presentano, invece, minore morbilità.
Tali siti includono:
- sinfisi mentoniera, da questo sito è possibile raccogliere una grande quantità di osso, che va prelevato tra i due forami mentonieri;
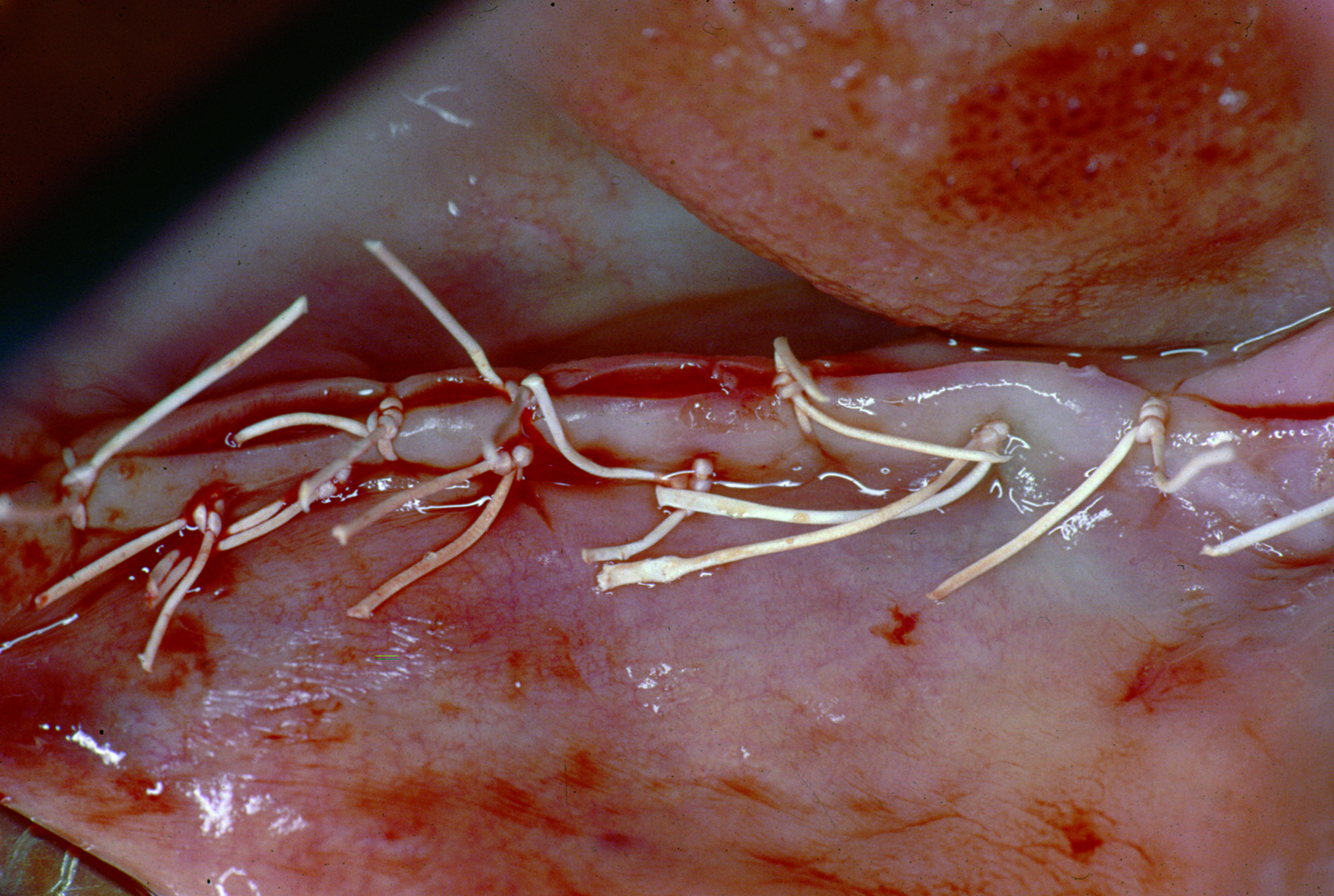
- ramo mandibolare, rispetto alla sinfisi mentoniera questo sito è associato a minori complicanze post-operatorie, riguardanti soprattutto disturbi neurosensoriali e deiscenze dei tessuti molli. L’osso prelevato è monocorticale
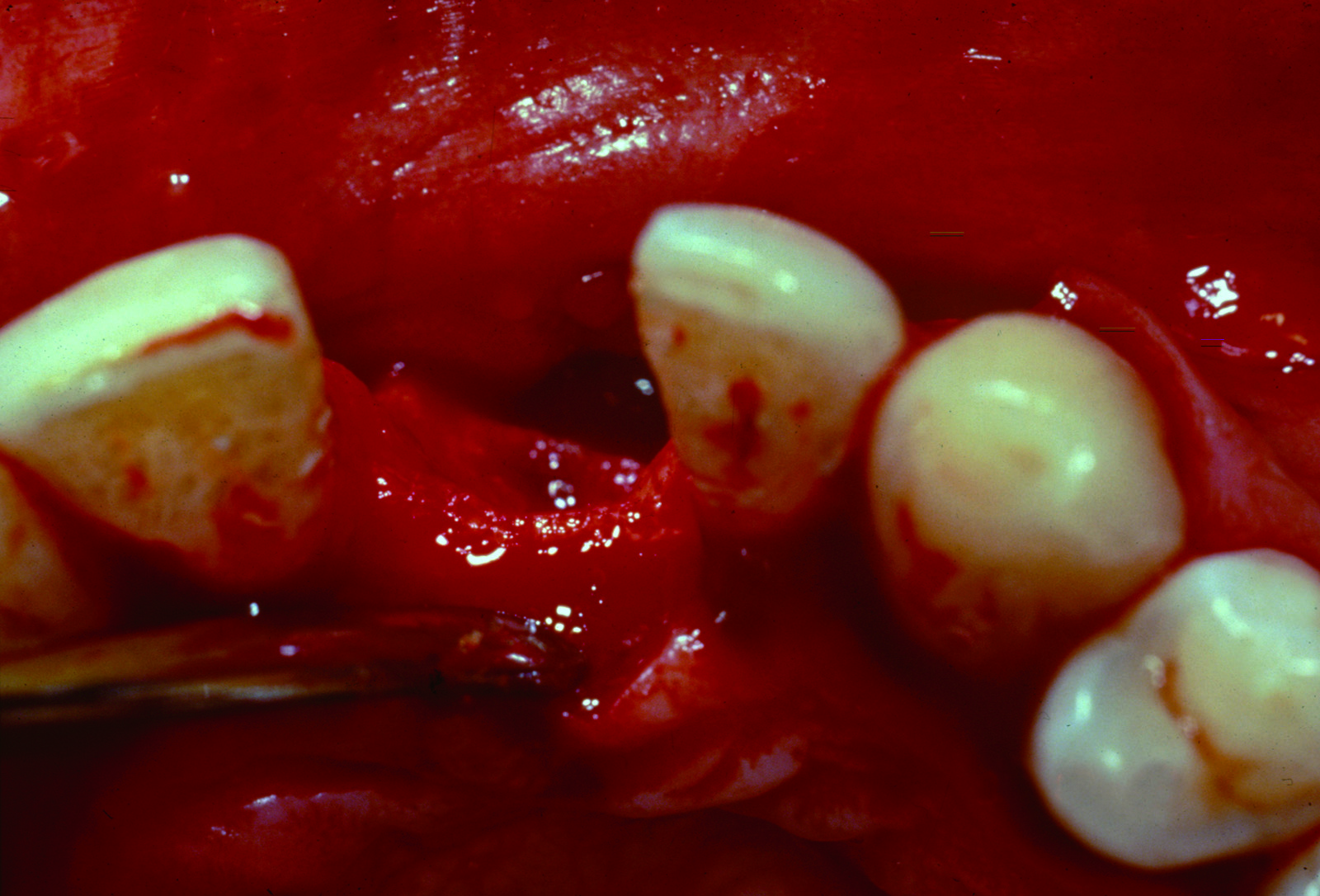
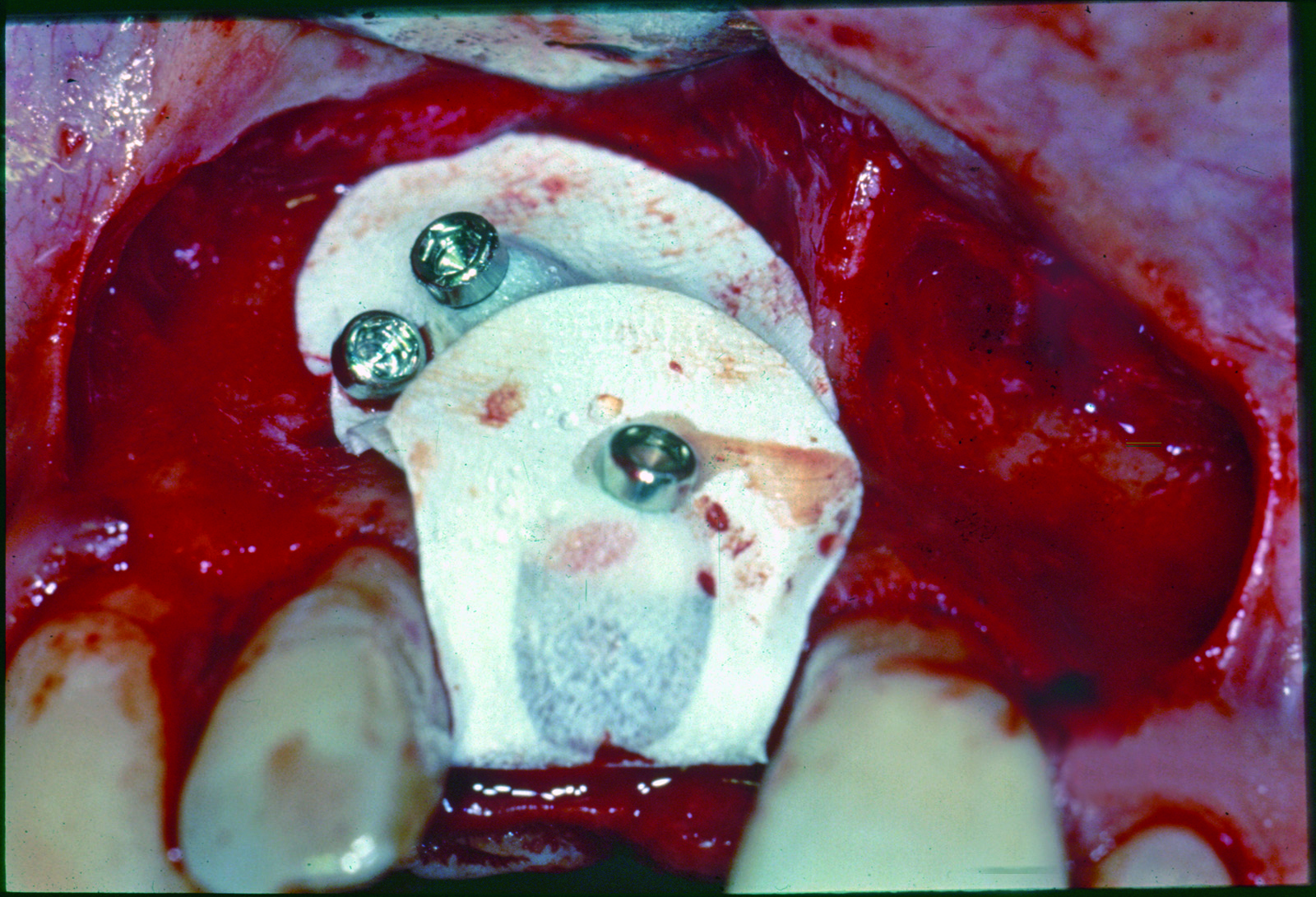
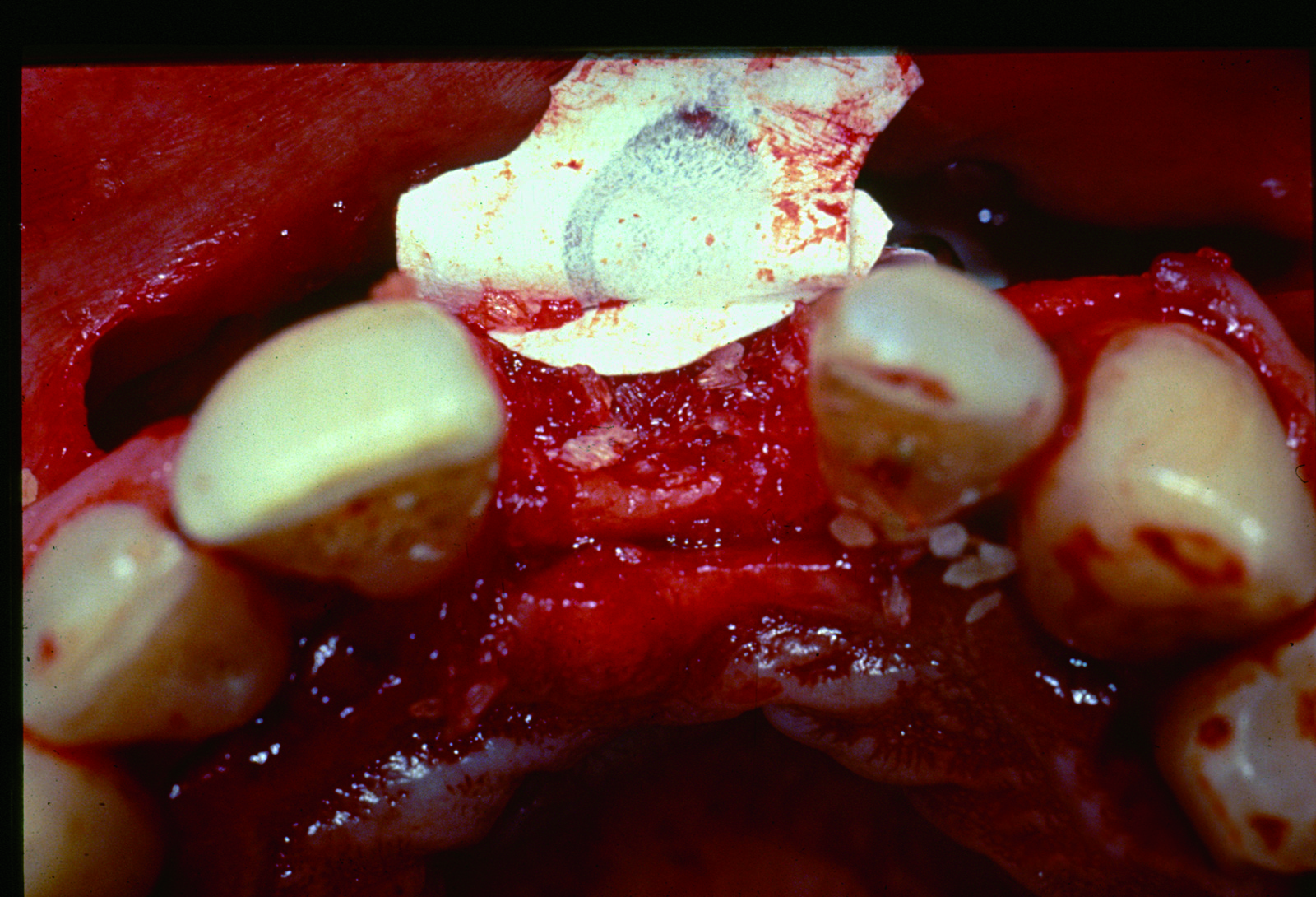
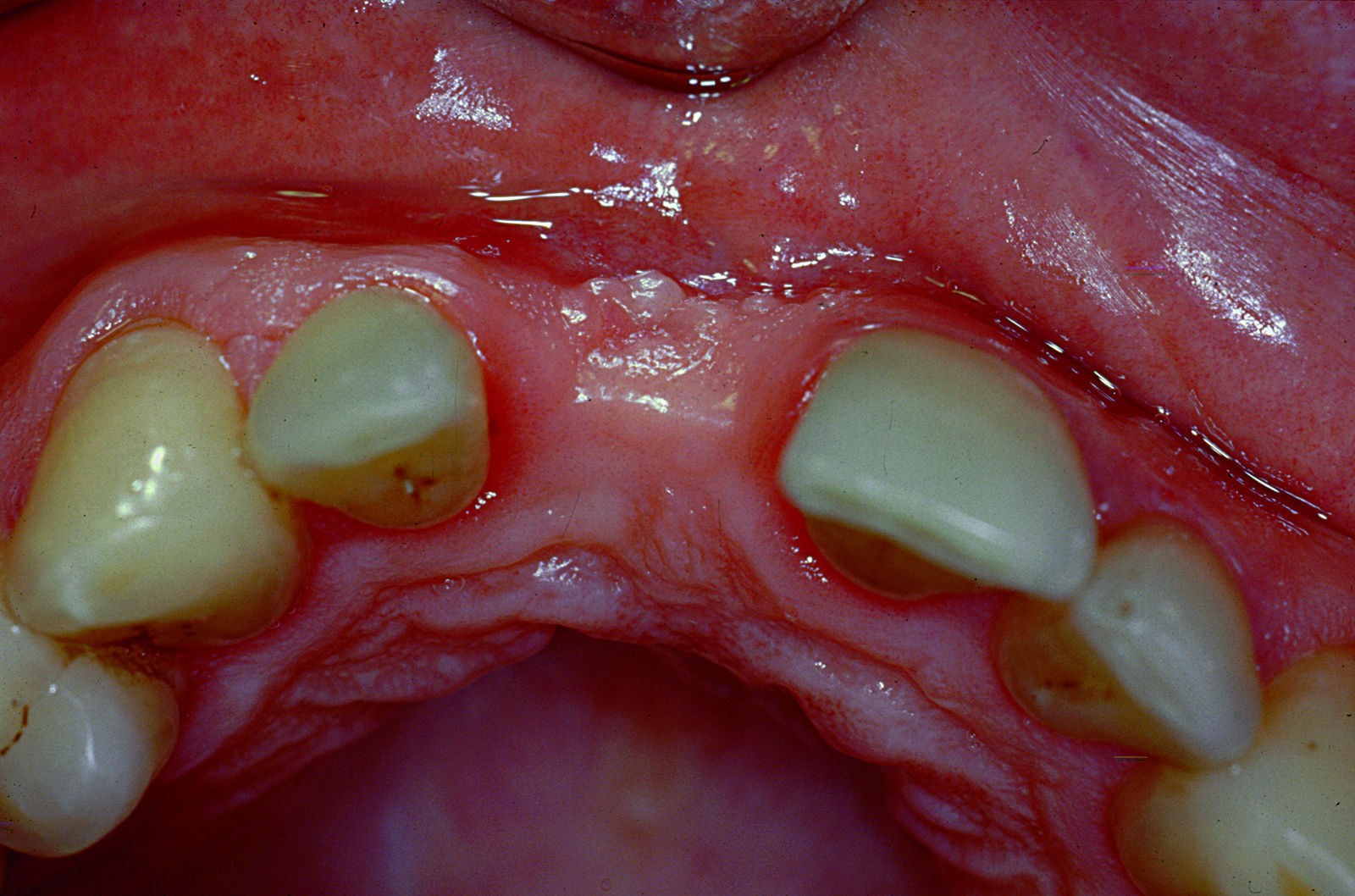
e la zona del prelievo comprende la corticale esterna tra il primo molare e il ramo (figure 1-3); - spina nasale, sito utilizzato in caso di piccoli difetti ossei in zona mascellare superiore anteriore;
- tuberosità, ideale per piccoli difetti ossei nella regione posteriore del mascellare superiore. La qualità ossea è minore rispetto agli altri siti di prelievo.
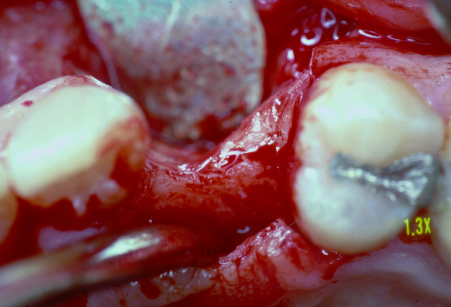
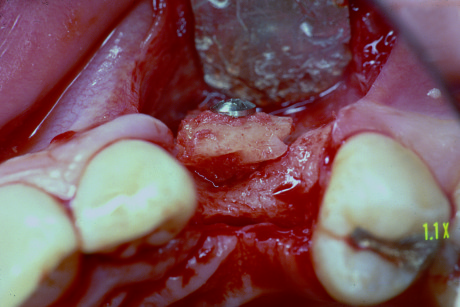
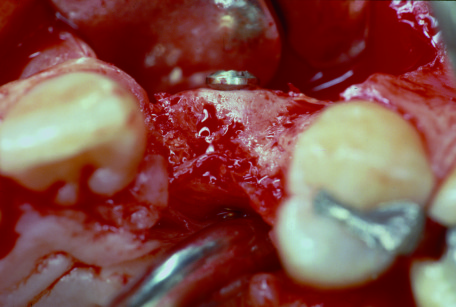
È stato suggerito che l’osso prelevato da siti intra-orali potesse avere benefici biologici, grazie alla sua origine embriologica30-32. In realtà, la maggior parte delle ossa dello scheletro ha un’origine endocondrale (da precursori cartilaginei). Con l’eccezione dell’osso alveolare, sia il mascellare superiore sia il corpo mandibolare hanno origine intramembranosa, mentre i condili si sviluppano per via endocondrale. Innesti di osso a origine intramembranosa hanno mostrato un minore riassorbimento rispetto a innesti di osso a origine endocondrale. Studi più recenti hanno indicato, invece, che l’origine embriologica dell’innesto osseo influenza il suo comportamento in virtù della proporzione esistente tra porzione corticale e spugnosa dell’innesto33. Occorre sottolineare che:
- una completa copertura dell’innesto da parte del lembo e una chiusura della ferita senza tensioni sono requisiti essenziali per il successo;
- l’innesto osseo deve essere rigidamente fissato e anche la stabilità degli impianti endossei è un fattore di primaria importanza;
- piccole perforazioni dell’osso sottostante l’innesto aumentano il reclutamento di cellule osteogeniche, accelerano la rivascolarizzazione, favoriscono i processi di guarigione e migliorano l’integrazione dell’innesto.
Rigenerazione ossea guidata
La GBR è essenzialmente guidata dal principio di guarigione a comparti. Nel 1957, Murray et al.34 hanno illustrato i principi che stanno alla base della ricostruzione tissutale. Questi autori hanno identificato tre fattori assolutamente necessari per la formazione di nuovo osso: stabilità e protezione del coagulo, presenza di cellule osteoblastiche e stretto contatto con tessuti vivi. La GBR è stata per la prima volta introdotta da Dahlin et al.35 nel 1988, in uno studio su 30 topi in cui difetti ossei mandibolari bilaterali venivano trattati in modo differente. I siti test venivano coperti con una membrana in e-PTFE, mentre i siti controllo erano semplicemente ricoperti con un lembo. Si ottenne una completa formazione di osso nei siti test, mentre i difetti presenti nei siti controllo furono riempiti quasi del tutto da tessuto connettivo con solo una piccolissima formazione di nuovo osso. Numerosi altri studi hanno sperimentato questa tecnica36,37. In tutti questi studi, la membrana andava a coprire i difetti ossei e si adattava alle superfici dell’osso circostante. Queste membrane avevano il compito di impedire la migrazione di cellule indesiderate nel difetto osseo dall’area della ferita e di favorire, invece, la colonizzazione e la proliferazione da parte delle cellule osteogeniche presenti nell’osso adiacente al difetto, così da indurre la guarigione della ferita e la contemporanea formazione di nuovo osso. La membrana, quindi, aveva il duplice ruolo di stabilizzare il coagulo e proteggerlo dall’arrivo di cellule non osteogeniche dai tessuti circostanti (epitelio e connettivo). Nei siti controllo, trattati senza l’utilizzo di membrane, vi era un’enorme prevalenza di formazione di tessuto connettivo fibroso, con minima e incompleta neoformazione di osso38.
Fattore critico di successo in GBR è il mantenimento dello spazio al di sotto della membrana: il suo collasso, infatti, è considerato la prima causa di fallimento della tecnica.
Altro fattore altrettanto determinante è la stabilità della membrana.
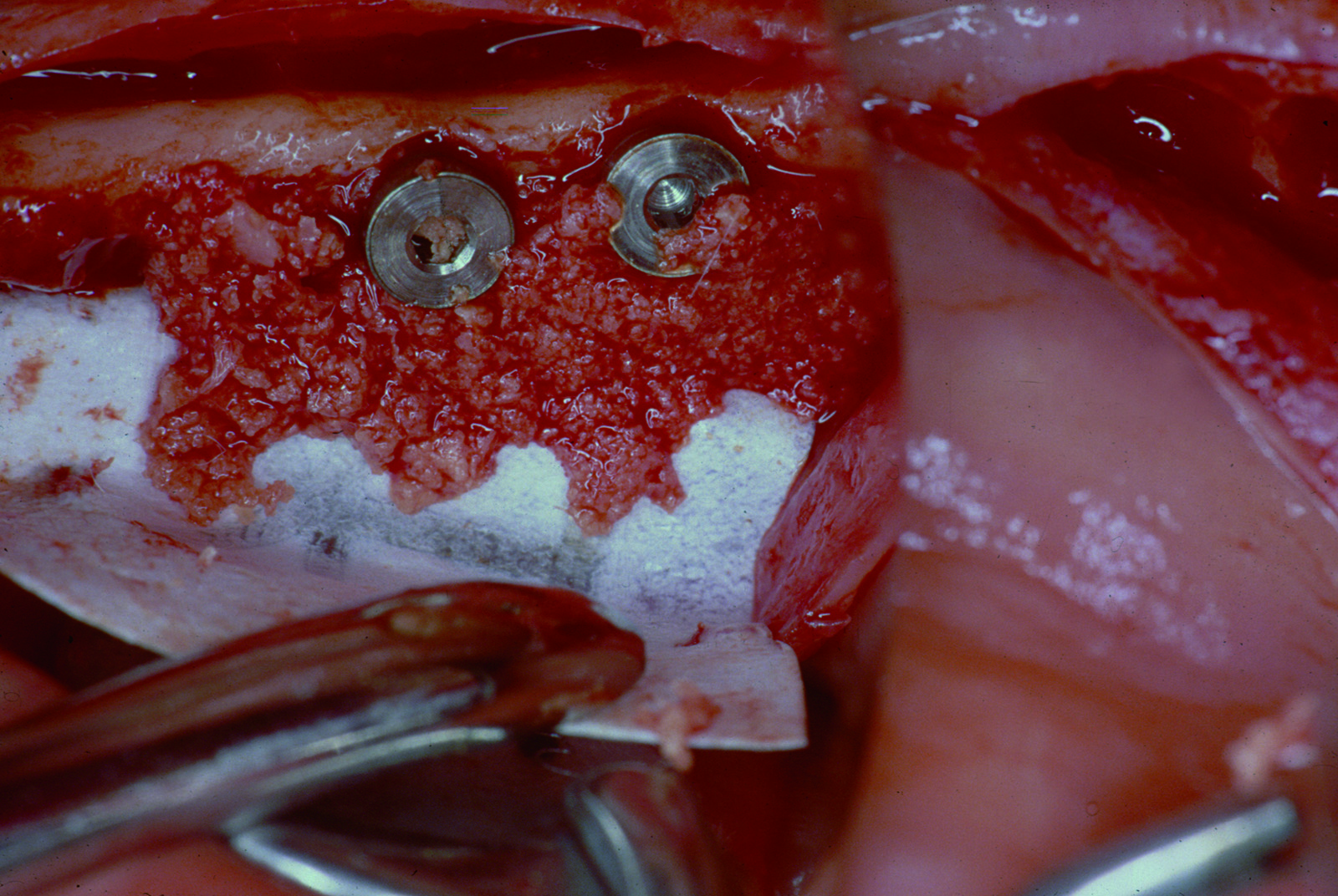
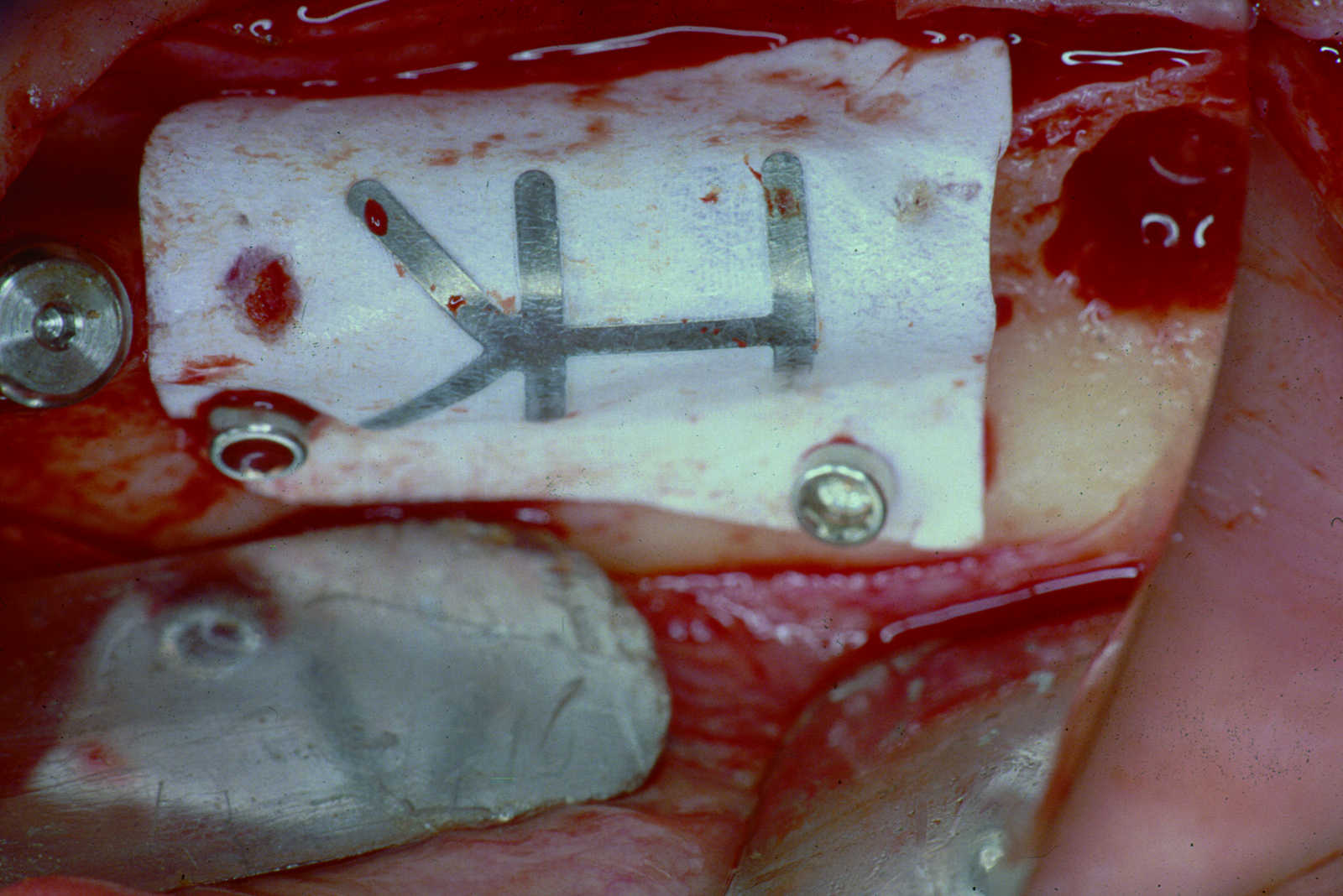
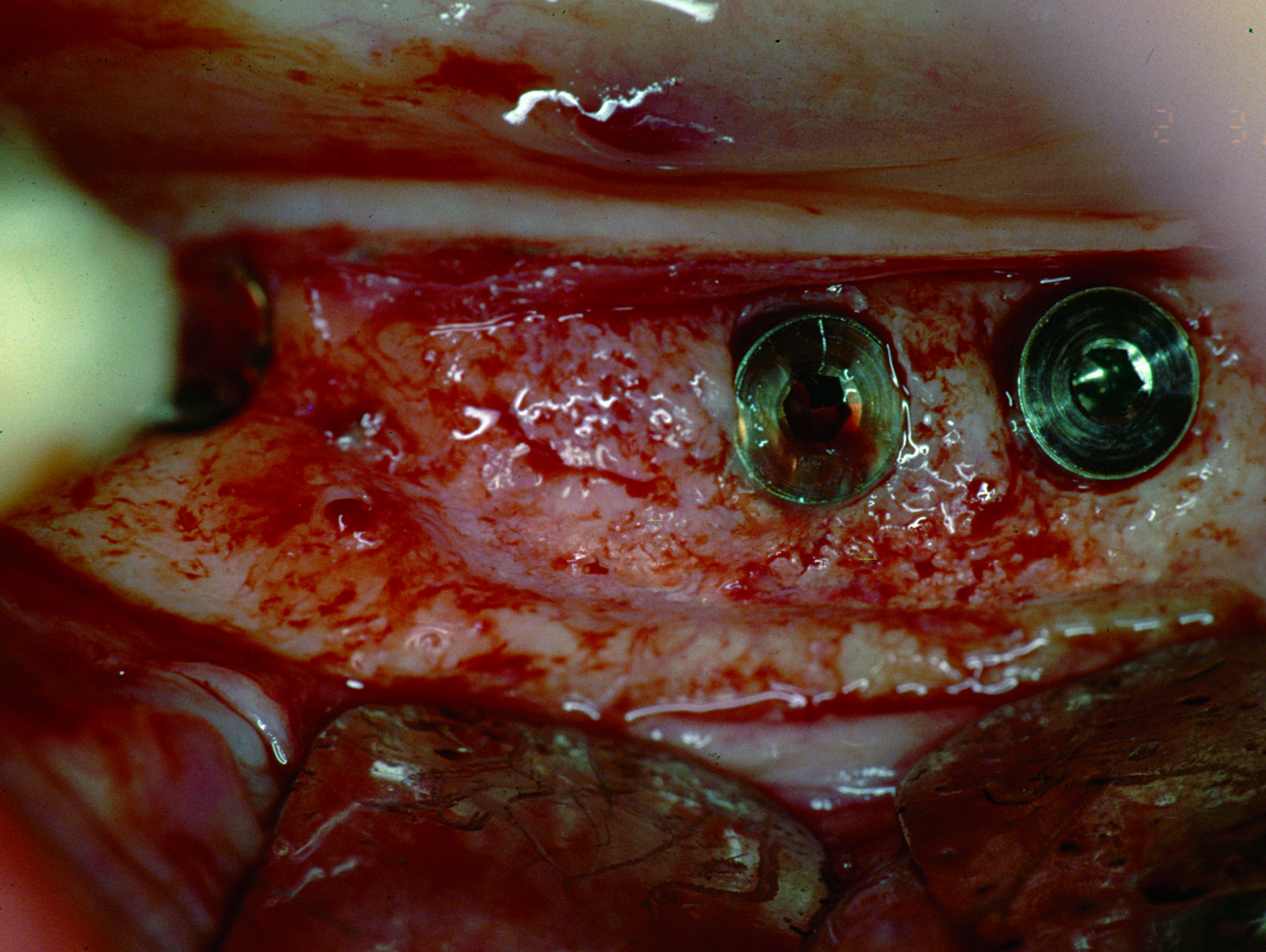
Hjorting-Hansen et al.39 hanno dimostrato che micromovimenti, anche di appena 20 µm, possono indurre le cellule mesenchimali a differenziarsi in fibroblasti anziché in osteoblasti. Dopo che Dalhin et al. dimostrarono i vantaggi dell’utilizzo di membrane nelle tecniche di ricostruzione ossea, molti autori le utilizzarono in associazione all’inserimento di impianti40,41. Un grande numero di differenti tecniche e materiali, comprese membrane riassorbibili e non, in associazione con innesti di osso autologo, allogenico, alloplastico, pins in titanio, griglie in oro e titanio, sono state proposte e utilizzate in GBR con risultati incoraggianti, per aumenti ossei sia verticali sia orizzontali42,43 (figure 4-8).
I difetti ossei verticali rappresentano una vera e propria sfida per il corretto inserimento di impianti. Riassorbimenti dell’osso alveolare in senso apico-coronale spesso impediscono l’inserimento di impianti sufficientemente lunghi con un rapporto corona-radice sfavorevole (figure 9-14).
Le tecniche che utilizzano membrane rinforzate in titanio come mantenitori di spazio hanno dato risultati positivi18,20. Simion et al.18 hanno utilizzato membrane rinforzate in titanio senza materiali da innesto per rigenerare osso verticale attorno a 15 impianti. Dopo 9 mesi di guarigione hanno ottenuto una rigenerazione verticale di osso media di 4 mm. Il nuovo tessuto duro formatosi, che un esame istologico ha rivelato essere osso, era ricoperto da uno spesso strato di tessuto connettivo denso (circa 2,1 mm). Gli autori hanno ipotizzato come cause della non completa rigenerazione ossea, micromovimenti della membrana durante la fase di guarigione, incompleta stabilizzazione del coagulo e formazione di uno spazio vuoto sotto la membrana.
Tinti e al.44 hanno modificato la tecnica chirurgica utilizzando innesti di osso autologo al di sotto delle membrane rinforzate in titanio, in modo tale da fornire un supporto meccanico alla membrana, una buona stabilità del coagulo e la riduzione dello spazio vuoto al di sotto della membrana stessa. Essi hanno ottenuto, dopo un periodo di guarigione di 12 mesi, un aumento verticale di osso medio di 7 mm attorno ai 14 impianti, con solo un sottile strato (meno di 1 mm) di tessuto connettivo a ricoprire il nuovo osso rigenerato. Gli stessi autori hanno confermato la buona predicibilità di tale tecnica in un recente studio retrospettivo su 18 pazienti a cui erano stati inseriti 48 impianti.
Simion e al.45 hanno comparato osso autologo e osso demineralizzato da banca (DFDBA, demineralized freeze-dried bone allograft) come materiali da innesto in associazione all’utilizzo con membrane rinforzate in titanio. In entrambi i casi si è ottenuta una buona rigenerazione verticale di osso, senza differenze tra un materiale e l’altro, con la formazione di un sottile strato di tessuto connettivo a coprire il nuovo osso formatosi. Qualora si abbia un’esposizione in cavità orale di una membrana non riassorbibile durante le fasi di guarigione, questa deve essere rimossa. In caso di esposizione, infatti, è stata dimostrata l’immediata colonizzazione da parte di batteri, sia all’esterno sia all’interno di essa. Simion et al.12 hanno riportato una percentuale di rigenerazione ossea del 41,6% in casi di esposizione della membrana, contro una percentuale del 96,6% in caso di non esposizione. Ciò suggerisce che la contaminazione batterica della membrana è un altissimo fattore di rischio in GBR, e questo è stato riscontrato, in modo particolare, per membrane in e-PTFE. Per quanto riguarda le membrane riassorbibili alcuni studi clinici ne hanno dimostrato la validità46-49.
Split crest
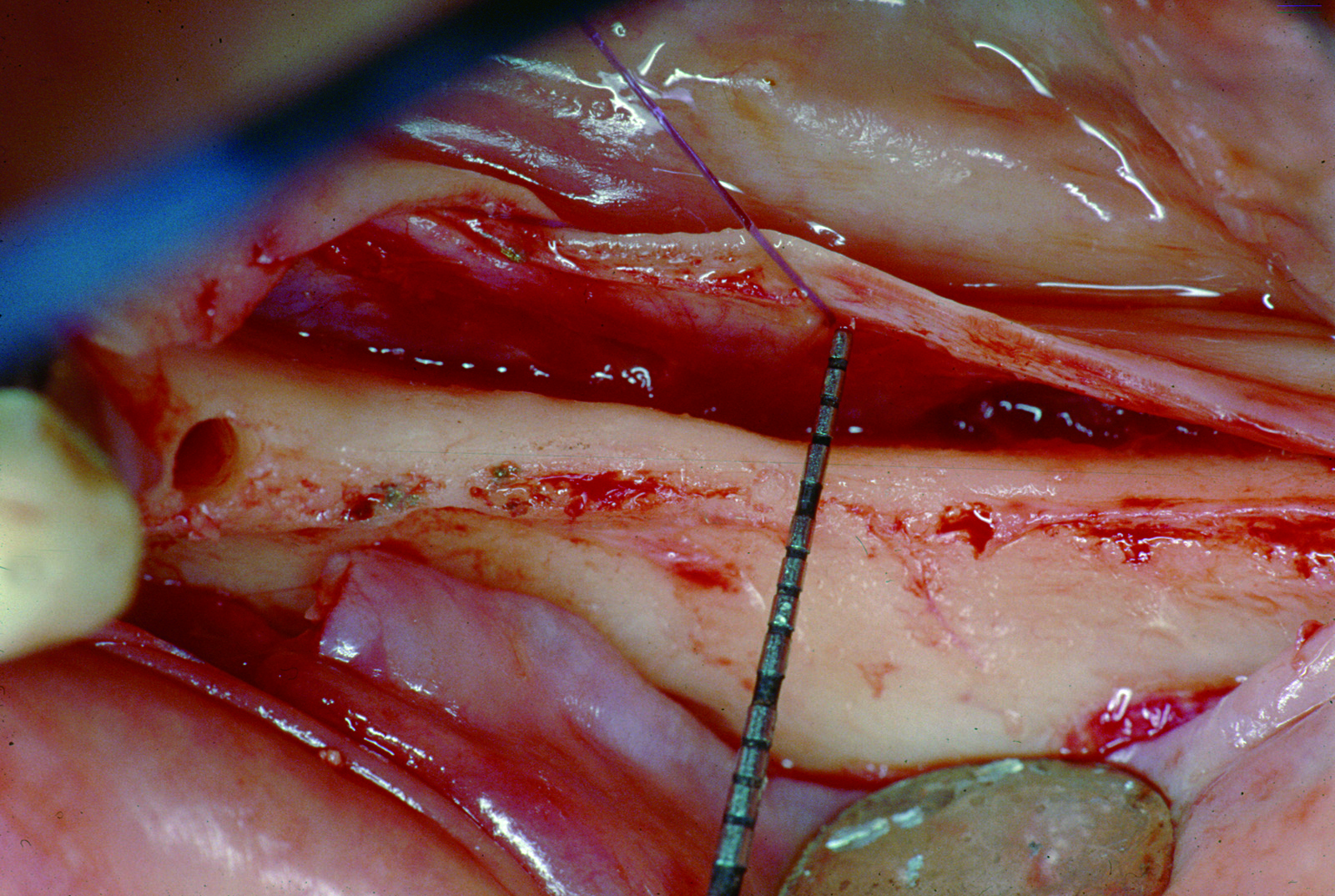
Nei pazienti con un’atrofia mascellare estremamente avanzata non è possibile posizionare un impianto immediato con le tecniche tradizionali, a causa della discrepanza tra lo spessore della cresta e il diametro dell’impianto. Una tecnica alternativa è la cosiddetta tecnica split crest (figure 15-17). Questa tecnica viene usata per ristabilire adeguate dimensioni oro facciali alle creste alveolari deficitarie durante l’inserimento dell’impianto. La rigenerazione ossea indotta da questa tecnica non è guidata da membrane e non richiede l’impianto di materiali osteoproduttivi o osteoconduttivi50,51.
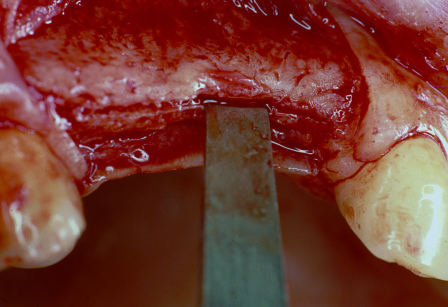
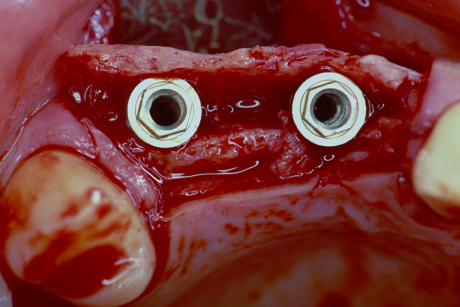
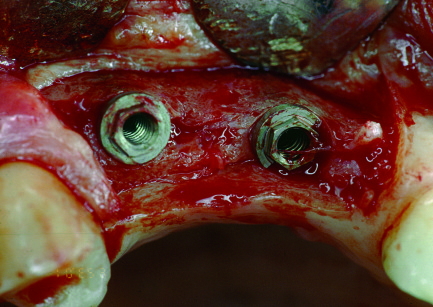
La tecnica split crest venne inizialmente utilizzata in adulti di giovane età per correggere i difetti dell’osso alveolare derivanti da traumi o agenesie di uno o più elementi dentali. In tali pazienti, la porzione buccale della cresta edentula è generalmente deformata da una perdita di osso avanzata.
Questa tecnica permette l’inserimento di impianti di dimensioni ideali, che si avvicinano approssimativamente a quelle delle radici che stanno rimpiazzando, in siti che normalmente vengono considerati inappropriati per una terapia implantare.
I passaggi base della tecnica split crest sono:
- viene sollevato un lembo a spessore parziale per esporre il sito implantare (ciò è molto importante al fine di preservare la vascolarizzazione);
- viene utilizzato uno scalpello per creare una fessura verticale intraossea;
- la parete ossea buccale viene mobilizzata e disposta vestibolarmente. La grandezza della fessura intraossea risultante è tra 4 e 8 mm al livello marginale;
- vengono inseriti impianti di misura appropriata e vengono stabilizzati all’interno del sito implantare;
- i lembi vengono suturati.
I due pre-requisiti base per la rigenerazione ossea sono:
- una solida base nutrizionale, derivante da uno spessore delle pareti ossee che va da 1 a 1,5 mm;
- una buona vascolarizzazione periostale, che permetta una nuova angiogenesi, necessaria per le trabecole ossee appena formate.
Corrispondenza
Prof. Ugo Covani
Istituto Stomatologico Tirreno
Ospedale Unico della Versilia
Via Aurelia 335 – 55043 Lido di Camaiore
direttore@istitutostomatologicotirreno.it
Roberto Cornelini1
Ugo Covani2
Massimiliano Carubbi3
Antonio Barone4
1 Professore a contratto, Università degli Studi di Genova; Fellow, Istituto Stomatologico Tirreno;
2.Professore straordinario, Università degli Studi di Pisa; Direttore, Istituto Stomatologico Tirreno.
3 Libero professionista in Rimini
4 Professore a contratto, Università degli Studi di Genova; Consulente, Istituto Stomatologico Tirreno.
2. Araujo MG, Lindhe J. Dimensional ridge alterations following tooth extraction. An experimental study in the dog. J Clin Periodontol 2005;32:212-218. 3. Cardaropoli G, Araujo MG, Lindhe J. Dynamics of bone tissue formation in tooth extraction sites. An experimental study in dogs. J Clin Periodontol 2003;30:809-818. 4. Johnson K. A study of the dimensional changes occurring in the maxilla following tooth extraction. Aust Dent J 1969;14:241-244. 5. Atwood DA. Reduction of residual ridges: a major oral entity. J Prosthet Dent 1971;26:266-279. 6. Tallgren A. The continuing reduction of the residual alveolar ridges in complete denture wearers: a mixed longitudinal study covering 25 years. J Prosthet Dent 1972;27:120-132. 7. Pietrokovski J, Starinsky R, Arensburg B, Kaffe I. Morphologic characteristics of bony edentulous jaws. J Prosthodont 2007;16:141-147. 8. Pietrokovski J, Kaffe I, Arensburg B. Retromolar ridge in edentulous patients: clinical considerations. J Prosthodont 2007;16:502-506. 9. Serino G, Biancu S, Iezzi G, Piattelli A. Ridge preservation following tooth extraction using a polylactide and polyglycolide sponge as space filler: a clinical and histological study in humans. Clin Oral Implants Res 2003 Oct;14(5):651-8. 10. Froum S, Cho SC, Rosenberg E, Rohrer M, Tarnow D. Histological comparison of healing extraction sockets implanted with bioactive glass or demineralized freeze-dried bone allograft: a pilot study. J Periodontol 2002 Jan;73(1):94-102. 11. Hahn E, Sonis S, Gallagher G, Atwood D. Preservation of the alveolar ridge with hydroxyapatite-collagen implants in rats. J Prosthet Dent 1988 Dec;60(6):729-34. 12. Simion M, Baldoni M, Rossi P, Zaffe D. A comparative study of the effectiveness of ePTFE membranes with and without early exposure during the healing period. Int J Period Rest Dent 1994a;14:166-180. 13. Zitzmann NU, Naef R, Schärer P. Resorbable versus non-resorbable membranes in combination with Bio-Oss for guided bone regeneration. Int J Oral Maxillofac Implants 1997;12:844-852. 14. Zubillaga G, Von Hagen S, Simon BI, Deasy MJ. Changes in alveolar bone height and width following post-extraction ridge augmentation using a fixed bioabsorbable membrane and demineralized freeze-dried bone osteoinductive graft. J Periodontol 2003 Jul;74(7):965-75. 15. Kay SA, Wisner-Lynch L, Marxer M, Lynch SE. Guided bone regeneration: integration of a resorbable membrane and a bone graft material. Pract Periodontics Aesthet Dent 1997 Mar;9(2):185-194. 16. O’Brien TP, Hinrichs JE, Schaffer EM. The prevention of localized ridge deformities using guided tissue regeneration. J Periodontol 1994;65:17-24. 17. Brown I. The effect of orthodontic therapy on certain types of periodontal defects. Clinical Findings 1973 Dec;44(12):742-56. 18. Simion M, Trisi P, Piattelli A. Vertical ridge augmentation using a membrane technique associated with osseointegrated implants. Int J Period Rest Dent 1994 Dec;14(6):496-511. 19. Jovanovic SA, Nevins M. Bone formation utilizing titanium-reinforced barrier membranes. Int J Period Rest Dent 1995 Feb;15(1):56-69. 20. Cornelini R, Cangini F, Covani U, Andreana S. Simultaneous implant placement and vertical ridge augmentation with a titanium-reinforced membrane: a case report. Int J Oral Maxillofac Impl 2000 Nov-Dec;15(6):883-7. 21. Bucholz RW, Carlton A, Holmes RE. Hydroxyapatite and tricalcium phosphate bone graft substitutes. Orthop Clin North Am 1987 Apr;18(2):323-34. 22. Elsinger EC, Leal L. Coralline hydroxyapatite bone graft substitutes. J Foot Ankle Surg 1996 Sep-Oct;35(5):396-9. 23. Guillemin G, Patat JL, Fournie J, Chetail M. The use of coral as a bone graft substitute. J Biomed Mater Res 1987 May;21(5):557-67. 24. Peltola M, Suonpaa J, Aitasalo K, Maattanen H, Andersson O, Yli-Urpo A, Laippala P. Experimental follow-up model for clinical frontal sinus obliteration with bioactive glass (S53P4). Acta Otolaryngol Suppl 2000;543:167-9. 25. Orsini G, Ricci J, Scarano A, Pecora G, Petrone G, Iezzi G, Piattelli A. Bone-defect healing with calcium-sulfate particles and cement: an experimental study in rabbit. J Biomed Mater Res B Appl Biomater 2004 Feb 15;68(2):199-208. 26. Cornelini R, Cangini F, Martuscelli G, Wennström J. Deproteinized bovine bone and biodegradable barrier membranes to support healing following immediate placement of transmucosal implants: a short-term controlled clinical trial. Int J Period Rest Dent 2004 Dec;24(6):555-63. 27. Bauer TW, Muschler GF. Bone graft materials. An overview of the basic science. Clin Orthop 2000 Feb;371:10-27. 28. Goldberg VM, Stevenson S. Natural history of autografts and allografts. Clin Orthop 1987 Dec;225:7-16. 29. Gross TP, Jinnah RH, Clarke HJ, Cox QG. The biology of bone grafting. Orthopedics 1991 May;14(5):563-8. 30. Usiak JF, Zins JE, Whitaker LA. The early revascularization of membranous bone. Plast Reconstr Surg 1985 Oct;76(4):510-6. 31. Hardesty RA, Marsh JL. Craniofacial onlay bone grafting: a prospective evaluation of graft morphology, orientation, and embryonic origin. Plast Reconstr Surg 1990 Jan;85(1):5-14. 32. Alonso N, Machado de Almeida O, Jorgetti V, Amarante MT. Cranial versus iliac onlay bone grafts in the facial skeleton: a macroscopic and histomorphometric study. J Craniofac Surg 1995 Mar;6(2):113-8. 33. Ozaki W, Buchman SR. Volume maintenance of onlay bone grafts in the craniofacial skeleton: micro-architecture versus embryologic origin. Plast Reconstr Surg 1998 Aug;102(2):291-9. 34. Murray G, Holden R, Roschlau W. Experimental and clinical study of new growth of bone in a cavity. Am J Surg 1957 Mar;93(3):385-7. 35. Dahlin C, Linde A, Gottlow J, Nyman S. Healing of bone defects by guided tissue regeneration. Plast Reconstr Surg 1988;81:672-676. 36. Dahlin C, Gottlow J, Linde A, Nyman S. Healing of maxillary and mandibular bone defects using a membrane technique. An experimental study in monkeys. Scand J Plast Reconstr Hand Surg 1990;24:13-19. 37. Linde A, Alberius P, Dahlin C, Bjurstam K, Sudin Y. Osteopromotion: a soft tissue exclusion principle using a membrane for bone healing and bone neogenesis. J Periodontol 1993;64:1116-28. 38. Schenk R, Buser D, Hardwick W, Dahlin C. Healing pattern of bone regeneration in membrane-protected defects. A histologic study in the canine mandible. Int J Oral Maxillofac Implants 1994;9:13-29. 39. Hjorting-Hansen E, Worsaae N, Lemons J. Histologic response after implantation of porous hydroxylapatite ceramic in humans. Int J Oral Maxillofac Implants1990;5:255-263. 40. Dahlin C, Sennerby L, Lekholm U, Linde A, Nyman S. Generation of new bone around titanium implants using a membrane technique: An experimental study in rabbits. Int J Oral Maxillofac Implants 1989; 4:19-25. 41. Becker W, Becker B. Guided tissue regeneration for implants placed into extraction sockets and for implants dehiscences: surgical techniques and case report. Int J Periodont Rest Dent 1990;10:377-391. 42. Mellonig JT, Nevins M. Guided bone regeneration of bone defects associated with implants: An evidence-based outcome assessment. Int J Period Rest Dent 1995;15(2):168-185. 43. Lorenzoni M, Pertl C, Keil C, Wegscheider WA. Treatment of peri-implant defects with guided bone regeneration: a comparative clinical study with various membranes and bone grafts. Int J Oral Maxillofac Implants 1998;13(5):639-646. 44. Tinti C, Parma-Benfenati S. Vertical ridge augmentation: surgical protocol and retrospective evaluation of 48 consecutively inserted implants. Int J Period Rest Dent 1998;18(5):434-443. 45. Simion M, Jovanovic SA, Trisi P, Scarano A, Piattelli A. Vertical ridge augmentation around dental implants using a membrane technique and autogenous bone or allografts in humans. Int J Period Rest Dent 1998;18(1):8-23. 46. Aaboe M, Pinholt EM, Hjorting Hansen E, Solheim E, Praetorius F. Guided tissue regeneration using degradable and nondegradable membranes in rabbit tibia. Clin Oral Impl Res 1993;4:172-176. 47. Godefroy J, Laroche N, Foucart J, Boivin G. Ridge reconstruction after implant failure using a resorbable membrane: report of a case and histologic study. Int J Oral Maxillofac Implants 1994;9:431-436. 48. Lundgren D, Sennerby L, Falk H, Friberg B, Nyman S. The use of a new bioresorbable barrier for guided bone regeneration in connection with implant installation. Case reports. Clin Oral Impl Res 19945:177-184. 49. Cornelini R, Cangini F, Martuscelli G, Wennstromm J. Deproteinized bovine bone and biodegradable barrier membranes to support healing following immediate placement of transmucosal dental implants. A short-term controlled clinical trial. Int J Period Rest Dent 2004;24:555-563. 50. Scipioni A, Bruschi GB, Calesini G. The edentulous ridge expansion technique: a five-year study. Int J Period Rest Dent 1994;14:451-9. 51. Scipioni A, Bruschi GB, Calesini G, Bruschi E, De Martino C. Bone regeneration in the edentulous ridge expansion technique: histologic and ultrastructural study of 20 clinical cases. Int J Period Rest Dent 1999;19:269-77.
1. Schropp L, Wenzel A, Kostopoulos L, Karring T. Bone healing and soft tissue contour changes following single-tooth extraction: a clinical and radiographic twelve-month prospective study. Int J Period Rest Dent 2003;23:313-323.