Si parla di peso estremamente basso alla nascita (ELBW-Extremely Low Birth Weight) quando il neonato pesa meno di 1000 grammi. Il basso peso alla nascita può avere diverse cause, prima fra tutte un parto prematuro (prima della 37a settimana di gestazione). In Ungheria il tasso complessivo di parti prematuri è considerato ancora elevato, benché si attesti da anni attorno all’8-10%. Ogni anno nel mondo si registrano 15 milioni di parti prematuri, 1 su 10, e questa cifra è in costante aumento1.
La sopravvivenza è correlata all’età gestazionale e i neonati ELBW sono più suscettibili a ogni tipo di complicanze, tra cui problemi cardiaci e respiratori, insufficienza renale, paralisi cerebrale, disturbi del neurosviluppo, difficoltà ad alimentarsi e a mantenere un’adeguata temperatura corporea, malattie metaboliche e deficit cognitivi2-5. A causa dell’immaturità degli organi, questi neonati richiedono terapie farmacologiche, intubazione e ventilazione assistita per periodi prolungati. Le infezioni sono un problema importante tra i bambini prematuri con basso peso alla nascita. I tassi di infezione aumentano con il diminuire del peso alla nascita e di conseguenza aggravano il rischio di complicanze neonatali e di ospedalizzazione. Gli interventi terapeutici perinatali e neonatali, benché associati a numerosi effetti benefici e a una riduzione della mortalità, possono determinare sequele avverse durante la prima infanzia6. Lo scopo del presente studio è stato quello di valutare le ripercussioni a livello dentale di un peso estremamente basso alla nascita tra i sopravvissuti seguiti presso l’Unità di terapia intensiva neonatale del Dipartimento pediatrico dell’università di Debrecen.
Metodi e materiali
Il progetto di ricerca è stato approvato dal Comitato etico per la ricerca dell’università di Debrecen e i genitori hanno rilasciato il consenso informato scritto. Nello studio sono stati inclusi cinquantasei bambini ELBW (da 5 a 14 anni) che frequentavano regolarmente l’ambulatorio di neonatologia del Centro clinico dell’università di Debrecen per le visite di follow up.
Il criterio di selezione è stato il peso alla nascita (<1000 g). Sono stati esclusi i bambini con sindromi genetiche. Come gruppo di controllo sono stati selezionati 56 bambini con peso normale alla nascita (NBW – Normal Birth Weight) di età e sesso corrispondenti; questi bambini erano tutti nati a termine, con peso alla nascita superiore a 2500 g e nessuno di loro era stato sottoposto a terapia farmacologica, né intubato durante il periodo neonatale. Gli esami dentali sono stati eseguiti presso il Dipartimento di odontoiatria e ortodonzia pediatrica, Facoltà di odontoiatria dell’università di Debrecen, da un unico esaminatore. Oltre al normale screening dentale e al rilevamento degli indici DMFT e dmft, è stata valutata l’eventuale presenza di ipoplasie, opacità e discolorazione dello smalto. L’ipoplasia è stata definita come una mancanza di continuità dello smalto, l’opacità come un’alterazione della traslucenza senza perdita di smalto.
Sono state esaminate tutte le superfici dentali e tutte le anomalie ortodontiche e i dati sono stati registrati in una cartella clinica7. Le anamnesi mediche della madre e del bambino sono state ottenute dalla madre. Sono state chieste informazioni sulle abitudini alimentari e di igiene orale, sulla frequenza e sul tipo di snack infrapasto. I dati sono stati analizzati statisticamente mediante test-t di Student e correlazione di Pearson, con livelli di significatività P minori di 0,05.
Risultati
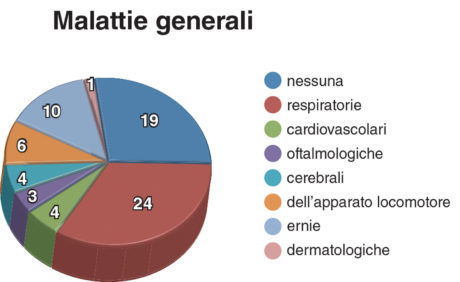
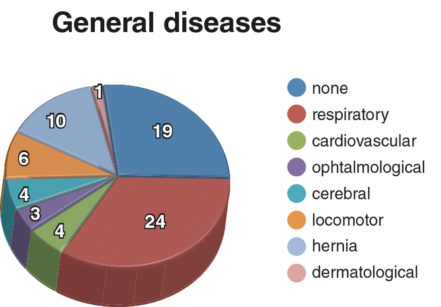
Il gruppo ELBW era composto da 56 bambini, 31 maschi e 25 femmine. Il peso alla nascita variava da 420 a 990 g (media 796,8±193,4 g). L’età media era di 8 anni (±DS=2,36). Il peso medio alla nascita del gruppo di controllo corrispondente per età e sesso era compreso tra 2600 e 3860 g (media 3200 grammi ±DS=660). Le malattie sistemiche presenti nel gruppo ELPBW sono illustrate in Figura 1. Nel gruppo NBW un solo bambino era affetto da malattia ematologica. Tutti i bambini del gruppo NBW e la maggioranza dei bambini del gruppo ELBW (85,71%) avevano sospeso le terapie farmacologiche, mentre il 14,28% dei bambini ELBW assumeva ancora farmaci.
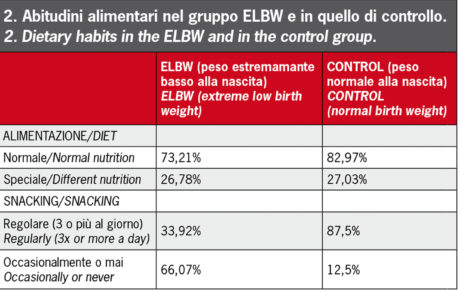
In base alle abitudini alimentari sono stati individuati due gruppi. I bambini appartenenti al primo gruppo seguivano una dieta normale equilibrata, mentre i bambini del secondo gruppo seguivano una dieta speciale (vegetariana, priva di glutine e di lattosio ecc.) (Figura 2).
In base alla routine di igiene orale dei bambini, sono stati individuati quattro gruppi principali. Nel primo, i bambini si lavavano i denti da soli, nel secondo gruppo erano le madri a lavare i denti ai bambini, nel terzo gruppo i bambini si lavavano i denti con l’aiuto delle madri e nell’ultimo i bambini non si lavavano affatto i denti. La distribuzione dei diversi tipi di igiene orale nel gruppo ELBW e in quello di controllo è illustrata in Figura 3.
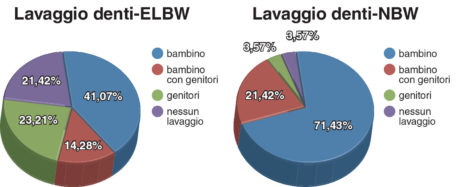
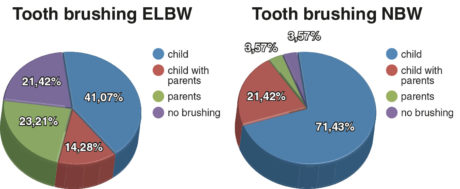
Non sono stati riscontrati casi di cheiloschisi e/o palatoschisi in nessuno dei due gruppi. Le anomalie ortodontiche diagnosticate sono state principalmente morso profondo, affollamento dentale, anomalie di II classe di Angle nel gruppo ELBW (37,50%). Nel gruppo dei bambini NBW le stesse anomalie ortodontiche sono state riscontrate nel 25% dei casi. Nel gruppo ELBW il reperto più frequente è risultato l’attrito grave nel segmento anteriore (32,14%).
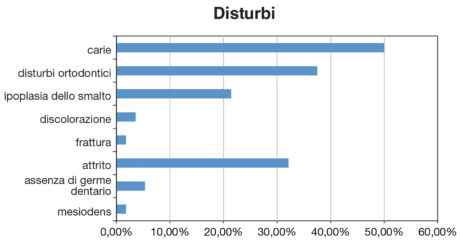
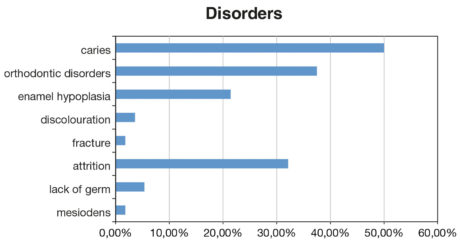
Tra i bambini del gruppo ELBW, il 21,42% presentava ipoplasia dello smalto, il 3,57% opacità, l’aplasia è stata riscontrata in 5 casi (5,35%). L’1,78% dei bambini presentava cricche o fratture dello smalto dovute a porosità o debolezza. Nell’1,78% dei casi è stata riscontrata la presenza di mesiodens (Figura 4). Nel gruppo NBW non sono state osservate malattie né aplasia dello smalto. La presenza di carie è stata rilevata nel 50% dei bambini ELBW, dt=2,67 e dmft=2,67, DT=0,107 e DMFT=0,23. Nel gruppo di controllo la carie è stata rilevata in 41 bambini (73,21%), dt=3,2, dmft=3,81 mentre DT=0,1 e DMFT=0,21.
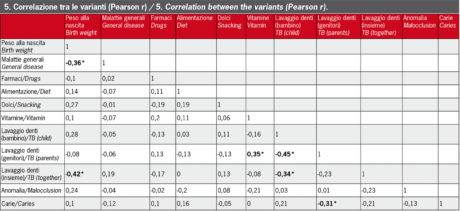
Abbiamo riscontrato una correlazione significativa tra (Figura 5):
- peso alla nascita e malattie respiratorie (r=0,39) o muscoloscheletriche (r=0,36);
- peso alla nascita e lavaggio dei denti con l’aiuto della madre (r=-0,42);
- problemi di udito e opacità dello smalto (r=0,41);
- malattie dermatologiche e aplasia (r=0,49);
- assunzione di vitamine e igiene orale (lavaggio dei denti del bambino da parte della madre) (r=0,35);
- disturbi del sistema nervoso e malattie della vista o muscoloscheletriche (r=0,32).
Discussione
La definizione “basso peso alla nascita” (LBW – Low Birth Weight) si riferisce solo a neonati di peso pari o inferiore a 2500 g al momento del parto, indipendentemente dall’età gestazionale o dalla causa. La classificazione dei neonati LBW può essere ulteriormente suddivisa in “peso molto basso alla nascita” (VLBW – Very Low Birth Weight: 1000-1499 g) e “peso estremamente basso alla nascita (ELBW – Extremely Low Birth Weight: 500-990 g). Secondo la definizione fornita dall’Organizzazione mondiale della sanità, un parto è considerato prematuro quando si verifica prima della 37a settimana di gestazione o quando il peso del neonato è inferiore a 2500 g8. L’eziologia del parto prematuro e del basso peso alla nascita è multifattoriale e può essere correlata a malattie del feto o della madre, sebbene in circa il 50% dei casi l’eziologia rimanga sconosciuta9. Dal punto di vista del dentista, la salute orale della madre è importante. Recenti evidenze microbiologiche e cliniche supportano il ruolo delle malattie parodontali materne nell’esito sfavorevole della gravidanza. La malattia parodontale si verifica in una percentuale relativamente elevata di donne gravide che sono esposte a un rischio significativo di avere un parto prematuro e di partorire un neonato con basso peso alla nascita10.
Con l’introduzione delle moderne cure mediche intensive, il tasso di mortalità è calato drasticamente; anche i neonati più piccoli e di poche settimane riescono a sopravvivere, ma il tasso di morbilità rimane elevato. Il parto prematuro e il peso estremamente basso alla nascita comportano notevoli ripercussioni sulla salute e sulla qualità della vita del bambino3. Non solo l’immaturità degli organi, ma anche lo stesso intervento del medico possono causare sequele tardive tra le quali rientrano le malattie dentali. I problemi possono verificarsi nel periodo prenatale, perinatale o postnatale. La possibile causa del difetto dentale può essere correlata al danneggiamento degli ameloblasti e della loro funzione dovuto a vari fattori di rischio che possono influenzare i denti, soprattutto nella delicata fase dello sviluppo. La qualità e quantità dello smalto dipendono soprattutto dalla corretta funzione degli ameloblasti, dall’adeguata disponibilità di calcio e fosforo, dalla presenza di vitamine (D, A, C) necessarie per il processo di amelogenesi11. Secondo Seow, nei neonati prematuri lo smalto è di circa il 20% più sottile rispetto ai neonati a termine; la maggior parte della riduzione interessa lo smalto che si forma nella fase prenatale e che risulta 5-13 volte più sottile rispetto ai bambini nati a termine. Lo spessore “recuperato” nella fase postnatale non riesce a compensare completamente la riduzione del periodo prenatale12.
Anche la stagione del parto può influenzare lo smalto; la luce del sole, la temperatura, la disponibilità di minerali e vitamine durante la gravidanza possono condizionarne lo spessore indipendentemente dal peso alla nascita. Queste variabili determinano lo spessore dello smalto che si forma nella fase prenatale e ne influenzano in modo determinante lo strato totale13. Le variazioni nel contenuto di calcio e fosfato degli ameloblasti possono dipendere dal deficit di vitamina D, perché i recettori della vitamina D che regolano l’assorbimento di calcio e fosfato si trovano anche negli ameloblasti. In presenza di un deficit di vitamine e minerali, la secrezione e mineralizzazione dello smalto rallentano11. La calcificazione iniziale degli incisivi centrali primari inizia tra la 12a e la 16a settimana di gestazione. I bambini ELBW sono esposti a un rischio doppio di malattie dello smalto rispetto ai bambini NBW. I nostri dati che indicano una frequenza significativamente più elevata dei difetti dello smalto nei bambini ELBW (21,4%) sono confermati da diversi studi14-16. Sebbene Seow17 abbia riferito una relazione diretta tra il peso alla nascita e la prevalenza di difetti dello smalto, non abbiamo potuto riscontrare alcuna correlazione tra peso e malattie nel gruppo ELBW. Molto probabilmente un peso alla nascita inferiore a 1000 g rappresenta un rischio sufficiente per l’ipoplasia dello smalto, un’ulteriore riduzione del peso corporeo non ha un’influenza più significativa sull’occorrenza della malattia.
La nostra ipotesi che l’immaturità, la cura intensiva e i farmaci, l’omeostasi elettrolitica sbilanciata e la prevalenza significativamente più elevata di ipoplasia dello smalto rendano i denti più vulnerabili e suscettibili alla carie non è stata confermata. Benché gli autori abbiano individuato una stretta connessione tra peso alla nascita, ipoplasia dello smalto e carie, i nostri risultati concordano con quelli di Burt18, che non ha rilevato alcuna associazione tra peso alla nascita, ipoplasia dello smalto e carie. Nonostante la maggiore prevalenza di difetti dello smalto, il tasso di carie nei bambini ELBW non è risultato significativamente più elevato rispetto ai bambini NBW, ma addirittura leggermente inferiore. Il motivo può essere duplice. Innanzitutto, oltre alle stesse abitudini alimentari il consumo di snack era più comune nel gruppo NBW. La frequenza e la quantità di snack consumati dai bambini ELBW risultava inferiore e concorde con i risultati di Ghasempour19. In secondo luogo abbiamo individuato una correlazione tra il peso alla nascita e le abitudini di igiene orale. Quanto minore il peso alla nascita, tanto più intenso l’intervento materno per aiutare il bambino a lavarsi i denti.
Alves20 ha rilevato una maggiore incidenza di anomalie orali tra il gruppo di bambini LBW intubati e quello di bambini NBW non intubati. Non abbiamo individuato alcuna differenza significativa tra il gruppo ELBW e il gruppo NBW rispetto all’occorrenza di anomalie ortodontiche. Probabilmente questo è dovuto all’uso di tubi nasotracheali anziché orotracheali. I tubi orotracheali sono stati associati allo sviluppo di palatoschisi acquisita, solchi alveolari, asimmetria e anche aplasia e disturbi dello smalto21. Secondo Ash22 in caso di parto prematuro e peso basso alla nascita, la scafocefalia tipica dei prematuri può causare un palato stretto, con volta palatina alta, peggiorato dalla posizione scorretta della testa che contribuisce al cedimento del palato. Anche la qualità e il tipo di alimentazione del neonato possono influenzare lo sviluppo del bambino, le eventuali malattie e il futuro benessere. La strategia per evitare un ritardo della crescita mira a fornire un adeguato e costante apporto di nutrienti. Il latte della madre è l’alimento d’elezione per i neonati prematuri, ma non fornisce la quantità necessaria di proteine; quindi il latte umano deve essere integrato con nutrienti, lipidi, minerali, soprattutto calcio e fosforo, e vitamine23. Il vantaggio dell’allattamento al seno per i neonati prematuri sembra essere addirittura maggiore che per i bambini nati a termine. Tuttavia, avviare l’allattamento al seno in questo gruppo è spesso problematico a causa della minore forza muscolare, della difficoltà a respirare, succhiare e inghiottire. Gli studi dimostrano che l’esperienza e la pratica migliorano le capacità motorie orali e il coordinamento nel succhiare-inghiottire-respirare e aumentano la quantità di latte alla suzione24,25.
È stato inoltre dimostrato che l’insegnamento ripetuto può facilitare la suzione e accelerare la maturazione e il coordinamento muscolare; inoltre i movimenti di lingua e muscoli hanno un effetto benefico sullo sviluppo dei mascellari26.
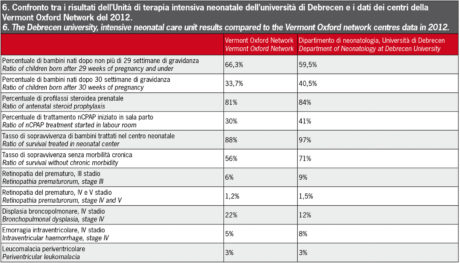
Vi sono differenze pratiche marcate tra i centri neonatali per quanto riguarda i tubi utilizzati per la ventilazione, le pratiche nutrizionali, i farmaci somministrati, ma possiamo affermare con orgoglio che i risultati della nostra università sono tra i migliori, come illustrato in Figura 627. È necessario sottolineare l’importanza della collaborazione tra ginecologo e dentista per la prevenzione di problemi in gravidanza correlati alla parodontite e tra neonatologo e dentista per la prevenzione di problemi orali. L’educazione dei genitori è essenziale per il mantenimento di una buona salute orale, soprattutto nei neonati prematuri ELBW, che sono esposti a un rischio maggiore di problemi dentali. Il frequente monitoraggio non solo dell’igiene orale, ma anche della carie e dei problemi di sviluppo, è importante dopo l’eruzione dei primi denti. È necessario limitare cibi e bevande ricchi di carboidrati e offrire al bambino una dieta sana ed equilibrata (Figure 7a-7b).
Corrispondenza/Correspondence
Dr. Alberth Márta
alberth.marta@dental.unideb.hu
Dipartimento di odontoiatria e ortodonzia pediatrica,
Facoltà di odontoiatria, Università di Debrecen, Ungheria/Department of paediatric dentistry and orthodontics, Faculty of dentistry, University of Debrecen, Hungary
2. Kajantie E, Hovi P. Is very preterm birth a risk factor for adult cardiometabolic disease? Seminars in fetal & neonatal medicine 2014;19:112-7.
3. Kosloske AM. Epidemiology of necrotizing enterocolitis. Acta Paediatr Suppl 1994;396:2-7.
4. Platt MJ, Cans CH, Johnson A et al. Trends in cerebral palsy among infants of very low birthweight (<1500 g) or born prematurely (<32 weeks) in 16 european centers: a database study. Lancet 2007;369:43-50.
5. Richard A, Ehrenkranz MD. Ongoing issues in the intensive care for the periviable infant. Nutritional management and prevention of bronchopulmonary dysplasia and nasocomial infections. Seminars of perinatology 2014;38:25-30.
6. Blencowe H, Cousens S, Chou D, Oestergaard M, Say L et al. Born too soon: the global epidemiology of 15 million preterm births. Reproductive Health 2013;10(Suppl 1):S2.
7. FDI Commission on oral health, research and epidemiology: a review of the developmental defects of enamel index (DDE index). Int Dent J 1992;42(6)411-26.
8. de Bernabé JV, Soriano T, Albaladejo R et al. Risk factors for low birth weight: a review. Eur J Obsterics Gyn and Reproductive Biol 2004;116:3-15.
9. Goldenberg RL, Culhane JF, Iams JD, Romero R. Epidemiology and causes of preterm birth. Lancet 2008;371:75-8.
10. Dortbudak O, Eberhardt R, Ulm M, Person GR. Periodontitis, a marker of risk in pregnancy for preterm birth. J Clin Periodontol 2005;32:45-52.
11. Seow WK, Maasel JP, Weir C et al. Mineral deficiency in the pathogenesis of enamel hypoplasia in prematurely born, very low birth weight children. Pediatr Dent 1989;11:297-302.
12. Seow WK, Tsang A, Young WG, Daley T. A study of primary dental enamel from preterm and full term children using light and scanning electron microscopy. Pediatr Dentistry 2005;27:374-9.
13. Zadzinska E, Kurek M, Borowska-Struginska B et al. The effect of the season of birth and selected maternal factors on linear enamel thickness is modern human deciduous incisors. Arch Oral Biol 2013;58:951-63.
14. Nelson S, Albert JM, Geng C, Curtan S, Lang K et al. Increased enamel hypoplasia and very low birthweight infants. J Dent Res 2013;92(9):788-94.
15. Weeheijm Kl, Duggal M, Mejáre I et al. Judgment criteria for molar incisor hypomineralization in epidemiological studies: a summary of the European meeting on MIH held in Athens. Eur J Paediatr Dent 2003;4:110-3.
16. Soewondo W, Effendi SH. The incidence of enamel hypoplasia and hypocalcification in low birth weight children according to teeth type. e-Journal of Dentistry 2012;2:200-5.
17. Seow WK, Humphrys C, Tudehope DI. Increased prevalence of development dental defects in low birth weight prematurely born children in a controlled study. Pediatr Dent 1987;9:221-5.
18. Burt BA, Pai S. Does low birth weight increase the risk of caries? A systemic review. Int Dent Educ 2001;65:1024-7.
19. Ghasempour M, Ahmadpour-Kocho M, Heikhi S. Dental caries in pre-term and low birth weight children and related factors. J Contemp Dent Prac 2009;10:051-8.
20. Alves PV, Luiz RR. The influence of orotracheal intubation on the oral tissue development in preterm infants. Oral Health Prev Dent 2012;10:141-7.
21. Kopra DE, Davis EL. Prevalence of oral defects among neonatally intubated 3 to 5 and 7 to 10 year old children. Pediatr Dent 1991;13:349-55.
22. Ash SP, Orth D, Moss JP et al. An investigation of the features of pre-term infant palate and the effect of prolonged orothracheal intubation with and without protective appliances. Br J Orthod 1987;14:253-61.
23. Lapillone A, Groh-Wargo S, Lozano Gonzales CH et al. Lipid needs of preterm infants: updated recommendations. J Pediatr 2013;162:S37-47.
24. Field TM. Stimulation of preterm infants. Pediatr Rev 2003;24(1):4-11.
25. Simpson C, Schanler Rj, Lau C. Early introduction of oral feeding in preterm infants. Pediatrics 2002;110(3):517-22.
26. Fucile S, Gisel E, Lau C. Effect of an oral stimulation program on sucking skill maturation of preterm infants. Dev Med Child Neurol 2005;47:158-62.
27. Balla G, Szabó M. Chronic morbidities of premature newborns. Orvosi Hetilap 2013;154:1498-510.