Francesco Mangani1 Erika Cavazzana2 Carlo Bonfanti3 Giorgia Mabellini2
Antonio Cerutti2
Increase of bacterial adhesion, related to polishing technique, on the surface of different indirect restorative materials
I compositi sono i materiali resinosi più usati nella comune pratica clinica, ma sono ormai disponibili anche altri materiali sintetici con proprietà differenti, tra cui i policarbonati. Nel seguente lavoro sono stati messi a confronto la variazione dell’adesività di superficie che si può riscontrare su differenti materiali da restauro indiretto, in seguito alla fase di rifinitura clinica.
Riassunto
I restauri indiretti che provengono dai laboratori odontotecnici risultano perfettamente rifiniti e lucidati; spesso, però, è necessario ricorrere a ritocchi diretti, all’interno del cavo orale, coi quali si altera la struttura superficiale, modificando così non solo la lucidità del restauro, ma anche l’adesività batterica in corrispondenza dello stesso. In questo studio microbiologico si è voluto studiare, in vitro, il comportamento di alcuni batteri (parodontopatogeni e non), valutando la loro capacità di adesione (legata a caratteri fenotipici propri dei ceppi in esame) in corrispondenza di restauri realizzati con tre materiali differenti (porcellana, composito e policarbonato), lucidati con dieci sistemi di rifinitura diversi. I risultati ottenuti hanno rivelato che non esiste sistema di lucidatura migliore di quella ottenuta in laboratorio, per tutti i materiali. La porcellana rimane ancora il gold standard nonostante il composito sia un’ottima alternativa con ampi margini di miglioramento chimico-strutturale.
Summary
Indirect restorations that come from dental laboratories are perfectly finished and polished; often, however, it is necessary to perform direct retouches, within the oral cavity, with which alters the surface structure, thus modifying not only the lucidity of the restoration, but also bacterial adhesiveness in correspondence of it. In this study we wanted to study, in vitro, the behavior of some bacteria (periodontopathic and not), assessing their capacity of adhesion (linked to their phenotypic traits) to restorations made with three different materials (porcelain, composite and polycarbonate), polished with ten different finishing systems. The obtained results have revealed that there is no polishing system better than that obtained in laboratory, for all materials. Porcelain is still the gold standard despite composite is an excellent alternative with much room for chemical and structural improvement.
Il progresso tecnologico ci mette a disposizione continuamente nuovi materiali, che garantiscono un elevato outcome estetico e funzionale, tuttavia l’operatore clinico deve conoscere le caratteristiche peculiari di ogni prodotto al fine di ottenere l’invisibilità del restauro e garantire l’omeostasi dell’apparato stomatognatico.
Oltre ai tradizionali compositi resinosi, largamente utilizzati per l’esecuzione di restauri diretti e indiretti, sono ormai disponibili anche altri materiali sintetici con proprietà differenti, tra cui i policarbonati, le ceramiche ecc.
Le ceramiche offrono una indiscutibile resa estetica, pur presentando alcuni difetti, tra cui l’eccessiva durezza e fragilità. Ognuno di questi materiali necessita di un particolare processo di finitura, al fine di riprodurre una superficie liscia e omogenea, priva di nicchie ritentive per la flora batterica orale. Numerosi studi hanno evidenziato come la ruvidità e il valore di energia libera di superficie, che caratterizzano i diversi materiali, siano le variabili più importanti per l’adesività batterica di superficie dei restauri1-5.
Già nel 1979, Blank et al hanno affermato che i restauri in composito ben rifiniti e lucidati non alterano lo stato di salute dei tessuti marginali6; mentre la presenza di restauri incongrui, mal rifiniti e sovracontornati, porta inevitabilmente allo sviluppo di processi cariosi secondari e parodontopatia7.
La proliferazione batterica viene, però, favorita in modo diverso anche da altri fattori. Infatti la capacità dei batteri colonizzatori del cavo orale di aderire alle strutture biologiche che rappresentano il loro ecosistema è, con tutta probabilità, il risultato di una selezione naturale di ceppi dotati di caratteri fenotipici vitali per la sopravvivenza: la selezione naturale ha difatti promosso la sopravvivenza di batteri dotati di particolari recettori, denominati adesine, specifici per i residui aminoacidici proiettati nell’ambiente da molecole di origine salivare (biofilm) adsorbite dalle superfici dure. Il microbiota che si viene a formare è il risultato di un complesso insieme di equilibri che vedono la competizione tra i batteri da un lato e i sistemi di difesa dell’organismo dall’altro8-9.
All’unanimità, tutti gli studi concordano nell’asserire che il grado di levigatezza superficiale è inversamente proporzionale all’adesione batterica10; questa tendenza è ulteriormente accresciuta quando la superficie ritentiva si trova in zone protette dall’autodetersione11.
La ruvidità di superficie del restauro, appena completato, dipende principalmente dal processo di finitura a cui viene sottoposto, prima del completamento e in questo senso le opinioni, se non discordi, possono essere definite perlomeno eterogenee12-14. Molti sono i sistemi messi a punto per eseguire la lucidatura del restauro; in quanto attualmente la finitura superficiale viene considerato il mezzo più efficace per eseguire un restauro pienamente funzionale ancor prima che estetico15.
Lo scopo di questo lavoro è stato quello di mettere a confronto la variazione di adesività batterica sulla superficie di alcuni materiali utilizzati in odontoiatria restaurativa, simulando, in vitro, le manovre di rifinitura che vengono effettuate, sugli stessi, nella fase clinica per avere l’integrazione ottimale nel cavo orale.
Materiali e metodi
Per la realizzazione dei campioni, utilizzati nello studio, sono stati selezionati tre differenti materiali: composito resinoso, policarbonato e ceramica.
È stato stabilito, per ogni materiale, un protocollo di finitura e sono stati selezionati batteri che la letteratura suggerisce come probabili responsabili di malattia parodontale e patologia cariosa. I campioni in resina sono stati preparati mediante una dima in acciaio di 2 mm di spessore in cui sono stati creati dei fori di 7 mm di diametro (superficie 0.4 mm2), a cui è stata accoppiata una seconda piastra mediante morsetti rimovibili; nei pozzetti così creati sono stati stratificati i materiali resinosi introdotti poi nel relativo forno da polimerizzazione UV LC6 a lampade fluorescenti (6 x 9W).
La produzione dei campioni in composito (Enamel plus® Micerium colore: UD6/GE2) è stata effettuata mediante stratificazione in tre tappe, di cui le prime due di dentina e una di smalto, ciascuna seguita dalla fase di polimerizzazione per una durata di 3 minuti, nel forno da polimerizzazione, e da una quarta fase di post-polimerizzazione mediante una lampada alogena da banco (Translux® Kulzer) per 1 minuto, ricoprendo il campione con uno strato di glicerina per eliminare lo strato di inibizione da ossigeno. Per la compattazione sono stati utilizzati strumenti da modellazione da laboratorio (Pentron Laboratory Technologies) unitamente a spatole da modellazione in metallo, mentre l’estrazione del campione dalla dima è stata eseguita mediante un punzone a testa piatta. In questo modo sono stati preparati 6 kit di campioni, comprendenti 40 elementi ciascuno, 10 per ogni metodica di finitura (E, F, G, H), che rappresentano i campioni utilizzati per la sperimentazione.
I campioni in policarbonato (Sculpture®, Pentron Laboratory Technologies colore: C4/19) hanno seguito una procedura analoga. Al termine di ogni stratificazione è seguita la fase di polimerizzazione mediante la Sculpture plus® Curing Light. I primi due strati sono stati polimerizzati con il ciclo Build-up, che prevede 5 minuti di pressione seguiti da 3 minuti di pressione-polimerizzazione, mentre l’ultimo strato ha seguito il ciclo Final, che ripercorre gli stessi tempi del precedente, dopo aver estratto l’ossigeno, sostituito con azoto, dalla camera di polimerizzazione. Sono stati allestiti 6 kit di elementi, ciascuno comprendente 30 campioni equamente divisi nelle tre finiture, condivise anche dai campioni in composito (E-F-H) a eccezione della finitura G, che viene esclusivamente applicata al composito. La dima utilizzata per la produzione dei campioni in porcellana ha necessariamente seguito una diversa geometria costruttiva: è stato realizzato un campionatore in resina dotato di uno stantuffo calibrato di 9 mm di diametro. Dopo la compattazione della porcellana (Noritake Super Porcelaine® EX3) nello stantuffo e la successiva asciugatura, il campione veniva estratto premendo lo stantuffo come in una siringa e adagiato sul piano refrattario per poi essere messo in forno. Il forno da ceramica (Pentron Laboratory Technologies, Autopress plus®) è stato avviato per la cottura dei campioni secondo le indicazioni del produttore del materiale e del forno stesso seguendo il programma suggerito dalla casa:
- asciugatura per 5 minuti per eliminare l’acqua di impasto;
- ingresso in ciclo di cottura a 650 °C per eliminare l’acqua di costituzione;
- pressurizzazione della camera (720 mm Hg) e formazione del vuoto
- a cui seguono l’innalzamento graduale della
- temperatura da 650 °C con passi di 55°C/min fino alla temperatura di lavoro;
- ingresso di aria nella camera una volta raggiunti i 910 °C;
- raggiungimento della temperatura finale a 930 °C in atmosfera.
La durata del ciclo completo è di 12 minuti, a cui va aggiunto il tempo necessario alla cottura della glasure. Anche in questo caso sono stati approntati 6 kit, ognuno dei quali contenente 10 elementi per ciascuna finitura (A, B, C, D), per un totale di 40 elementi.
Metodi di finitura
Tutti i passaggi di ogni sequenza hanno avuto una durata di 20 secondi, tutte le procedure, realizzate mediante micromotore da laboratorio da un unico operatore, sono state eseguite sui campioni mantenendoli nella dima utilizzata per la loro fabbricazione.
Finitura A
1. Fresa 40 µm (Diagen turbo-grinder(DTG).
Questo passaggio è stato considerato esclusivamente per la ceramica.
Finitura B
1. Gommini da lucidatura ceramica (Edenta Cerapol Super 22/3 mm 0321; 17/2 mm 0326; 22/3 mm 0322).
2. Spazzolino in pelo di capra + pasta diamantata da 3 µm (plus Shiny, pasta A Micerium).
3. Spazzolino in pelo di capra + pasta diamantata da 1 µm (plus Shiny, pasta B Micerium).
Finitura C
1. Fresa 40 µm (Diagen turbo-grinder® DTG).
2. Gommini da lucidatura ceramica (Edenta, Cerapol® Super, 22/3 mm 0321; 17/2 mm 0326; 22/3 mm 0322).
Finitura D
1. Glasatura (Noritake stain Glaze®).
2. Feltrino da lucidatura.
Questa procedura deve essere considerata il gold standard.
Finitura E
1. Fresa 40 µm da laboratorio.
2. Gommino abrasivo a bassa velocità (Shofu OneGloss® Midi-point n°060).
Finitura F
1. Gommino abrasivo ad alta velocità (Shofu OneGloss® Midi-point n°060).
2. Gommino abrasivo a bassa velocità (Shofu OneGloss® Midi-point n°060).
3. Spazzolino in pelo di capra + pasta diamantata da 3 µm a secco (Enamel plus Shiny®, pasta A Micerium).
4. Spazzolino in pelo di capra + pasta diamantata da 1 µm a secco (Enamel plus Shiny®, pasta B Micerium).
5. Feltrino con ossido di alluminio a secco (Enamel plus Shiny®, pasta C Micerium).
6. Feltrino con ossido di alluminio e acqua (Enamel plus Shiny®, pasta C Micerium).
Finitura G
1. Gommino abrasivo ad alta velocità (Shofu OneGloss®, Midi-point n°060).
2. Gommino abrasivo a bassa velocità (Shofu OneGloss®, Midi-point n°060).
3. Laccatura (Biscover®, Bisco) secondo le indicazioni del produttore.
4. Polimerizzazione con programma incrementale per 60 secondi (Elipar® Trilight, Espe).
Finitura H
1. Fresa multilama 40µm da laboratorio.
2. Spazzolino in silicone + pasta diamantata 3 µm a secco (Enamel plus Shiny®, pasta A Micerium)
3. Spazzolino in pelo di capra + pasta diamantata 3 µm a secco (Enamel plus Shiny®, pasta A Micerium).
4. Spazzolino in pelo di capra + pasta diamantata 1 µm a secco (Enamel plus Shiny®, pasta B Micerium).
5. Detersione con vaporizzazione per 5 secondi (Tissy, Ceramo steam jet®, 7 atm).
6. Feltrino in cotone da lucidatura.
La finitura H rappresenta il protocollo di lucidatura da laboratorio.
Procedure di prelievo microbiologico
Per l’analisi microbiologica dell’adesività dei materiali è stato selezionato un pool batterico rappresentativo con le specie più citate dalla letteratura:
- Actinobacillus actinomycetemcomitans;
- Porphyromonas gingivalis;
- Prevotella intermedia;
- Bacteroides forsythus;
- Treponema denticola;
- Streptococcus mutans.
I tre soggetti, affetti rispettivamente da una forma di parodontite cronica dell’adulto, da una forma aggressiva localizzata e da una forma aggressiva generalizzata, sono stati selezionati da un pool di possibili candidati tra i pazienti seguiti presso la clinica odontoiatrica dell’Università degli Studi di Brescia. Ogni paziente ha firmato un consenso informato per la realizzazione del prelievo microbiologico.
L’operatore, in campo pulito e con guanti sterili, ha effettuato i prelievi mediante coni di carta sterili (Inline®paperponits, fine, 28 mm), inseriti in tasche parodontali profonde, che con maggiore probabilità garantivano il reperimento dei patogeni. Una volta inseriti delicatamente nelle tasche, i coni di carta sono stati estratti e immediatamente immersi in una provetta contenente brodo di coltura a base di cuore e cervello (in vitro diagnostic n°42 081, bioMerieux sa); la provetta è stata poi inserita, insieme a una busta per anaerobiosi opportunamente attivata (AnaeroGen® an0025a, Oxoid), in una giara, che è stata immediatamente sigillata, per poi essere inviata al reparto di microbiologia per l’identificazione e l’amplificazione dei ceppi.
Le giare con i prelievi sono state deposte in incubatore per anaerobi a 37°C, per poi essere seminati su terreno di coltura selettivo SSC. Gli isolati sono stati poi sottoposti a una procedura di identificazione con sistema Rapid ID 32 A (Rapid ID 32° ref 32 300; bioMerieux sa). La galleria Rapid ID 32 A è costituita da 32 cupole, di cui 29 utilizzate per i test, contenenti un mezzo di reazione disidratato. La lettura delle reazioni si effettua dopo 4 ore di incubazione in anaerobiosi e con metodica manuale.
Si esegue, partendo da una colonia ben isolata, una sub-coltura su una piastra di agar-sangue (agar base Columbia), per poi incubare la piastra per 24 ore a 36°C in condizioni di anaerobiosi.
Una volta terminato il periodo di incubazione è stata preparata una sospensione (API® Suspension Medium da 2 ml) con una opacità pari al punto 4 di McFarland. La sospensione è stata prelevata con una pipetta depositando 55 µl su ogni cupola; dopo la coltura delle cupole sono state rivelate le reazioni con i reattivi di controllo (Test NIT; Test IND e Test da PAL a SerA) e si è proceduto alla lettura manuale. I ceppi, così isolati, sono stati inseriti in un ciclo di replicazione su piastre di coltura in cappa anaerobia, così da poter disporre di colture sufficienti all’esecuzione dell’esperimento. Lo Streptococcus mutans è stato prelevato e isolato con la galleria di identificazione specifica ID 32 strep.
Risultati
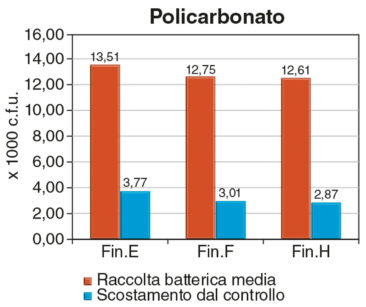
È stata effettuata l’analisi della varianza (ANOVA), con un intervallo di confidenza del 95%; l’analisi è stata condotta con il test di Duncan (P<0,05). Nella figura 1 osserviamo la rappresentazione grafica dei valori di raccolta batterica per tutte le metodiche di rifinitura analizzate. La rifinitura che ha ottenuto i risultati minori in termini di carica batterica adesa è la glasatura su ceramica (Fin. D); questa viene quindi presa come riferimento per tutte le altre. Nello stesso grafico viene messa in evidenza anche la discordanza percentuale di ciascuna finitura, in relazione alla glasatura su ceramica. Le finiture E, F e H risultano essere quelle che favoriscono una maggiore adesione batterica alle superfici trattate (in questo caso si tratta di composito e policarbonato).
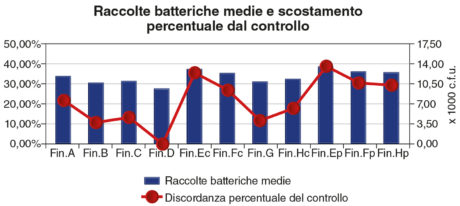
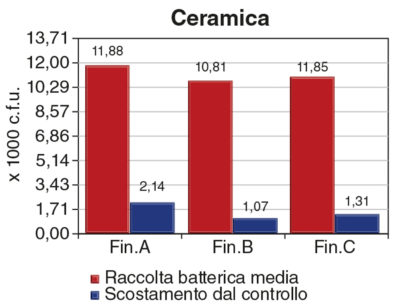
Per quanto riguarda le finiture eseguite su ceramica (A, B, C e D), sicuramente la glasatura, essendo stata presa anche come riferimento, risulta essere la più soddisfacente; le finiture A e B danno risultati simili, mentre la C si colloca in posizione intermedia tra le prime due e la finitura D (Figura 2).
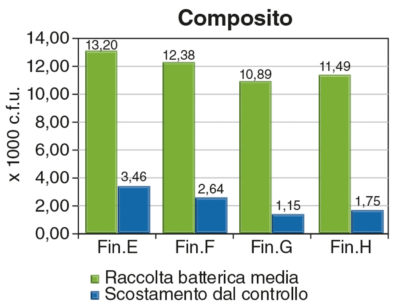
Riguardo a composito e policarbonato, la rifinitura presa come riferimento è la H, ossia la finitura eseguita in laboratorio. Per entrambi i materiali sono state prese in esame le finiture E, F e H, mentre la finitura G è stata effettuata solamente sui campioni in composito.
In figura 3 osserviamo come, per quanto riguarda la resina composita, la finitura G (laccatura) dimostra di favorire il minor accumulo di placca con valori statisticamente rilevanti, ma solo in relazione alle finiture E e F, simili tra loro. La finitura H si colloca in posizione intermedia tra le prime due e la laccatura.
Nello stesso grafico è rappresentata la discordanza dal valore di riferimento (Fin. H).
Il comportamento del policarbonato, per le tre finiture adottate è risultato peculiare (Figura 4): nessuna finitura ha prodotto valori di raccolta significativamente difformi tra loro, come è evidente dalle medie espresse nello schema. I valori ottenuti sono peraltro costantemente maggiori, sia delle medie della ceramica, sia dei corrispondenti campioni in composito, che hanno subìto il medesimo trattamento.
Nello stesso grafico è rappresentata la discordanza dal valore di riferimento (Fin. H).
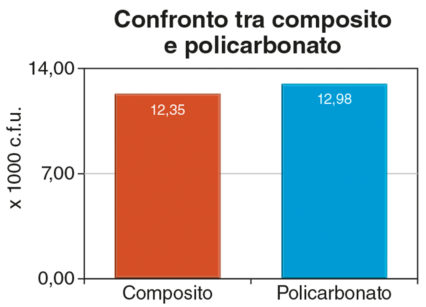
Calcoliamo la discordanza tra i valori di raccolta media relativi alle finiture E, F e H e i risultati relativi alla laccatura, sia per i campioni in composito, che per quelli in policarbonato; confrontiamo poi le discordanze medie per i due materiali e osserviamo come (Figura 5) il policarbonato sia il materiale che favorisce un valore maggiore di adesione batterica.
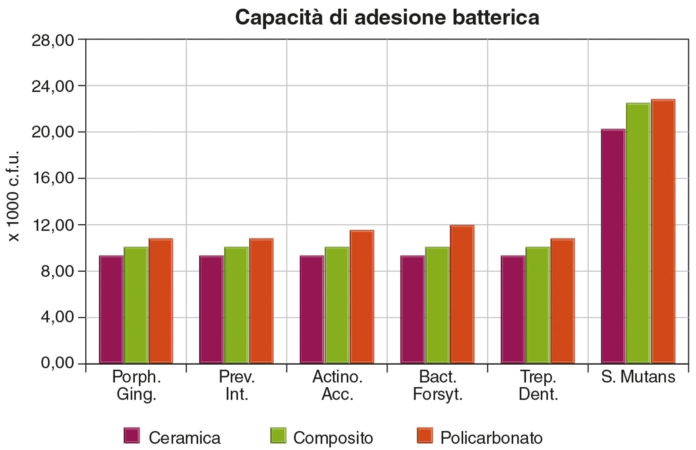
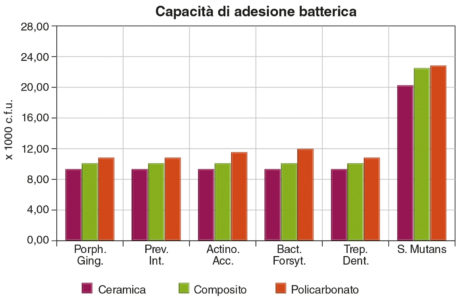
Per quanto riguarda la capacità adesiva dei diversi ceppi batterici ai tre materiali in esame, possiamo dire che la ceramica favorisce l’adesione batterica meno di composito e policarbonato (Figura 6); in particolare Porphyromonas gingivalis, Prevotella intermedia, Actinobacillus actinomycetemcomitans, Treponema denticola e Bacteroides forsythus hanno valori di adesione superficiale paragonabili tra loro e simili al pool utilizzato come riferimento. Molto superiori sono i valori di adesione dello Streptococcus mutans.
Sui campioni in composito, i valori di adesione batterica sono generalmente più bassi che sul policarbonato, per tutti i ceppi batterici considerati.
Il policarbonato dà valori maggiori a quelli del composito, a eccezione del risultato relativo allo S. mutans, che sono sovrapponibili.
Discussione
In linea generale la crescita dei batteri anaerobi e quindi anche quella del pool da essi costituito, ha seguito, dal momento dell’inoculo, un progressivo incremento che al momento della raccolta si andava arrestando; prove di coltura oltre il tempo stabilito (dati non riportati), hanno permesso di verificare che il prolungamento del tempo di coltura non avrebbe offerto ulteriori informazioni circa la crescita batterica. La prova sulla porcellana può essere considerata lo studio pilota di tutta la sperimentazione, questo perché la ceramica è un materiale dotato di una struttura omogenea, sul quale le procedure di finitura possono esercitare le proprietà leviganti senza interferenze da parte dell’interfaccia di eventuali riempitivi16.
In quest’ottica devono essere interpretati i risultati dell’adesione, per ciò che riguarda le medie batteriche, ovvero per l’analisi del comportamento batterico che prescinde dal tipo di finitura. Gli schemi riportati nei risultati mostrano che le differenze tra le medie dei ceppi batterici non sono significativamente difformi tra loro (Figura 6) e che, quindi, tutti i batteri hanno manifestato la medesima capacità di raggiungere una quota di carica aderente, prescindendo dalla diversa forma. Da ciò si può affermare che tutti i batteri risultano egualmente capaci di innescare il processo di adesione; questo risultato ha compreso il pool, che ha prodotto un quantitativo di colonie batteriche adese, nel complesso, simile a quello di tutti i ceppi piastrati singolarmente.
In generale la finitura A, come ci si poteva aspettare, ha promosso i più alti livelli di adesione ai campioni, con un quantitativo che, tuttavia, non è risultato significativamente maggiore di quello della finitura C. La finitura B ha indotto un quantitativo di carica inferiore alle due precedentemente citate, risultando significativamente inferiore a quello della lavorazione con la sola fresa. La glasatura, che come noto rappresenta il gold standard in termini estetici poiché garantisce una superficie uniformemente lucida e liscia, ha consentito di ridurre sensibilmente il numero di colonie raccolte. Le procedure che più spesso vengono applicate, dopo aver ritoccato un manufatto protesico, sono in larga maggioranza costituite dai gommini da lucidatura (finitura B) e dall’applicazione, in seguito, di una serie di paste abrasive (finitura C); in entrambi i casi, la tendenza a creare della nicchie protette per i batteri che raggiungono queste zone induce un aumento della carica aderente tra il 10% e il 13%.
Discorso a parte merita lo S. mutans; considerando le modalità di crescita di questo batterio cariogeno, occorre garantire superfici in grado di limitare il più possibile l’accumulo di colonie su di esse visti i ridotti tempi di aggregazione e stabilizzazione di cui questo ceppo necessita17.
Tra i batteri singoli il P. gingivalis ha dimostrato capacità superiori, rispetto agli altri ceppi parodontali, di attecchire alle superfici trattate, in quantità analoga a quelli della P. intermedia. Questi due batteri, che sono considerati strettamente correlati alla progressione della malattia parodontale, come noto, sono provvisti di fimbrie; questo carattere fenotipico potrebbe aver facilitato l’aggregazione iniziale, determinando così una più efficace strutturazione della colonia. Il composito sembra rappresentare il materiale che si pone come migliore rapporto lucidabilità-resa estetica, stando ai risultati ottenuti. Il valore che si è distinto è stato quello delle colture sui campioni laccati (finitura G), che non solo ha prodotto una carica significativamente diversa da quella delle prime due finiture, ma il cui valore assoluto, anche se non statisticamente significativo, è risultato inferiore al valore di riferimento (finitura H) del 5% circa18-20. La laccatura garantisce, in effetti, la creazione di una condizione superficiale ottimale, ma è naturale aspettarsi un’esfoliazione della lacca stessa in seguito a un certo numero di cicli masticatori; inoltre, l’abrasione, a cui sono soggette tutte le superfici trituranti nel cavo orale, porterebbe a una superficie molto più irregolare di quelle create mediante i sistemi adottati nelle altre lavorazioni.
Un paragone diretto tra porcellana e composito è realizzabile solo riguardo ai valori assoluti di raccolta batterica. Da ciò risulta evidente che le finiture della porcellana hanno indotto un accumulo di placca costantemente inferiore a quello delle finiture del composito, confermando le premesse fatte in precedenza.
Lo S. mutans e il pool batterico hanno fornito risultati in controtendenza e in particolare per quest’ultimo possiamo ragionevolmente ipotizzare che l’antagonismo, che ha condizionato la crescita delle colonie, abbia potuto avere, come fattore d’interferenza, proprio il condizionamento dei potenziali di adesione, aumentando la sensibilità dei componenti del pool ai valori di levigatezza incontrati.
Il terzo materiale in esame, il policarbonato, è quello che ha fornito i risultati più significativi sotto il profilo dell’adesione batterica: il B. forsythus ha manifestato la più alta tendenza all’aggregazione, rispetto agli altri ceppi, in tutte le lavorazioni, con risultati parzialmente sovrapponibili all’A. actinomycetemcomitans e al pool batterico. Sembra più realistico ritenere la superficie in senso morfologico, il fattore selettivo più importante per spiegare le tendenze registrate. Il policarbonato è un materiale composito, il cui riempitivo è dimensionalmente simile a quello del composito nanoibrido; si sospetta, quindi, che le particelle inserite nella massa di uno, si comportino in modo differente piuttosto che nella resina dell’altro, oppure che è la resina stessa a provocare questa difformità di superficie. Dallo studio delle caratteristiche chimico-fisiche dei materiali è emerso che il sistema di polimerizzazione del policarbonato, definito reticolazione, permette un incremento delle proprietà meccaniche del manufatto. Questo sistema comporta, purtroppo, anche la tendenza a formare, durante il processo, grani di accrescimento che inducono un fenomeno conosciuto come delaminazione del policarbonato, spiegazione plausibile del fenomeno osservato; per di più, è legittimo ritenere che tale effetto di delaminazione possa essere innescato in seguito a procedure di finitura.
Conclusioni
Lo studio si è rivelato utile alla comprensione degli effetti che le finiture dei materiali inducono sul comportamento dei batteri analizzati e dell’importanza che la fase di finitura riveste nel processo restaurativo di un elemento dentale; i risultati dello studio hanno messo in luce, inoltre, l’influenza che il materiale può potenzialmente esprimere sulla stabilizzazione di una flora batterica dalle caratteristiche di patogenicità, quando questo ne faciliti l’organizzazione in un microambiente protetto.
Per ciò che riguarda la porcellana, si può confermare che questo materiale, una volta glasato, continua a rappresentare la migliore scelta terapeutica per ciò che riguarda la biocompatibilità, garantendo superfici levigate che limitano l’adesione batterica e favoriscono la detersione delle stesse. Le proprietà tanto apprezzate di una superficie glasata vengono però meno, riducendosi significativamente, quando vengono ritoccati i margini di un manufatto. I migliori sistemi di lucidatura sono quelli costituiti da un numero maggiore di passaggi mediante gommini e paste diamantate.
Il composito ha rappresentato un compromesso tra i due materiali alternativi dello studio, avendo dato prova di notevole variabilità della superficie e consentendo l’ottenimento di superfici lucidate, con valori di carica batterica superiori alla ceramica e inferiori al policarbonato.
La laccatura ha consentito di ridurre la placca aderente del 5% rispetto ai campioni finiti in laboratorio, si ricorda però che la lacca, applicata a una superficie di carico, è soggetta a microfratture ed esfoliazione, lasciando verosimilmente una superficie più eterogenea di quella prodotta dalla sola fresa. L’uso dei gommini, pur migliorando sensibilmente l’aspetto della superficie lavorata, non ha prodotto una riduzione di carica significativamente rilevante.
Il policarbonato è il materiale che in assoluto ha dimostrato di esercitare un’azione favorente l’accumulo di placca a causa probabilmente delle sue caratteristiche morfo-strutturali: la struttura del materiale non consente di ottenere una superficie levigata. Ciò è probabilmente riconducibile alla presenza dell’effetto di delaminazione a cui sono soggetti i policarbonati. Occorre segnalare il fatto che, seppur in gradi diversi, tutte le finiture hanno prodotto un miglioramento dal punto di vista estetico, anche quando l’effettivo miglioramento delle caratteristiche di superficie non ha subìto cambiamenti altrettanto rilevanti, come dimostrato dalle colture batteriche.
1Università degli studi di Roma
«Tor Vergata», Facoltà di Odontoiatria e Protesi dentaria
2Università degli studi di Brescia, Facoltà di Odontoiatria e Protesi dentaria
3Università degli studi di Brescia, Facoltà di Medicina, Reparto di Microbiologia (Spedali Civili di Brescia)
2. Gibbons RJ, Hay DI, Childs WC 3rd, Davis G. Role of cryptic receptors (cryptitopes) in bacterial adhesion to oral surfaces. Arch Oral Biol 1990; 35 Suppl: 107S-114S.
3. Siegrist BE, Brecx MC, Gusberti FA, Joss A, Lang NP. In vivo early human dental plaque formation on different supporting substances. A scanning electron microscopic and bacteriological study. Clin Oral Implants Res 1991 Jan-Mar; 2(1):38-46.
4. Olsson J, van der Heijde Y, Holmberg K. Plaque formation in vivo and bacterial attachment in vitro on permanently hydrophobic and hydrophilic surfaces. Caries Res 1992; 26(6):428-33.
5. Quirynen M, Bollen CM. The influence of surface roughness and surface-free energy on supra- and subgingival plaque formation in man. A review of the literature. J Clin Periodontol 1995 Jan; 22(1):1-14. Review.
6. Blank LW, Caffesse RG, Charbeneau GT. The gingival response to well-finished composite resin restorations. J Prosthet Dent 1979 Dec;42(6):626-32.
7. Lang NP, Kiel RA, Anderhalden K. Clinical and microbiological effects of subgingival restorations with overhanging or clinically perfect margins. J Clin Periodontol. 1983 Nov; 10(6):563-78.
8. Al-Hashimi I, Levine MJ. Characterization of in vivo salivary-derived enamel pellicle. Arch Oral Biol1989;34(4):289-95.
9. Steinberg D, Mor C, Dogan H, Zacks B, Rotstein I. Effect of salivary biofilm on the adherence of oral bacteria to bleachedand non-bleached restorative material. Dent Mater 1999 Jan; 15(1):14-20.
10. Jendresen MD. Clinical behavior of 21st-century adhesives and composites. Quintessence Int 1993 Sep;24(9):659-62.
11. Bollen CM, Lambrechts P, Quirynen M. Comparison of surface roughness of oral hard materials to the threshold surface roughness for bacterial plaque retention: a review of the literature. Dent Mater 1997 Jul; 13(4):258-69. Review.
12. Gurgan S, Bolay S, Alacam R. In vitro adherence of bacteria to bleached or unbleached enamel surfaces.J Oral Rehabil 1997 Aug; 24(8):624-7.
13. Carlen A, Nikdel K, Wennerberg A, Holmberg K, Olsson J. Surface characteristics and in vitro biofilm formation on glass ionomerand composite resin. Biomaterials 2001 Mar; 22(5):481-7.
14. Kawai K, Urano M. Adherence of plaque components to different restorative materials. Oper Dent 2001 Jul-Aug; 26(4):396-400.
15. Mor C, Steinberg D, Dogan H, Rotstein I. Bacterial adherence to bleached surfaces of composite resin in vitro. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1998 Nov; 86(5):582-6.
16. Kawai K, Urano M, Ebisu S. Effect of surface roughness of porcelain on adhesion of bacteria and their synthesizing glucans. J Prosthet Dent 2000 Jun; 83(6):664-7.
17. Saeki Y, Kato T, Naito Y, Takazoe I, Okuda K. Inhibitory effects of funoran on the adherence and colonization of mutans streptococci. Caries Res 1996; 30(2):119-25.
18. Willershausen B, Callaway A, Ernst CP, Stender E. Related Articles, Links The influence of oral bacteria on the surfaces of resin-based dental restorative materials–an in vitro study. Int Dent J 1999 Aug; 49(4):231-9.
19. Roeder LB, Tate WH, Powers JM. Effect of finishing and polishing procedures on the surface roughness of packable composites. Oper Dent 2000 Nov-Dec; 25(6):534-43.
20. Gohring TN, Besek MJ, Schmidlin PR. Related Articles, Links Attritional wear and abrasive surface alterations of composite resin materials in vitro. J Dent 2002 Feb-Mar;30(2-3):119-27.