Studio clinico controllato
Antimicrobial photodynamic therapy in the treatment of perimplantitis. Controlled clinical study trial
La terapia della perimplantite è rivolta al controllo dell’infezione, alla decontaminazione della superficie implantare e al ripristino della condizione di salute.
La decontaminazione delle superfici implantari tuttavia risulta complicata. Obiettivo di questo studio è quello di valutare se la terapia fotodinamica antimicrobica possa rappresentare un supporto efficace ai metodi convenzionali nel trattamento di questa condizione patologica infiammatoria.
Silvia Sabatini1
Roberto Apponi2,
Roberta Grassi3
Gianna Maria Nardi4
1Igienista dentale, Sapienza Università di Roma
2Odontoiatra, Università degli Studi di Modena e Reggio Emilia
3Odontoiatra, Bari
4Ricercatore universitario confermato, Sapienza Università di Roma, Dipartimento di Scienze Odontostomatologiche e Maxillo-facciali
Riassunto
Lo scopo di questo studio è quello di mostrare l’efficacia della combinazione fra la terapia fotodinamica antimicrobica e i metodi convenzionali nel trattamento della perimplantite.
Materiali e metodi. 30 soggetti sono stati coinvolti nello studio, 12 donne e 18 uomini, con età compresa tra i 36 e i 61 anni (± 5) e divisi in modo casuale in due gruppi. All’inizio dello studio, dopo 30 giorni e dopo 90 giorni sono stati rilevati indice di placca (FMPS), indice di sanguinamento (FMBS) con o senza suppurazione, e profondità di sondaggio (PD). Il gruppo di controllo ha ricevuto una terapia parodontale convenzionale, mentre il gruppo sperimentale ha ricevuto, oltra a questa, la terapia fotodinamica.
Risultati. Il PD è migliorato in entrambi i gruppi, maggiormente nel gruppo test ma senza miglioramenti statisticamente significativi tra i due gruppi. Il FMBS nel gruppo test è migliorato, arrivando a un valore del 16%, mentre nel gruppo di controllo ha raggiunto un valore del 22%; la differenza tra i due gruppi era statisticamente significativa.
Discussione. La terapia fotodinamica ha alcuni vantaggi rispetto a quella tradizionale, poiché le tasche hanno presentato una guarigione più efficace e più rapida.
Conclusione. I risultati ci indicano come la terapia fotodinamica antimicrobica con laser a diodi e cloruro di fenotiazina rappresenti un supporto efficace alla terapia convenzionale. La terapia fotodinamica deve essere considerata una strategia aggiuntiva, nel trattamento della perimplantite, ai trattamenti meccanici (scaling) e chirurgici (gli innesti).
Summary
The purpose of this study is to demonstrate the effectiveness of the antimicrobial photodynamic therapy in combination with conventional methods in the treatment of perimplantitis.
Materials and methods. 30 subjects were involved in the study, 12 women and 18 men, aged between 36 and 61 (± 5), casually divided into two groups. Full mouth plaque score (FMPS), full mouth bleeding score (FMBS) with or without suppuration, and probing depth (PD) were detected at the beginning of the study, after 30 days and after 90 days. The control group received conventional periodontal therapy, while the experimental group received also photodynamic therapy.
Results. PD improved in both groups, most in the test group but with no statistically significant improvements between the two groups. FMBS in the test group improved, reaching a value of 16%, while in the control group it reached a value of 22%; the difference between the two groups was statistically significant.
Discussion. Photodynamic therapy has some advantages compared to the traditional treatment, because the pockets presented a more effective and quicker healing.
Conclusion. The results indicate that photodynamic antimicrobial therapy with diode laser and phenothiazine chloride represents an effective support for conventional therapy. Photodynamic therapy should be considered as an additional strategy, in the treatment of perimplantitis, to mechanical scaling and surgical treatments (grafts).
La perimplantite è una condizione patologica infiammatoria che causa la perdita dell’osso perimplantare, l’aumento della profondità di sondaggio (PPD) ad almeno 4 mm, il sanguinamento (BOP) e la fuoriuscita di essudato purulento al sondaggio1,3. È caratterizzata da un grave processo infiammatorio che coinvolge sia la mucosa sia il tessuto osseo attorno all’impianto2 e rappresenta il caso più comune di fallimento implantare a lungo termine.
Questa patologia si verifica nel 10% degli impianti e nel 20% dei pazienti sottoposti a terapia implantare dopo 5-10 anni4. I fattori di rischio associati a questa situazione patologica sono riconducibili a una scarsa igiene domiciliare, a un controllo della placca batterica inadeguato5, a una storia pregressa di malattia parodontale5, ai residui di cemento perimplantare nel caso di protesi cementate6, al sovraccarico occlusale7,8, al fumo9 e a patologie sistemiche quali diabete non controllato5, osteoporosi10 e infezioni da HIV11.
Il biofilm batterico che si forma sulla superficie implantare è simile a quello presente nei pazienti affetti da parodontite. La microflora include microrganismi come Aggregatibacter actinomycetemcomitans, Peptostreptococcus micros, Campylobacter rectus, Capnocytophaga spp., Porphyromonas gingivalis, e Tannerella forsythia. Occorre sottolineare che i denti residui possono influenzare la composizione della microflora. Le specie batteriche osservate nei pazienti edentuli sono diverse da quelle presenti nei soggetti parzialmente edentuli. Sulla base di ciò, risulta plausibile l’idea che la presenza dei batteri coinvolti nella malattia parodontale possa contribuire allo sviluppo della perimplantite12.
Il trattamento è rivolto al controllo dell’infezione, alla decontaminazione della superficie implantare e al mantenimento delle condizione di salute13. La decontaminazione delle superfici implantari, tuttavia, risulta complicata. In letteratura sono stati proposti molti approcci differenti14,15. Le superfici possono essere pulite tramite procedure meccaniche (curette parodontali, ablatori a ultrasuoni e airpolishing) e chimiche (acido citrico, H2O2, clorexidina digluconato, EDTA), insieme all’utilizzo di antibiotici locali o sistemici16,17.
I laser possono essere usati per la decontaminazione delle superfici implantari. I laser a diodi, i laser ad erbio e il CO2 sono fra i più utilizzati, per via delle loro proprietà emostatiche, del loro effetto selettivo sul tartaro, e della loro efficacia battericida18,19.
Un approccio innovativo per ottenere la decontaminazione della superficie implantare consiste nell’esecuzione del trattamento convenzionale abbinato alla terapia fotodinamica (PDT).
La terapia fotodinamica prevede l’utilizzo di un laser a diodi a bassa potenza e di composti fotosensibilizzanti. Il composto fotosensibilizzante si lega alle cellule bersaglio e, quando è irradiato da una luce con una specifica lunghezza d’onda, in presenza dell’ossigeno, subisce una transizione da uno stato fondamentale di bassa energia a uno stato eccitato di singoletto; in questo modo viene rilasciato l’ossigeno singoletto e vengono prodotti altri agenti molto reattivi, che sono tossici per le cellule batteriche bersaglio20, 21.
La terapia fotodinamica (PDT) ha ricevuto, negli ultimi anni, una crescente attenzione in ambito odontoiatrico. È stato dimostrato che l’applicazione di coloranti fotosensibili all’interno delle tasche perimplantari e la loro attivazione con la luce laser è in grado di favorire l’eliminazione dei patogeni parodontali. Gli studi clinici eseguiti su pazienti affetti da parodontite cronica hanno evidenziato benefici della PDT sulla riduzione dell’infiammazione gengivale22. Sono stati eseguiti degli studi sui cani per valutare gli effetti della PDT sul trattamento della perimplantite indotta. I risultati hanno evidenziato una riduzione nella conta batterica di Prevotella intermedia/nigrescens, Fusobacterium spp. e Streptococcus betaemolitico23. Altri studi hanno mostrato come, mediante la PDT, sia possibile raggiungere la distruzione dei batteri senza alcun danno alle superfici di titanio durante il trattamento24-26. Questo studio sperimentale ha l’obiettivo di dimostrare l’efficacia della terapia fotodinamica antimicrobica in combinazione con i metodi tradizionali di scaling e root planing nel trattamento della perimplantite.
2. Materiali e metodi
30 soggetti sono stati coinvolti nello studio, 12 donne e 18 uomini, con età compresa tra i 36 e i 61 anni (± 5).
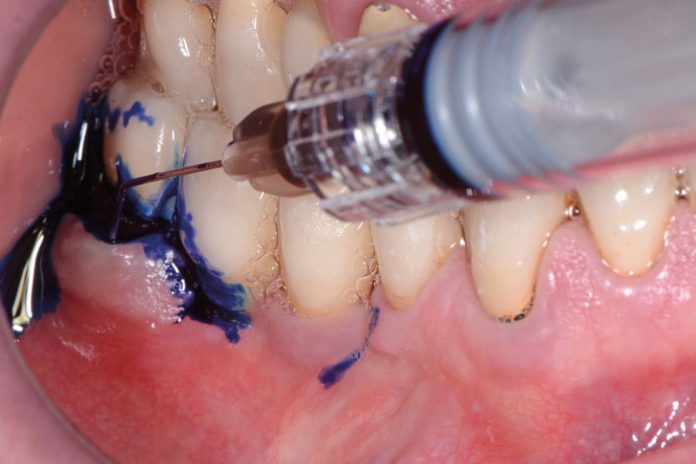
Tutti i soggetti hanno dato il loro consenso al trattamento. Lo studio è stato condotto in rispetto della Dichiarazione di Helsinki. I pazienti sono stati selezionati secondo i seguenti criteri: indice di sanguinamento totale (FMBS) ≥40% e almeno un sito implantare con le seguenti caratteristiche: profondità di sondaggio (PD) ≥4 mm, sanguinamento al sondaggio (BOP), e presenza di suppurazione (Figura 1).
I criteri di esclusione comprendevano: malattie sistemiche non controllate, malattie ossee degenerative, chemioterapia o radioterapia dell’area testa-collo, gravidanza o allattamento, presenza di denti con parodontite adiacenti ai siti affetti da peri-implantite, impianti post-estrattivi, consumo di >10 sigarette al giorno, alcolismo.
L’ipotesi nulla era che non ci fossero differenze statisticamente significative nella rilevazione dei parametri clinici (p. es. PD, FMBS, e FMPS) tra le due modalità di trattamento (gruppo sperimentale con PDT aggiuntiva e gruppo di controllo).
La variabile primaria è stata la riduzione del PD nei siti peri-implantari con profondità del sondaggio ≥4 mm. Le variabili secondarie sono state i cambiamenti nel FMBS e nel FMPS.

Il razionale di questo studio è stato basato sulla capacità della terapia fotodinamica di favorire l’inattivazione dei batteri attraverso la luce anziché attraverso il calore. Questo lo si può ottenere con una potenza di fascio laser pari a 40 milliwatt, senza che sia sviluppata alcuna forma di calore. L’irradiazione a 360° avviene invece grazie a delle sonde particolari che assicurano una perfetta diffusione del fascio di luce.
Sono stati analizzati 69 impianti dentali. I pazienti sono stati assegnati in modo casuale a due gruppi: un gruppo sperimentale (38 impianti) e un gruppo di controllo (31 impianti), assegnando un codice a ogni paziente.
Per entrambi i gruppi di pazienti i seguenti indici sono stati misurati tramite l’utilizzo di una sonda in plastica (T216 Easyview, PDT®): l’indice di placca (FMPS), basato sul Plaque Control Record (PCR)27, sanguinamento al sondaggio (FMBS) con o senza suppurazione, e profondità del sondaggio (PD) (Figura 2).
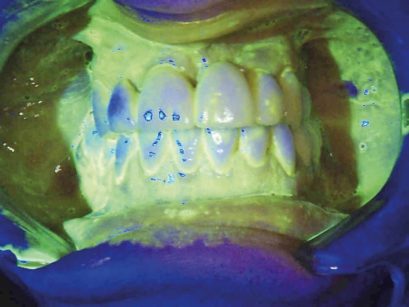
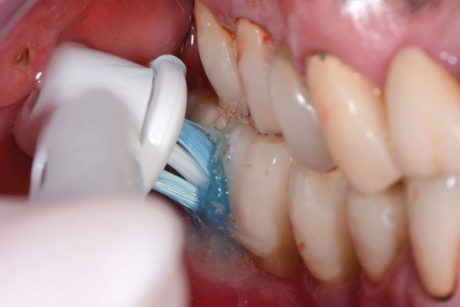
L’igiene orale professionale è stata eseguita con approccio clinico D-BIOTECH (Dental BIOfilm Detection Topographic Tecnique) che permette all’operatore di eseguire un trattamento minimamente invasivo strumentando con polishing selettivo o airpolishing o scaling, osservando la topografia del biofilm batterico evidenziato dal rivelatore di placca alla fluorescina e con airpolishing (Mectron® COMBI Touch) con polvere di glicina circa 25 μm (Mectron® Glycine powder) per rimuovere biofilm batterico e pigmenti ed esporre il tartaro sottostante (Figure 3a, b).
Quest’ultimo è stato rimosso con un ablatore piezoelettrico (Mectron® COMBI Touch), al quale è stato applicato un inserto universale (Mectron® S1) per lo scaling sopragengivale dei denti naturali (Figure 4 a, b). Il debridement radicolare nei siti con PD ≥4 mm è stato effettuato con un inserto ultrasonico parodontale (Mectron® P10). Per la decontaminazione degli impianti sono stati utilizzati strumenti in titanio per evitare di danneggiare l’impianto graffiandone la superficie o lasciando residui di altri materiali (WingroveTM B5-6 Ti R661, WingroveTM L3-4 Ti R680, WingroveTM N128-L5mini Ti R693). Al termine di tale operazione, secondo il codice sulla busta, l’operatore ha considerato nel gruppo sperimentale l’ulteriore utilizzo della terapia fotodinamica antimicrobica assistita con laser, in base al protocollo HELBO, nei siti implantari con PD ≥4 mm.
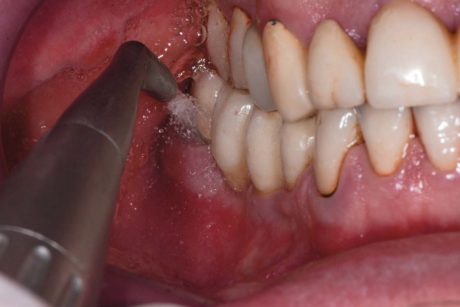
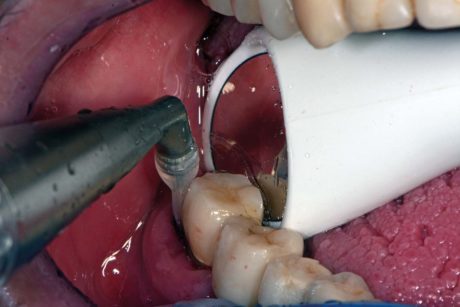
dell’air-polisher sulla superficie dell’impianto e non all’apice della tasca (Mectron® COMBI Touch).
La terapia fotodinamica è stata eseguita utilizzando un laser a diodi a batteria con lunghezza d’onda di 660 nm e potenza di 75mW/cm2 (HELBO® TheraLite, Bredent Medical), con una sonda di diametro di 0,06 cm. È stato utilizzato un fotosensibilizzante liquido, contenente blu di metilene (cloruro di fenotiazina) (HELBO® Blue, Bredent Medical). La concentrazione di fotosensibilizzante era di 10 mg/mL con un picco di assorbimento pari a 670 nm.
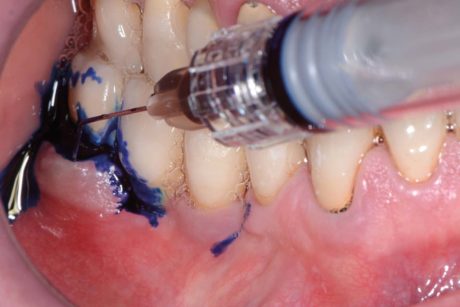
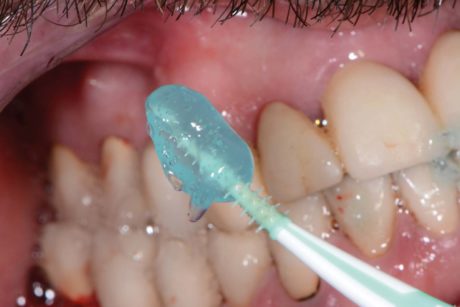
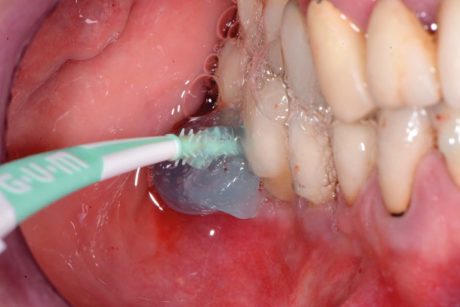
Il suo uso come cromoforo nella terapia fotodinamica è dovuto alla sua relativa stabilità alla luce, che lo rende un importante generatore di ossigeno singoletto (ET = 142,1 kJ/mol con Φ∆= 0,60 in acqua). Il fotosensibilizzante è stato applicato all’interno della tasca perimplantare, partendo dal fondo e muovendolo in direzione apico-coronale (Figura 5). È stata prestata la dovuta attenzione a evitare la formazione di bolle d’aria, permettendo al fluido di colorare tutti i batteri lasciandolo rimanere nel sito per 60 secondi. Dopo aver risciacquato il fluido via dalla tasca e aver aspirato il liquido in eccesso, la superficie implantare colorata è stata esposta al laser a diodi per un minuto (Figure 6a, b).
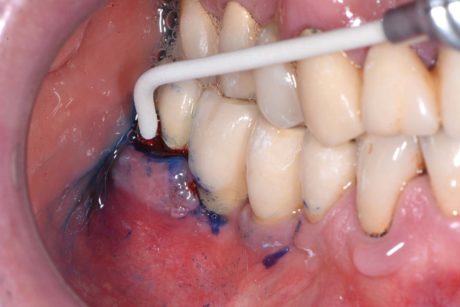

Il flusso era di 25,54 J/cm2, mentre l’energia totale impiegata di 1592 J/cm2. L’illuminazione TheraLite è stata applicata mantenendo la sonda ferma in prossimità del fondo della tasca per 10 secondi, come indicato dal protocollo del produttore. Questo tipo di movimento favorisce l’attivazione delle molecole coloranti con la luce laser e trasferisce la loro energia all’ossigeno locale. Ciò che ne emerge è un ossigeno singoletto altamente aggressivo in grado di distruggere le cellule batteriche.
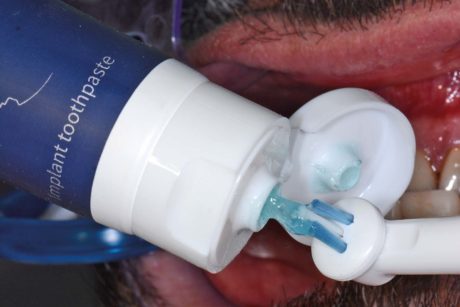
Entrambi i gruppi hanno ricevuto indicazioni sull’igiene orale domiciliare secondo il TBM -Tailored Brushing Method28 (Figure 7, 8, 9a,b). È stato deciso, in condivisione con il paziente, di spazzolare i denti per due minuti due volte al giorno, utilizzando uno spazzolino elettrico rotante oscillante (Oral-B), con un dosaggio minimo di dentifricio (Implaclean®, Dyna Dental Engineering BV, Halsteren, NL), e uno scovolino in gomma (Gum® Soft-Picks® Advanced, Sunstar) per l’igiene interprossimale.
È stato indicato lo spazzolamento con testina Interspace e spazzolino roto-oscillante (Oral-B) a livello del solco implantare. Il dentifricio scelto contiene ossigeno attivo ed è formulato specificatamente per l’igiene quotidiana domiciliare in modo da non danneggiare la superficie implantare.
Follow up
- T1 (30 giorni). A entrambi i gruppi sono stati rilevati gli stessi indici clinici raccolti all’inizio dello studio e i pazienti sono stati nuovamente informati riguardo le norme di igiene orale domiciliare.
- T2 (90 giorni). A entrambi i gruppi sono stati rilevati gli stessi indici clinici raccolti all’inizio dello studio, e i pazienti sono stati nuovamente informati riguardo le norme di igiene orale domiciliare. È stata poi effettuata una rimozione della placca con un air polishing con polvere di glicina e puntali orientati a 90° o a 120°.
- T3, fine dello studio (180 giorni). A entrambi i gruppi sono stati rilevati gli stessi indici clinici raccolti all’inizio dello studio.
Per calcolare i valori medi di ogni gruppo del PD, del FMBS, e del FMPS è stata presa in considerazione, a 30, 90 e 180 giorni, una media ponderata, ed è stata eseguita analisi statistica con test T Student utilizzando un software (Graph Pad Prism 5®).
3. Risultati
Già dopo 30 giorni sono state osservate riduzioni nei parametri clinici in entrambi i gruppi, rispetto ai valori iniziali. Tali riduzioni erano maggiori nel gruppo sperimentale. Sono stati calcolati i valori medi del PD. La riduzione è stata visibile già alla prima rivalutazione, per poi essere confermata a T2, quando i valori sono ulteriormente calati. Le letture sono rimaste costanti fino alla rivalutazione finale. Il gruppo sperimentale ha mostrato un valore migliore del PD, con valore medio di 2 mm, se paragonato a quello del gruppo di controllo (3 mm).
In merito all’indice di placca, il valore medio è stato calcolato su ogni gruppo. In questo caso è stata registrata già a T1 una riduzione significativa. Nonostante il perfezionamento delle pratiche di igiene orale di giorno in giorno, le variazioni dell’indice di placca non sono state costanti. A T2 il gruppo sperimentale ha mostrato un FMPS del 16%, mentre il gruppo di controllo ha mostrato un FMPS del 22%. Non ci sono state differenze significative fra i due gruppi.
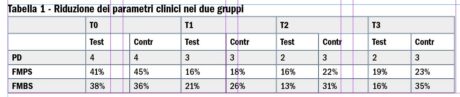
Riguardo al FMBS, all’inizio dello studio, tutti i pazienti avevano sanguinamento al sondaggio e i siti peri-implantari presentevano suppurazione. Fra i pazienti del gruppo sperimentale questi segni di infiammazione sono lentamente spariti del tutto dalla seconda rivalutazione. Nel gruppo di controllo sono stati registrati alcuni miglioramenti, ma non tutti i pazienti sono riusciti a ottenere la remissione totale. Le differenze nel FMBS sono risultate statisticamente significative (p<0,05) a T2 e T3.
I risultati sono riassunti in Tabella 1.
4. Discussione e conclusione
Gli impianti dentali sono diventati il gold standard nella sostituzione degli elementi dentali persi o mancanti.
Decenni di ricerca hanno provato l’efficacia della terapia implantare e il rispettivo successo a lungo termine sia estetico che funzionale. Tuttavia, l’aumento del numero annuale di impianti posizionati ha portato a un incremento di pazienti affetti da perimplantite.
La perimplantite è stata definita come un processo infiammatorio che colpisce i tessuti duri e molli attorno a un impianto osteointegrato ed è associata alla perdita dell’osso marginale di supporto. La mucosite perimplantare invece è una reazione infiammatoria reversibile della mucosa adiacente a un impianto che non comporta la perdita di osso. In accordo con una recente revisione sistematica, la prevalenza della mucosite e della perimplantite varia rispettivamente dal 19% al 65% (media 43%) e dall’1% al 47% (media 22%)29.
La ricerca di un trattamento per questa patologia è divenuta uno degli argomenti maggiormente studiati in campo odontoiatrico. Negli ultimi decenni si è arrivati a comprendere le cause eziologiche che portano allo sviluppo della perimplantite e si sono formulate numerose ipotesi sulla sua gestione terapeutica. Sebbene siano numerosi i fattori di rischio associati alla perimplantite, questa infiammazione patologica è sostenuta dagli stessi microrganismi responsabili delle parodontite.
La colonizzazione, da parte di biofilm batterico, delle superfici implantari avviene rapidamente, e lo sviluppo del biofilm sembra avere un ruolo importante nell’alterazione della biocompatibiltà della superficie dell’impianto, incrementando quindi lo sviluppo della patologia perimplantare30.
Da quando è stata introdotta la terapia fotodinamica nel settore odontoiatrico, in letteratura sono stati evidenziati numerosi vantaggi del laser e della PDT stessa. L’interesse per la PDT come trattamento coadiuvante per la perimplantite sta ampiamente crescendo31. La terapia fotodinamica consiste nell’impiego di una luce visibile (un laser) e di un colorante (un fotosensibilizzatore), la cui combinazione porta al rilascio di radicali liberi di ossigeno, che a loro volta riescono a distruggere, in maniera selettiva, i batteri ed i loro prodotti.
La terapia fotodinamica, con laser a bassa frequenza, presenta alcuni vantaggi rispetto alla terapia tradizionale. Si sa per certo che il laser è in grado di modificare la dentina in modo da ottenere l’esposizione delle fibre di collagene. L’esposizione del collagene può facilitare la coagulazione e la sua stabilizzazione. Ciò può favorire, a sua volta, una rapida guarigione e la formazione di un nuovo attacco epiteliale lungo32.
Questo potrebbe spiegare la maggiore e più rapida guarigione della ferita e i risultati ottenuti nel gruppo sperimentale. Chiaramente per dimostrarlo dovrebbero essere effettuate ulteriori analisi istologiche33. In questo modo la terapia fotodinamica (PDT) potrebbe rappresentare un vero e proprio trattamento alternativo. Solo negli ultimi 15 anni, circa, gli studi clinici hanno esaminato la sua applicazione nella cavità orale.
I dati attuali mostrano che il trattamento della parodontite cronica attraverso la sola PDT, rispetto al solito trattamento di scaling e root planing (SRP), non porta alcun ulteriore beneficio4. Se invece si combina la PDT con il trattamento SRP è possibile apprezzare alcuni benefici, in particolar modo nelle lesioni con condizioni anatomiche sfavorevoli. Uno studio clinico randomizzato controllato ha confrontato l’effetto della sola PDT (senza lo SRP subgengivale) con l’SRP nel trattamento della parodontite aggressiva concludendo che la PDT può ridurre la necessità della terapia chirurgica, il tempo di trattamento, il rischio di batteriemia e migliorare il comfort del paziente35.
Una revisione della letteratura del 2010 ha riportato che la PDT in associazione alla SRP, rispetto alla sola SRP, permette di ottenere un maggiore guadagno di attacco clinico (differenza media di 0.29 mm, intervallo di confidenza del 95% tra 0.08 mm e 0.50 mm p=0.007) ed una più evidente riduzione della profondità di sondaggio a 12 settimane (differenza media 0.11mm, intervallo di confidenza del 95% tra 0.12 mm e 0.35 mm p=0.35)36.
Un recente studio randomizzato controllato splith-mouth su 30 impianti con segni clinici e radiografici di perimplantite ha confrontato i vantaggi della sola terapia tradizionale di scaling (controllo) rispetto alla PDT in associazione con lo scaling (test). I parametri clinici (PPD, CAL, BOP e GI) sono stati misurati prima della terapia, a 45 giorni e a 90 giorni.
La PDT associata allo scaling ha portato ad una risoluzione nel 100% dei casi del sanguinamento al sondaggio (BOP) a 90 giorni dalla terapia. A 45 e 90 giorni il guadagno di CAL è stato, con significato statistico, maggiore nel gruppo test.
Questo studio ha dimostrato che esiste un vantaggio clinico nell’esecuzione della terapia fotodinamica (PDT) in aggiunta alla terapia tradizionale di scaling37.
Nel trattamento della perimplantite, la tecnologia HELBO offre il vantaggio di un’inattivazione batterica non invasiva, indolore e rapida, grazie alla liberazione di ossigeno. L’ossigeno nascente permette la distruzione della membrana batterica e consente la rapida rimozione degli enzimi pericolosi e della collagenosi dalla tasca, al fine di una migliore rimozione batterica, e, di conseguenza, facilitare la guarigione. Il miglioramento dei valori analizzati in questo studio era più evidente nel gruppo sperimentale (Tabella 1).
Il gruppo sperimentale ha mostrato un miglior valore medio di PD di 2 mm, rispetto a quello del gruppo di controllo (3 mm). Riguardo al FMPS, la significativa riduzione registrata A T1 è stata seguita da un lieve aumento A T2, e T3. Tuttavia, i valori dell’indice della placca di ogni paziente a T3 erano più bassi di quelli rilevati all’inizio dello studio. Infine, il confronto tra i valori iniziali e finali di FMBS e suppurazione ha mostrato un miglioramento statisticamente significativo. Così, i risultati ottenuti in questo studio indicano che la terapia fotodinamica potrebbe essere considerata un efficace metodo per la riduzione batterica sulle superfici implantari31-38.
La terapia fotodinamica, tuttavia, dovrebbe essere considerata una terapia di supporto nel trattamento della peri-implantite, in aggiunta ai trattamenti meccanici (scaling) e chirurgici (innesti), proprio per controllare la patologia peri-implantare.
Corrispondenza
profnardi.giannamaria@gmail.com
- Mombelli A, Marxer M, Gaberthüel T et al. The microbiota of osseointegrated implants in patients with a history of periodontal disease. J Clin Periodontol 1995 Feb;22(2):124-30.
- Warrer K, Buser D, Lang NP, Karring T. Plaque-induced peri-implantitis in the presence or absence of keratinized mucosa. An experimental study in monkeys. Clin Oral Implants Res 1995 Sep;6(3):131-8.
- Renvert S, Polyzois IN. Clinical approaches to treat peri-implant mucositis and peri-implantitis. Periodontol 2000. 2015 Jun;68(1):369-404.
- Mombelli A, Müller N, Cionca N. The epidemiology of peri-implantitis. Clin Oral Implants Res 2012 Oct;23 Suppl 6:67-76.
- Javed F, Romanos GE. Impact of diabetes mellitus and glycemic control on the osseointegration of dental implants: a systematic literature review. J Periodontol 2009 Nov;80(11):1719-30.
- Pette GA, Ganeles J, Norkin FJ. Radiographic appearance of commonly used cements in implant dentistry. Int J Periodontics Restorative Dent 2013 Jan-Feb;33(1):61-8.
- Naert I, Duyck J, Vandamme K. Occlusal overload and bone/implant loss. Clin Oral Implants Res 2012 Oct;23 Suppl 6:95-107.
- Tawil G. Peri-implant bone loss caused by occlusal overload: repair of the peri-implant defect following correction of the traumatic occlusion. A case report. Int J Oral Maxillofac Implants 2008 Jan-Feb;23(1):153-7.
- Galindo-Moreno P, León-Cano A, Ortega-Oller I et al. Marginal bone loss as success criterion in implant dentistry: beyond 2 mm. Clin Oral Implants Res 2015 Apr;26(4):e28-34.
- Chen H, Liu N, Xu X et al. Smoking, radiotherapy, diabetes and osteoporosis as risk factors for dental implant failure: a meta-analysis. PLoS One 2013 Aug 5;8(8):e71955.
- Hwang D, Wang HL. Medical contraindications to implant therapy: Part II: Relative contraindications. Implant Dent 2007 Mar;16(1):13-23.
- Esposito M, Grusovin MG, Coulthard P, Worthington HV. The efficacy of interventions to treat peri-implantitis: a Cochrane systematic review of randomised controlled clinical trials. Eur J Oral Implantol Summer 2008;9 Suppl 1(2):111-25.
- Ntrouka V, Hoogenkamp M, Zaura E, van der Weijden F. The effect of chemotherapeutic agents on titanium-adherent biofilms. Clin Oral Implants Res 2011 Nov;22(11):1227-34.
- Schwarz F, Sahm N, Iglhaut G, Becker J. Impact of the method of surface debridement and decontamination on the clinical outcome following combined surgical therapy of peri-implantitis: a randomized controlled clinical study. J Clin Periodontol 2011 Mar;38(3):276-84
- Faggion CM Jr, Schmitter M. Using the best available evidence to support clinical decisions in implant dentistry. Int J Oral Maxillofac Implants 2010 Sep-Oct;25(5):960-9.
- Norowski PA Jr, Bumgardner JD. Biomaterial and antibiotic strategies for peri-implantitis: a review. J Biomed Mater Res B Appl Biomater 2009 Feb;88(2):530-43.
- Marotti J, Neto PT, Toyotade Camposetal T. Recent patents of lasers in implant dentistry. Recent Patents on Biomedical Engineering 2011;(4)2:103-109.
- Nevins M, Nevins ML, Yamamoto A et al. Use of Er:YAG laser to decontaminate infected dental implant surface in preparation for reestablishment of bone-to-implant contact. Int J Periodontics Restorative Dent 2014 Jul-Aug;34(4):461-6.
- Sarkar S, Wilson M. Lethal photosensitization of bacteria in subgingival plaque from patients with chronic periodontitis. J Periodontal Res 1993 May;28(3):204-10.
- Alshehri FA. The role of lasers in the treatment of peri-implant diseases: A review. Saudi Dent J 2016 Jul;28(3):103-8.
- Wilson M, Dobson J, Sarkar S. Sensitization of periodontopathogenic bacteria to killing by light from a low-power laser. Oral Microbiol Immunol 1993 Jun;8(3):182-7.
- Andersen R, Loebel N, Hammond D, Wilson M. Treatment of periodontal disease by photodisinfection compared to scaling and root planing. J Clin Dent 2007;18(2):34-8.
- Shibli JA, Martins MC, Theodoro LH et al. Lethal photosensitization in microbiological treatment of ligature-induced peri-implantitis: a preliminary study in dogs. J Oral Sci 2003 Mar;45(1):17-23.
- Dörtbudak O, Haas R, Bernhart T, Mailath-Pokorny G. Lethal photosensitization for decontamination of implant surfaces in the treatment of peri-implantitis. Clin Oral Implants Res 2001 Apr;12(2):104-8.
- Bassetti M, Schär D, Wicki B et al. Anti-infective therapy of peri-implantitis with adjunctive local drug delivery or photodynamic therapy: 12-month outcomes of a randomized controlled clinical trial. Clin Oral Implants Res 2014 Mar;25(3):279-87.
- Poli PP, Cicciu M, Beretta M, Maiorana C. Peri-implant mucositis and peri-implantitis: a current understanding of their diagnosis, clinical implications, and a report of treatment using a combined therapy approach. J Oral Implantol 2017 Feb;43(1):45-50.
- O’Leary TJ, Drake RB, Naylor JE. The plaque control record. J Periodontol. 1972 Jan;43(1):38.
- Nardi GM, Sabatini S, Guerra F et al. Tailored brushing method (TBM): an innovative simple protocol to improve the oral care. J Biomed 2016; 1:26-31.
- Derks J, Tomasi C. Peri-implant health and disease. A systematic review of current epidemiology. J Clin Periodontol 2015 Apr;42 Suppl 16:S158-71.
- Hayek RR, Araújo NS, Gioso MA et al. Comparative study between the effects of photodynamic therapy and conventional therapy on microbial reduction in ligature-induced peri-implantitis in dogs. J Periodontol 2005 Aug;76(8):1275-81.
- Nardi GM, Sabatini S, Scarano F et al. Utilizzo della terapia fotodinamica Helbo nel trattamento delle perimplantiti: case report. Hygiene Tribune Italian Edition – Marzo 2012.
- Romeo U, Nardi GM, Libotte F et al. The antimicrobial photodynamic therapy in the treatment of peri-implantitis. Int J Den. 2016;2016:7692387.
- O’Neill JF, Hope CK, Wilson M. Oral bacteria in multi-species biofilms can be killed by red light in the presence of toluidine blue. Lasers Surg Med 2002;31(2):86-90.
- Sgolastra F, Petrucci A, Gatto R et al. Photodynamic therapy in the treatment of chronic periodontitis: a systematic review and meta-analysis. Lasers Med Sci 2013 Feb;28(2):669-82.
- Atieh MA. Photodynamic therapy as an adjunctive treatment for chronic periodontitis: a meta-analysis. Lasers Med Sci 2010 Jul;25(4):605-13.
- Malik R, Manocha A, Suresh DK. Photodynamic therapy–a strategic review. Indian J Dent Res 2010 Apr-Jun;21(2):285-91.
- Karimi MR, Hasani A, Khosroshahian S. Efficacy of antimicrobial photodynamic therapy as an adjunctive to mechanical debridement in the treatment of peri-implant diseases: a randomized controlled clinical trial. J Lasers Med Sci 2016 Summer;7(3):139-145.
- Kömerik N, Nakanishi H, MacRobert AJ et al. In vivo killing of Porphyromonas gingivalis by toluidine blue-mediated photosensitization in an animal model. Antimicrob Agents Chemother. 2003 Mar;47(3):932-40.