Riassunto
Obiettivi. Scopo di questo studio è stato quello di verificare l’attività del sistema adesivo di tipo “self-etching primer” (Clearfil Protect Bond, Kuraray, Giappone) contenente methacryloyloxydodecylpyridinium bromide (MDPB) contro i batteri di tipo Streptococcus mutans e di osservare la proliferazione sotto forma di biofilm in restauri di prima classe in vitro. Per stabilirne l’efficacia un analogo sistema adesivo (Clearfil SE Bond, Kuraray, Giappone) è stato impiegato nel medesimo esperimento scambiando i rispettivi agenti leganti.
Materiali e metodi. Quaranta prime classi di forma rotonda sono state eseguite con fresa pre-calibrata in sezioni di smalto dentina bovina simili per dimensione: nel Gruppo 1 le cavità sono state riempite con composito dopo averne condizionato le pareti cavitarie con il primer contenente MDPB e il sistema adesivo di SE Bond mentre nel Gruppo 2 il sistema di adesione era assicurato dal primer del sistema SE Bond e dall’adesivo del sistema Protect Bond. L’inversione dei due composti dei sistemi adesivi è stata eseguita per eliminare l’eventuale effetto antibatterico presente nel bonding del sistema Protect Bond. I campioni sono stati inseriti in camera sterile e inseminati con un ceppo di S.mutans; la crescita è stata monitorata dopo 48 ore. I campioni sono stati quindi avviati all’osservazione in microscopia elettronica. L’analisi dei dati è stata effettuata e valutata statisticamente attraverso un’ANOVA dopo trasformazione degli stessi.
Risultati. Il Gruppo 2 ha mostrato una consistente crescita batterica se paragonata a quella presente nel Gruppo 1, sia sulle superfici smaltee che su quelle dentinali (p<0.001).
Conclusioni. Il sistema adesivo contenente MDPB ha diminuito in modo significativo la crescita batterica a 48 ore; sono tuttavia necessari ulteriori approfondimenti per chiarire il ruolo dei componenti a base di ammonio quaternario nei confronti della colonizzazione batterica delle superfici dei restauri dentali e delle strutture dentali residue.
Summary
Influence of MDPB-containing primer on Streptococcus mutans biofilm formation in simulated class I restorations
Purpose. The aim of the study was to evaluate the activity of a methacryloyloxydodecylpyridinium bromide (MDPB)-containing self-etching primer (Clearfil Protect Bond, Kuraray, Japan) against Streptococcus mutans and its ability to reduce biofilm formation on standardized experimental restorations. The inhibitory activity of the tested primer was compared with that of MDPB-free self-etching adhesive primer (Clearfil SE Bond Primer, Kuraray, Japan) by exchanging their respective bonding agents to evaluate any influence of the adhesives.
Materials and methods. Forty experimental Class I round restorations were prepared on enamel-dentin slabs using two different adhesive strategies: Group 1 specimens were bonded with MDPB-containing primer and SE Bond bonding agent, while Group 2 specimens were bonded with MDPB-free primer and Clearfil Protect Bond bonding agent. A Streptococcus mutans biofilm was grown for 48 h on the restoration surfaces and subsequently evaluated using scanning electron microscopy on two different areas: enamel and composite surfaces. Statistical analysis was performed by multiple ANOVA analysis after data transformation.
Results. Group 2 specimens showed greater biofilm formation than Group 1 specimens (p<0.001) both on enamel and composite areas.
Conclusions. MDPB-containing primer adhesive system decreased significantly biofilm formation in Class I restorations. Further in vitro and in vivo studies are required to clarify the role of quaternary ammonium compounds in reducing bacterial biofilm formation on restorations surfaces.
Il problema delle carie secondarie è, ancora oggi, molto difficile da risolvere e rimane un importante obiettivo da raggiungere nel preservare i restauri dentali a lungo termine2,18,44,45,49,56. Per ottenere questo risultato, la comprensione delle interazioni biologiche tra placca batterica e materiali da restauro riveste un ruolo fondamentale; esse sono state a lungo studiate da molti ricercatori5,24,27. In molti riscontri di letteratura tali interazioni si sono rivelate molto importanti nel promuovere la crescita batterica sotto forma di biofilm3,14,16.
In aggiunta la colonizzazione da parte di Streptococcus mutans (S. mutans) delle aree all’interfaccia tra dente e restauro risulta determinante per il mantenimento dell’integrità del restauro stesso e dei tessuti circostanti22,23,26. Infatti i “gap” marginali tra adesivo (DBS) e dentina, come ben dimostrato da Tay et al.52 possono essere dei luoghi elettivi ove la placca può proliferare nel tempo indisturbata8,54. Lo sviluppo di nuovi materiali per odontoiatria restaurativa è iniziato da tempo e molte ricerche sono state svolte per trovare un prodotto che potesse essere attivo contro la flora batterica che, inevitabilmente, si sviluppa nelle zone di contatto tra materiale da ricostruzione e struttura dentale residua50.
Le strategie costruttive per ottenere questo tipo di materiale sono state molteplici; la più recente è stata quella di incorporare agenti antibatterici all’interno dei materiali compositi. Da qui la produzione di materiali compositi addizionati con cementi vetroionomerici liberanti fluoro, polimeri contenenti disinfettanti come il triclosano47, polimeri con varie tipologie contenenti ossido di zinco1,43, clorexidina15,38 e nano particelle di polyethyleneimina4,51. Altri studi hanno proposto l’impiego di composti dell’ammonio quaternario nella formulazione di resine composite e, in particolare, nei DBS53, il che comporterebbe una significativa attività antibatterica laddove le necessità di fronteggiare la placca sono maggiori, ovvero nella zona di interfaccia tra dente e restauro. Ad esempio, l’aggiunta di methacryloxyethyl cetyl dimethyl ammonium chloride (DMAE-CB) alla matrice resinosa di un DBS determina, secondo gli studi di Xiao et al., una potente attività antibatterica57. Il methacryloyloxydodecylpyridinium bromide (MDPB) è probabilmente il polimero metacrilico a base di ammonio quaternario più studiato negli ultimi anni. Decritto per primo da Imazato e coll.28,31,32, il MDPB è stato inserito in self-etch DBS del commercio da alcuni anni (Clearfil Protect Bond,Kuraray, Tokyo, Japan). Si è potuto notare che il suo maggiore vantaggio è quello di co-polimerizzare con le altre resine formanti la matrice di questi agenti leganti29 e ciò avrebbe la peculiare caratteristica di prolungare la sua azione battericida topica. In aggiunta, dato il legame stabile con il reticolo polimerico il MDPB non dovrebbe eluire in quantità significative nell’ambiente circostante. Le attività antibatteriche legate al MDPB sono state a lungo studiate10,11,30,35,58; tuttavia non sono del tutto note le sue capacità di inibire i batteri cariogeni nelle fasi di trasformazione in biofilm55 e, per conseguenza, sulla reale efficacia di questo presidio nel diminuire la colonizzazione dei restauri adesivi. Particolarmente, la letteratura è povera di contributi riguardanti il ruolo dell’MDPB contenuto nei primer in condizioni dinamiche di proliferazione della placca. Questo perché la messa a punto di sistemi di valutazione di laboratorio che assomiglino alle condizioni in vivo è poco sviluppata: è indispensabile quindi ricreare in modo simile queste condizioni per verificare la reale efficacia dei sistemi di azione antibatterica forniti da questi materiali di nuova generazione17. Obiettivo di questo studio è stato quello di verificare la reale efficacia di un self-etch DBS contenente MDPB sulla formazione di biofilm di S. mutans in restauri adesivi di I Classe. L’ipotesi nulla era quella secondo cui il sistema adesivo self-etch contenente MDPB non avrebbe determinato alcun cambiamento sulla proliferazione batterica in questo ambito se paragonato ad analogo materiale non contenente lo stesso principio attivo.
Materiali e metodi
Preparazione dei campioni
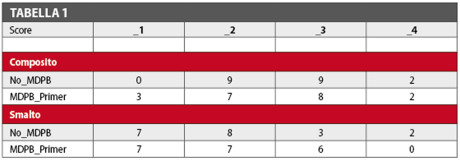
Quaranta incisivi umani, estratti per motivi parodontali, sono stati reperiti nel reparto di Chirurgia Orale, Clinica Odontoiatrica, DIS dell’Università di Milano. Una volta detersi sono stati conservati a -20 °C sino alla preparazione di 40 pezzi di 6.5 mm in diametro e 2.5 mm in altezza sulla superficie labiale degli stessi con una fresa calibrata sotto consistente getto d’acqua (INDIAM, Carrara, MS, Italy). All’interno di questi pezzi si sono realizzate 40 cavità di I Classe, 3 mm in diametro e 1.5 mm in profondità, con una fresa cilindrica diamantata dedicata (Intensiv SA, Grancia, Switzerland). Ciascuna delle cavità è stata assegnata in modo casuale ai due trattamenti smalto-dentinali previsti con i sistemi adesivi descritti nella Tabella 1.
Gruppo 1. In 20 cavità il processo adesivo è stato ottenuto mescolando il primer tipo self-etch contenente MDPB (Clearfil Protect Bond primer) con il legante resinoso (bonding) privo di fluoro del sistema adesivo (Clearfil SE Bond bonding). Il primer è stato applicato con strofinamento continuo di un “micro-brush” nella cavità e lasciato agire per 20 secondi. La cavità di ciascun campione è stata asciugata con getto d’aria lieve per far evaporare le componenti volatili ed è stato applicato il bonding con un analogo “micro-brush”; il tutto è stato polimerizzato per 40 secondi con lampada LED a 800 mW/cm2 (MiniLed, Satelec, Francia).
Gruppo 2. In altre 20 cavità il primer del sistema self-etching privo di MDPB (Clearfil SE Bond primer) è stato miscelato con il bonding contenente fluoro del sistema adesivo menzionato (Clearfil Protect Bond bonding). Il primer è stato applicato con strofinamento continuo di un “micro-brush” nella cavità e lasciato agire per 20 secondi. La cavità di ciascun campione è stata asciugata con getto d’aria lieve per far evaporare le componenti volatili ed è stato applicato il bonding con un analogo “micro-brush”; il tutto è stato polimerizzato per 40 secondi con lampada LED a 800 mW/cm2 (MiniLed, Satelec, Francia).
Le cavità così condizionate sono state riempite con un composito tradizionale microibrido (Filtek Supreme XT, 3M, St Paul, MN, USA) e polimerizzato per 40 s dalla stessa sorgente luminosa impiegata in precedenza. I restauri sono stati lucidati con Motopol 8 polishing machine (Buehler, Lake Bluff, IL, USA) e con dischi abrasivi umidi a grana fine, rispettivamente di 1000, 2000 e 4000. Ciò ha condotto alla formazione di una superficie liscia con discrepanze di rugosità inferiori < 0.2 µm, che possono essere considerati clinicamente irrilevanti.
Preparazione della saliva
Quattro donatori di età media (32±8 anni) hanno fornito la saliva necessaria allo studio. Essa è stata raccolta secondo le metodologie suggerite da Guggenheim et al20.
La saliva è stata centrifugata per 15 min a 4 °C (12,000 rpm) in provette sterili e il supernatante è stato pastorizzato (60 °C per 30 min) e conservato a −20 °C. Prima dell’inizio dell’esperimento la saliva è stata decongelata e lasciata a 37 °C per 1 ora.
Procedure microbiologiche
Ogni campione è stato posto in una piastra a 24 pozzetti (24-well polystyrene plates – Sigma-Aldrich, St. Louis, MO, USA) e conservato al buio per 24 h a 37 °C al fine di consentire la completa polimerizzazione della resina. Successivamente a ogni pozzetto sono stati aggiunti 2 mL di PBS (PBS, Sigma-Aldrich) e i campioni sono stati mantenuti in immersione per sette giorni al fine di favorire l’eluizione dei monomeri non polimerizzati. Durante l’incubazione i pozzetti sono stati lavati due volte con PBS. Prima dell’inizio dell’esperimento i campioni sono stati sterilizzati con un sistema al plasma di perossido di idrogeno (chemical peroxide-ion plasma sterilizer, STERRAD, ASP, Pratica di Mare, Roma, Italy). Tale sistema raggiunge una temperatura massima di 40 °C ed evita danni termici ai tessuti dentali e al materiale resinoso. In ciascun pozzetto è stato inserito 1 ml della saliva precedentemente trattata e le piastre sono state incubate in termostato per 1 h a 37 °C. La saliva è stata quindi rimossa e i pozzetti sono stati lavati con PBS due volte. I terreni di coltura microbiologici sono stati acquistati dalla Becton-Dickinson (BD Diagnostics-Difco, Franklin Lakes, NJ, USA). Piastre di Mitis Salivarius Bacitracina agar sono state inoculate con il ceppo da collezione di S. mutans ATCC 25175 e incubate a 37 °C per 48 h in un ambiente arricchito con il 5% di CO2. Dalle colonie sviluppate sulla superficie del terreno selettivo è stata ottenuta una sospensione di cellule batteriche in fase logaritmica la cui densità ottica è stata aggiustata a 0.3 OD, usando uno spettrofotometro (Genesys 10S, Thermo Spectronic, Rochester, NY, USA). Una calibrazione precedente aveva dimostrato che una diluizione a 0.3 unità OD conteneva 1.5×105 cfu/mL. I campioni sterili sono stati posti nelle piastre a 24 pozzetti ciascuno contenente 1.5 mL di Tripticase Soy Broth sterile e 250 µL di sospensione batterica. Le piastre sono state incubate per 48 ore a 37 °C in un ambiente arricchito con il 5% di CO2 al fine di promuovere la formazione di un biofilm di S. mutans sulla superficie dei campioni.
Analisi in microscopia elettronica a scansione
Dopo l’incubazione i campioni sono stati lavati per tre volte con 1 mL di PBS sterile al fine di rimuovere le cellule batteriche non aderenti e sono stati sottoposti a processo di fissazione con glutaraldeide al 2% (Sigma-Aldrich) per 1 settimana. I campioni sono stati successivamente disidratati utilizzando la scala degli alcool e, infine, sottoposti a essicazione al punto critico (Critical-point Dryer, EMS 850, Hatfield, PA, USA). I campioni sono stati successivamente montati su stub per microscopia elettronica in alluminio mediante colla conduttiva, metallizzati (JEOL FFC-1100 Sputter Coater, Japan) e osservati al microscopio elettronico a scansione (JEOL JSM 8400, Japan).
Due osservatori indipendenti sono stati addestrati e calibrati attraverso l’osservazione di una serie di immagini che corrispondessero alla scala di seguito riportata. La scala di valutazione di tipo semi-quantitativo prevedeva 6 livelli di colonizzazione, da 0 a 5, ed era basata su quella descritta da Martins Júnior et al41:
- 0. nessuna cellula visibile batterio;
- 1. presenza di cellule batteriche in numero ridotto;
- 2. presenza di un monostrato di cellule batteriche;
- 3. presenza di un monostrato di cellule batteriche con tendenza a formare aggregati pluristratificati;
- 4. presenza di un biofilm pluristratificato; la superficie del tessuto o del restauro è visibile solo in alcune parti del preparato;
- 5. presenza di un biofilm pluristratificato; la superficie del dente o del restauro non è visibile in alcuna parte del preparato.
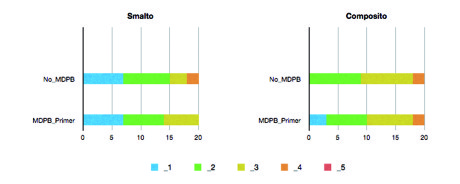
- Per ogni campo microscopico a 600 ingrandimenti è stato valutato, mediante la scala sopracitata, il grado di colonizzazione batterica su tre aree specifiche: smalto, interfaccia e composito.
Analisi statistica
Tutti i dati sono stati processati con il sistema SAS Statistical Package (SAS 9.1). Per verificare gli effetti sulle superfici e sui gruppi è stato utilizzato un esame attraverso ANOVA multipla con trasformazione dei dati da non parametrici a parametrici dovuta all’asimmetria negativa e all’eterogeneità tra i gruppi9. La validità dei dati inter- e intra-esaminatori è stata saggiata con kappa test (κ).
Risultati
Al fine di verificare in vitro l’attività antimicrobica di un sistema adesivo tipo self-etch che contiene il polimero MDPB (Clearfil Protect Bond primer), abbiamo comparato la formazione di biofilm in fase statica sia su smalto che su composito in restauri di prima classe attraverso il confronto tra due gruppi sperimentali. La colonizzazione batterica è risultata variabile attorno ai restauri di I classe come espresso e riassunto nella Tabella 2.
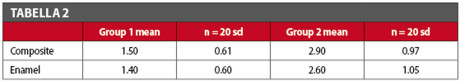 Alcuni quadri di proliferazione sono mostrati nella Figura 1.
Alcuni quadri di proliferazione sono mostrati nella Figura 1.
Nei campioni in cui si è impiegato il primer con MDPB (Gruppo 1) una quantità molto bassa di biofilm è stata osservata, addirittura quasi non comparabile con quella mostrata, invece, nei campioni del Gruppo 2 sebbene in questi ultimi il sistema adesivo potesse fruire della presenza del fluoro nell’agente legante (bonding).

Tale differenza è parsa altamente significativa (p < 0.001) ma, sorprendentemente, non è stata apprezzata tra smalto e materiale da restauro (Figura 2). L’affidabilità delle osservazioni inter- e intra-esaminatori è stata considerata eccellente (κ = 0.81).
Discussione
I moderni sistemi adesivi non possono impedire la formazione, in assoluto, di micro cavità tra tessuti duri dentali e materiali compositi30; per questo motivo l’inclusione di agenti antibatterici – quale il MDPB – all’interno dei DBS può rappresentare una valida alternativa finalizzata a impedire una colonizzazione microbica precoce delle superfici del dente e del restauro11,58. Il risultato raggiunto in questo studio autorizza a rigettare l’ipotesi nulla, poiché il DBS del Gruppo 1, ovvero quello contenente un primer con MDPB, ha ridotto in modo consistente la colonizzazione batterica sui restauri se paragonato all’analogo self-etching primer DBS senza MDPB (p < 0.05).
Sulla base di considerazioni più generali, è bene ricordare che la placca batterica si forma nel cavo orale attraverso sistematiche di aggregazione assai complesse e difficili da codificare per intero12. Pertanto la colonizzazione deve essere considerata un processo dinamico che, in ultima analisi, fa sì che la resistenza degli organismi cellulari di origine batterica sia maggiore agli agenti antimicrobici rispetto a quello che appare in esperimenti di laboratorio, ove le condizioni non sono paragonabili a quelle descritte in esperimenti in vivo42.
Per tali motivi il reattore statico impiegato in questo studio fornisce una metodologia semplice ed economica per replicare situazioni simil-cliniche nell’ambito della crescita del biofilm batterico nell’arco di 24-48 h. Vero è che la multiformità della placca mal si presta a valutazioni come questa; tuttavia la scelta di S. mutans rappresenta quella obbligata dato il ruolo primario che esso gioca nello sviluppo della carie primaria e secondaria46. In aggiunta, esso è considerato uno dei primi colonizzatori della superficie dentale, in virtù di un’adesività alle superfici superiore a quella di altri microrganismi.
Vari studi hanno dimostrato che la formazione42 in vivo del biofilm è fortemente influenzata dalla saliva; infatti, con questa finalità, per simulare le situazioni in vivo nelle quali i restauri vengono immediatamente coperti dalla pellicola salivare25, nello studio è stato previsto l’impiego di saliva. Infine, pare importante aggiungere che la saliva possa attenuare o annullare le differenze in energia libera di superficie caratteristiche di ogni materiale36.
La cavità di I Classe è un paradigma utile di confronto per comparare situazioni cliniche frequenti e le procedure di lucidatura impiegate sono state utilizzate per eliminare lo strato superficiale di materiale composito non sufficientemente polimerizzato per l’inibizione dell’ossigeno presente in superficie. A scopo esemplificativo, un nostro precedente contributo ha mostrato che il grado di conversione dei materiali compositi è inversamente proporzionale alla colonizzazione batterica7.
Tra i composti dell’ammonio quaternario inglobati in metacrilato, il MDPB ha mostrato avere attività battericida per interazione con la superficie della cellula batterica34, che si tradurrebbe in un danno citoplasmatico rilevante39,40. Sebbene questi composti nella forma aggregata del polimero abbiano minore forza battericida13, questa si sarebbe dimostrata sufficiente in molte situazioni sperimentali40.
Nell’esperimento da noi eseguito, al fine di verificare la sola efficacia del MDPB, il primer del DBS (Clearfil Protect Bond) è stato combinato con un bonding compatibile privo di fluoro (Clearfil SE Bond).
Per il motivo sopra menzionato, quindi, il MDPB sarebbe il responsabile dell’effetto inibitorio esercitato dal sistema adesivo nei confronti della specie batterica prescelta in questo esperimento, ovvero il biofilm di S. mutans; tale effetto si è esplicato sia sullo smalto che sulla superficie del restauro. L’interpretazione di questi risultati potrebbe far presupporre che l’agente contenuto nel primer abbia una sua efficacia non solo limitatamente alla zona dell’adesivo, per sé, ma anche a distanza.
Molto più probabilmente, però, questo effetto potrebbe essere dovuto a una eluizione dello stesso nella coltura, evento desiderabile nelle prime fasi del posizionamento del restauro ma negativo se considerato nel lungo periodo.
I nostri risultati sono in accordo con quelli già espressi in passato da Imazato et al.32 che studiò gli effetti di un adesivo self-etching (Clearfil Protect Bond) su S. mutans, Lactobacillus casei e Actinomyces naeslundii attraverso un meccanismo di diffusione su agar.
Gondim et al.19 usando una metodologia analoga hanno confermato che primer contenti MDPB potevano avere effetto contro la flora cariogena; Fang Li et al.40, usando la microscopia confocale laser scanning (CLSM) con indicatori fluorescenti, hanno dimostrato una franca inibizione della crescita di S. mutans sia da parte di un monomero antibatterico (methacryloxylethyl cetyl dimethyl ammonium chloride – DMAE-CB) incorporato a un adesivo sia da un analogo prodotto contenente MDPB. Thomé et al.55 ha analizzato, in vitro, l’effetto di resine per ricostruzione con MDPB sullo sviluppo di carie secondarie, ottenendo risultati molto soddisfacenti. Per contro, Rolland e coll.48 non ha riportato analoghi significativi risultati comparando adesivi con e senza MDPB. Hahnel e coll.21 comparando l’effetto del MDPB con adesivi a base di siloranica giunsero alla conclusione che la ridotta adesione iniziale al composito su base siloranica potrebbe essere la chiave dei risultati di questo esperimento. Tuttavia, come dimostrato da studi precedentemente citati, la dinamica di adesione ai materiali è fortemente influenzata dalle condizioni sperimentali e, pertanto, la difformità di alcuni riscontri potrebbe avere questa spiegazione. A corollario di quanto dimostrato è altresì evidente che l’effetto del fluoro incorporato nel prodotto commerciale Clearfil Protect Bond abbia poco effetto nei confronti di S. mutans, almeno nella prima parte della colonizzazione delle superfici.
È noto che il fluoro ostacola ma non inibisce la crescita batterica; tuttavia, anche questo aspetto sembra essere controverso. Infatti, alcuni studi in vitro hanno mostrato una ridotta colonizzazione da parte di S. mutans su cementi vetroionomerici rispetto a quanto ottenuto sui materiali compositi, sui vetroionomeri modificati con resina e compomeri29. Il ruolo attributo al fluoro fuoriuscito da questi elementi pare non essere l’elemento preponderante nel contrastare l’adesione batterica poiché, nei compositi costruiti con rilascio di fluoro, la quota parte pare essere poco influente nei confronti della crescita batterica25,33,34,37. Probabilmente, l’incorporazione di fluoro si traduce in una ridotta copolimerizzazione dell’insieme e questo fatto può portare all’aumento dell’adesione batterica, non sufficientemente contrastata dalla quota di fluoro eluito dal materiale composito31.
Conclusioni
Questo studio supporta l’evidenza secondo cui l’incorporazione di MDPB in un DBS può ridurre in modo cospicuo la colonizzazione da parte di S. mutans nei restauri di I Classe. L’azione di MDPB dopo la polimerizzazione è presente non solo a livello delle interfacce adesive ma su tutte le superfici e questo potrebbe far presupporre che il materiale possa avere benefici effetti immediati e a distanza. È altresì evidente che studi più a lunga distanza possano essere effettuati per corroborare questa prima ipotesi.
Corrispondenza
Eugenio Brambilla
Dipartimento di Medicina, Chirurgia e odontoiatria, Università degli Studi di Milano
Via Beldiletto 1/3, 20142 Milano
Tel. +39 02 50319007 – fax +39 02 50319040
eugenio.brambilla@unimi.it
Eugenio Brambilla1
Andrei Ionescu1
Luigi Fadini1
Annalisa Mazzoni2
Lorenzo Breschi3
Massimo Gagliani1
1Dipartimento di Scienze della Salute, Università degli Studi di Milano
2Laboratorio di Immunoreumatologia e Biologia Cellulare – Ramses Laboratory c/o Istituto Ortopedico Rizzoli, Bologna e Dipartimento SAU&FAL, Università degli Studi di Bologna
3Dipartimento di Scienze Mediche, Unità di Scienze Dentali e Biomateriali, Università degli Studi di Trieste, IGM-CNR, Unità di Bologna c/o IOR, Bologna
2. Bernardo M et al. Survival and reasons for failure of amalgam versus composite posterior restorations placed in a randomized clinical trial. J Am Dent Assoc 2007;138:775-83. 3. Beyth N, Bahir R, Matalon S, Domb AJ, Weiss EI. Streptococcus mutans biofilm changes surface-topography of resin composites. Dent Mater 2008;24:732-6. 4. Beyth N, Yudovin-Fearber I, Domb AJ, Weiss EI. Long-term antibacterial surface properties of composite resin incorporating polyethyleneimine nanoparticles. Quintessence Int 2010;41:827-35. 5. Bollen CM, Lambrechts P, Quirynen M. Comparison of surface roughness of oral hard materials to the threshold surface roughness for bacterial plaque retention: a review of the literature. Dent Mater 1997;13:258-69. 6. Brambilla E, Cagetti MG, Gagliani M, Fadini L, Garcia-Godoy F, Strohmenger L. Influence of different adhesive restorative materials on mutans streptococci colonization. Am J Dent 2005;18:173-6. 7. Brambilla E, Gagliani M, Ionescu A, Fadini L, Garcia-Godoy F. The influence of light-curing time on the bacterial colonization of resin composite surfaces. Dent Mater 2009;25:1067-72. 8. Burgers R et al. Effects of aging on surface properties and adhesion of Streptococcus mutans on various fissure sealants. Clin Oral Investig 2009;13:419-26. 9. Conover W. On some alternative procedures using ranks for the analysis of experimental designs. Commun Stat 1978;5:1349-1368. 10. da Silva BM, Franca FM, Florio FM, Basting RT. In situ anticariogenic effect of adhesive systems containing fluoride and MDPB. Am J Dent 2010;23:75-80. 11. de Carvalho FG, Puppin-Rontani RM, Soares LE, Santo AM, Martin AA, Nociti-Junior FH. Mineral distribution and CLSM analysis of secondary caries inhibition by fluoride/MDPB-containing adhesive system after cariogenic challenges. J Dent 2009;37:307-14. 12. Donlan RM, Costerton JW. Biofilms: survival mechanisms of clinically relevant microorganisms. Clin Microbiol Rev 2002;15:167-93. 13. Ebi N, Imazato S, Noiri Y, Ebisu S. Inhibitory effects of resin composite containing bactericide-immobilized filler on plaque accumulation. Dent Mater 2001;17:485-91. 14. Engelmann J, Leyhausen G, Leibfritz D, Geurtsen W. Metabolic effects of dental resin components in vitro detected by NMR spectroscopy. J Dent Res 2001;80:869-75. 15. Frencken JE et al. Antibacterial effect of chlorhexidine- containing glass ionomer cement in vivo: a pilot study. Caries Res 2007;41:102-7. 16. Geurtsen W, Leyhausen G. Chemical-Biological Interactions of the resin monomer triethyleneglycol-dimethacrylate (TEGDMA). J Dent Res 2001;80:2046-50. 17. Goeres DM et al. A method for growing a biofilm under low shear at the air-liquid interface using the drip flow biofilm reactor. Nat Protoc 2009;4:783-8. 18. Goldstein GR. The longevity of direct and indirect posterior restorations is uncertain and may be affected by a number of dentist-, patient-, and material-related factors. J Evid Based Dent Pract 2010;10:30-1. 19. Gondim JO, Duque C, Hebling J, Giro EM. Influence of human dentine on the antibacterial activity of self-etching adhesive systems against cariogenic bacteria. J Dent 2008;36:241-8. 20. Guggenheim B, Giertsen E, Schupbach P, Shapiro S. Validation of an in vitro biofilm model of supragingival plaque. J Dent Res 2001;80:363-70. 21. Hahnel S, Leyer A, Rosentritt M, Burgers R, Handel G. Surface properties and in vitro Streptococcus mutans adhesion to self-etching adhesives. J Adhes Dent 2009;11:263-269. 22. Hahnel S, Rosentritt M, Burgers R, Handel G. Adhesion of Streptococcus mutans NCTC 10449 to artificial teeth: an in vitro study. J Prosthet Dent 2008;100:309-15. 23. Hahnel S, Rosentritt M, Burgers R, Handel G. Surface properties and in vitro Streptococcus mutans adhesion to dental resin polymers. J Mater Sci Mater Med 2008;19:2619-27. 24. Hansel C, Leyhausen G, Mai UE, Geurtsen W. Effects of various resin composite (co)monomers and extracts on two caries-associated micro-organisms in vitro. J Dent Res 1998;77:60-7. 25. Hicks J, Garcia-Godoy F, Donly K, Flaitz C. Fluoride-releasing restorative materials and secondary caries. Dent Clin North Am 2002;46:247-76, vi. 26. Huang M, Meng L, Fan M, Hu P, Bian Z. Effect of biofilm formation on virulence factor secretion via the general secretory pathway in Streptococcus mutans. Arch Oral Biol 2008;53:1179-85. 27. Ikeda M, Matin K, Nikaido T, Foxton RM, Tagami J. Effect of surface characteristics on adherence of S. mutans biofilms to indirect resin composites. Dent Mater J 2007;26:915-23. 28. Imazato S. Antibacterial properties of resin composites and dentin bonding systems. Dent Mater 2003;19:449-57. 29. Imazato S, Ebi N, Takahashi Y, Kaneko T, Ebisu S, Russell RR. Antibacterial activity of bactericide-immobilized filler for resin-based restoratives. Biomaterials 2003;24:3605-9. 30. Imazato S, Kaneko T, Takahashi Y, Noiri Y, Ebisu S. In vivo antibacterial effects of dentin primer incorporating MDPB. Oper Dent 2004;29:369-75. 31. Imazato S, Kinomoto Y, Tarumi H, Ebisu S, Tay FR. Antibacterial activity and bonding characteristics of an adhesive resin containing antibacterial monomer MDPB. Dent Mater 2003;19:313-9. 32. Imazato S, Kuramoto A, Takahashi Y, Ebisu S, Peters MC. In vitro antibacterial effects of the dentin primer of Clearfil Protect Bond. Dent Mater 2006;22:527-32. 33. Imazato S, McCabe JF. Influence of incorporation of antibacterial monomer on curing behavior of a dental composite. J Dent Res 1994;73:1641-5. 34. Imazato S, Russell RR, McCabe JF. Antibacterial activity of MDPB polymer incorporated in dental resin. J Dent 1995;23:177-81. 35. Izutani N et al. Effects of the antibacterial monomer 12-methacryloyloxydodecylpyridinium bromide (MDPB) on bacterial viability and metabolism. Eur J Oral Sci 2011;119:175-81. 36. Kantorski KZ, Scotti R, Valandro LF, Bottino MA, Koga-Ito CY, Jorge AO. Adherence of Streptococcus mutans to uncoated and saliva-coated glass-ceramics and composites. Gen Dent 2008;56:740-7; quiz 748-9,768. 37. Kantorski KZ, Scotti R, Valandro LF, Bottino MA, Koga-Ito CY, Jorge AO. Surface roughness and bacterial adherence to resin composites and ceramics. Oral Health Prev Dent 2009;7:29-32. 38. Kwon TY, Hong SH, Kim YK, Kim KH. Antibacterial effects of 4-META/MMA-TBB resin containing chlorhexidine. J Biomed Mater Res B Appl Biomater 2010;92:561-7. 39. i F et al. Anti-biofilm effect of dental adhesive with cationic monomer. J Dent Res 2009;88:372-6. 40. Li F et al. Effects of a dental adhesive incorporating antibacterial monomer on the growth, adherence and membrane integrity of Streptococcus mutans. J Dent 2009;37:289-96. 41. Martins Junior W, De Rossi A, Samih Georges Abi Rached R, Rossi MA. A scanning electron microscopy study of diseased root surfaces conditioned with EDTA gel plus Cetavlon after scaling and root planing. J Electron Microsc (Tokyo) 2011;60:167-75. 42. Mo SS, Bao W, Lai GY, Wang J, Li MY. The microfloral analysis of secondary caries biofilm around Class I and Class II composite and amalgam fillings. BMC Infect Dis 2010;10:241. 43. Niu LN et al. Tetrapod-like zinc oxide whisker enhancement of resin composite. J Dent Res 2010;89:746-50. 44. Opdam NJ, Bronkhorst EM, Roeters JM, Loomans BA. Longevity and reasons for failure of sandwich and total-etch posterior composite resin restorations. J Adhes Dent 2007;9:469-75. 45. Opdam NJ, Bronkhorst EM, Roeters JM, Loomans BA. A retrospective clinical study on longevity of posterior composite and amalgam restorations. Dent Mater 2007;23:2-8. 46. Paradella TC, de Sousa FA, Koga-Ito CY, Jorge AO. Microbiological or chemical models of enamel secondary caries compared by polarized-light microscopy and energy dispersive X-ray spectroscopy. J Biomed Mater Res B Appl Biomater 2009;90:635-40. 47. Rathke A, Staude R, Muche R, Haller B. Antibacterial activity of a triclosan-containing resin composite matrix against three common oral bacteria. J Mater Sci Mater Med 2010;21:2971-7. 48. Rolland SL, McCabe JF, Robinson C, Walls AW. In vitro biofilm formation on the surface of resin-based dentine adhesives. Eur J Oral Sci 2006;114:243-9. 49. Roumanas ED. The frequency of replacement of dental restorations may vary based on a number of variables, including type of material, size of the restoration, and caries risk of the patient. J Evid Based Dent Pract 2010;10:23-4. 50. Saku S et al. Antibacterial activity of composite resin with glass-ionomer filler particles. Dent Mater J 2010;29:193-8. 51. Takahashi Y, Imazato S, Kaneshiro AV, Ebisu S, Frencken JE, Tay FR. Antibacterial effects and physical properties of glass-ionomer cements containing chlorhexidine for the ART approach. Dent Mater 2006;22:647-52. 52. Tay FR et al. Bonding of a self-etching primer to non-carious cervical sclerotic dentin: interfacial ultrastructure and microtensile bond strength evaluation. J Adhes Dent 2000;2:9-28. 53. Tezvergil-Mutluay A et al. The inhibitory effects of quaternary ammonium methacrylates on soluble and matrix-bound MMPs. J Dent Res 2011;90:535-40. 54. Thomas RZ, van der Mei HC, van der Veen MH, de Soet JJ, Huysmans MC. Bacterial composition and red fluorescence of plaque in relation to primary and secondary caries next to composite: an in situ study. Oral Microbiol Immunol 2008;23:7-13. 55. Thome T, Mayer MP, Imazato S, Geraldo-Martins VR, Marques MM. In vitro analysis of inhibitory effects of the antibacterial monomer MDPB-containing restorations on the progression of secondary root caries. J Dent 2009;37:705-11. 56. van Dijken JW, Pallesen U. Clinical performance of a hybrid resin composite with and without an intermediate layer of flowable resin composite: a 7-year evaluation. Dent Mater 2011;27:150-6. 57. Xiao YH, Ma S, Chen JH, Chai ZG, Li F, Wang YJ. Antibacterial activity and bonding ability of an adhesive incorporating an antibacterial monomer DMAE-CB. J Biomed Mater Res B Appl Biomater 2009;90:813-7. 58. Yoshikawa K et al. The effect of antibacterial monomer MDPB on the growth of organisms associated with root caries. Dent Mater J 2007;26:388-92.