
• Domenico Viscuso1,5
• Massimiliano Di Giosia2
• Giulia Borromeo3
• Marco Persia4
• Vincenzo Piras5
1Istituto Stomatologico Italiano, Milano, Reparto di Gnatologia
2Consulente odontoiatrico per il Centro di Medicina del Sonno della Casa di Cura “Villa Serena” di Città Sant’Angelo, Pescara
3Istituto Stomatologico Italiano, Milano, Reparti di Gnatologia e Gnatologia Neuromuscolare
4Istituto Stomatologico Italiano, Milano, Reparto Chirurgia Maxillo Facciale
5Università di Cagliari, Scuola di Specializzazione in Ortognatodonzia, Direttore Prof. V.Piras
Riassunto
Nell’ambito della Medicina del Sonno, il russamento e la OSA (Sindrome da Apnea Ostruttiva) sono patologie che, per quanto riguarda la diagnosi e il trattamento, interessano l’Odontoiatria. Mentre il russamento semplice, a parte il disturbo del partner di sonno, non implica seri problemi per la salute, la OSA, soprattutto nelle forme medie e gravi, oltre a compromettere la salute generale aumenta notevolmente il rischio di malattia cardiovascolare e causa sonnolenza diurna, con conseguente maggior probabilità di incorrere in incidenti della strada e del lavoro. La diagnosi si serve dell’anamnesi, dell’esame clinico, della sleep endoscopy e della polisonnografia; attualmente sono in commercio polisonnigrafi semplificati, poco costosi e di facile uso, che possono essere utilizzati anche dagli odontoiatri per lo screening dei pazienti e per la valutazione dell’efficacia delle terapie. E’ sempre indispensabile, comunque, la collaborazione con un Centro del Sonno. La terapia si avvale di apparecchi orali di avanzamento mandibolare; essi sono riconosciuti dalle linee guida della letteratura efficaci, almeno quanto la CPAP, nel russamento e nella OSA lieve e media; nelle forme gravi sono alternative alla CPAP quando questa non può essere utilizzata. Nella monografia, dopo una prima parte generale sul sonno e i suoi disturbi vengono spiegate le linee guida, basate sulle evidenze scientifiche, circa l’uso delle apparecchiature orali; in seguito si specificano le procedure cliniche pratiche e viene esposto un caso clinico.
Summary
The role of the orthodontist in the diagnosis and treatment of snoring and
obstructive sleep apnea (OSA)
Dentistry is directly involved in the diagnosis and treatment of Sleep Related Breathing Disorders such as snoring and Obstructive Sleep Apnea (OSA). Usually the primary snoring doesn’t cause any serious health problem to the subject, but OSA has been linked to serious adverse health consequences such as cardiovascular disease and motor vehicle accidents. The diagnosis is done by history taking, clinical exam, polysomnography and sleep endoscopy. There are some simple sleep-screening tool that could be used to identify patients at risk for OSA and during the titration of the oral appliance (OA), but the dentist should work together with a sleep center. According to the international guidelines OA therapy is indicated for patients with primary snoring, mild/moderate OSA and for patients with severe OSA who cannot tolerate CPAP. The aim of this review is to summarize current evidence about the treatment of snoring and OSA with OA therapy. Also, the clinical procedure for the fabrication and delivery of OA and a case-report will be exposed and discussed.
La Medicina ha ormai da anni sviluppato quella branca, denominata “Medicina del Sonno”, che ha lo scopo di studiare le procedure diagnostiche e terapeutiche relative ai disturbi del sonno.
L’inizio dell’Ipnologia come scienza si può far risalire al 1937, quando A. Loomis, dopo che H. Berger nel 1929 aveva registrato i primi tracciati elettroencefalografici, descrisse dettagliatamente il pattern EEG del sonno, proponendone per primo quella suddivisione ancora oggi seguita.
L’inizio dell’“Odontoiatra del Sonno” si deve invece far risalire idealmente a quando Pierre Robin (1867-1950), agli inizi del secolo scorso, utilizzò per primo il monoblocco per l’avanzamento delle mandibola e il condizionamento dei tessuti molli circostanti.
Attualmente, le apparecchiature orali di avanzamento mandibolare (MAD) sono diventate, come vedremo, sofisticate e performanti, ben accettate dai pazienti e, soprattutto nel russamento o nei casi di OSAS (Obstructive Sleep Apnea Sindrome) lievi e medie, sono considerate dalle linee guida trattamenti di prima scelta, in alternativa alla CPAP, che comunque è ritenuta ancora dai medici del Sonno come il trattamento principe. In Italia ci sono circa quaranta Centri di Medicina del Sonno riconosciuti dalla A.I.M.S. (Associazione Italiana Medicina del Sonno) e molti altri ne stanno nascendo, facendo prevedere uno sviluppo di questa branca della Medicina nel futuro immediato.
Questa situazione sicuramente crea una prospettiva culturale e professionale anche per gli odontoiatri. I Centri del Sonno studiano e curano i disturbi del sonno; utilizzano a scopo diagnostico, oltre ai dati anamnestici e clinici relativi al paziente, anche il polisonnigrafo, uno strumento che rileva e registra, mentre il paziente dorme, varie attività fisiologiche dell’organismo.
I polisonnigrafi maggiormente utilizzati dispongono di sette canali per registrare altrettante attività:
- onde cerebrali (EEG);
- movimenti oculari (EOG);
- movimenti delle gambe e dei muscoli masticatori (EMG);
- attività cardiaca (ECG);
- flusso di aria dalle vie aeree superiori (Thermistor, C02);
- movimenti del torace e dell’addome;
- saturazione di ossigeno (pulso-ossimetria).
Attualmente sono in commercio anche polisonnigrafi meno sofisticati, consigliati soprattutto come apparecchi di screening, dotati di pochi canali e quindi meno costosi e più maneggevoli (Figura 1).
Alcuni di questi strumenti, validati dalla letteratura (Milton K. e coll., 2007), sono sempre più utilizzati dagli odontoiatri che si occupano di disturbi del sonno per una valutazione iniziale del paziente. “Le linee guida consigliano comunque di avvalersi sempre della collaborazione di Centri del Sonno specializzati per la valutazione diagnostica e clinica (Linee guida di procedura diagnostica nella sindrome delle apnee ostruttive nel sonno dell’adulto”, AIMS-AIPO, 2001).
L’utilizzo di questi strumenti semplificati andrebbe pertanto riservato a una valutazione preliminare del paziente e al controllo nel tempo dell’efficacia delle apparecchiature orali applicate dall’odontoiatra nei pazienti apneici, come vedremo. Anche i Centri del Sonno dovrebbero avvalersi della collaborazione di odontoiatri esperti ai quali inviare i pazienti quando si presuma la necessità di un trattamento con apparecchiature orali.
In quest’ottica di duplice collaborazione si prevedono nel futuro immediato, come è già stato detto, grosse possibilità di opportunità professionale per gli odontoiatri.
In realtà parliamo di odontoiatri in generale, ma appare sempre più evidente che per le metodiche diagnostiche, come per esempio la cefalometria, e terapeutiche, come per esempio gli apparecchi di avanzamento mandibolare, tali competenze dovrebbero essere affidate all’ortodontista.
Il sonno
Il sonno rappresenta circa un terzo della vita umana; le sue numerose funzioni includono il mantenimento del metabolismo del cervello, il riposo del sistema cardiovascolare e il bilanciamento del metabolismo del glucosio.
È un processo attivo che segue dei meccanismi propri ed evidenzia la sequenza di differenti stadi, correlati con le funzioni del Sistema Nervoso Autonomo.
La durata del sonno varia fra 5 e 10 ore e dipende da fattori genetici e ambientali; i farmaci e le malattie possono alterare la sonnolenza e la vigilanza.
Secondo le conoscenze attuali, chi dorme meno di 5 ore al giorno ha un aumentato rischio per ipertensione arteriosa. Secondo D. Spiegel (1999) più si dorme meno si invecchia.
La struttura del sonno di ciascun individuo è determinata geneticamente, tanto è vero che i gemelli monozigoti si comportano in modo identico nei ritmi sonno-veglia.
Il sonno ha una struttura con andamento ciclico nella quale si alternano fasi NREM (Non Rapid Eye Movement) a fasi REM (Rapid Eye Movement).
In una normale notte di sonno si hanno da quattro a sei cicli, cioè alternanze di fasi NREM e REM. Per ulteriori approfondimenti sulla fisiologia del sonno si rimanda alla consultazione di testi specialistici.
I medici del sonno affermano, sintetizzando, che:
- nel sonno NREM si ha un cervello tranquillo in un corpo riposato;
- nel sonno REM si ha un cervello attivo in un corpo paralizzato.
Classificazione dei disturbi del sonno
Numerose sono le patologie del sonno, che possono distinguersi in dissonnie e parasonnie. La Classificazione internazionale dei disturbi del sonno (ICSD 2005) ne raggruppa tantissime (oltre 90). Le principali sono riassunte nella Tabella 1.

All’odontoiatra interessano, dal punto di vista diagnostico e terapeutico, le seguenti patologie:
- disturbi motori del sonno (bruxismo notturno);
- disturbi respiratori del sonno (roncopatia e OSAS).
In questa trattazione ci occuperemo di questi ultimi.
Disturbi respiratori del sonno
La Sindrome delle Apnee Ostruttive del Sonno (OSA) e il russamento abituale - che della OSA può rappresentare la fase iniziale, come malattia ingravescente nel tempo, o il sintomo clinicamente più rilevante, in fase conclamata - costituiscono un problema sia medico che sociale di crescente rilevanza nella popolazione. Lo spettro dei disturbi respiratori del sonno è riassunto nella Tabella 2.
Il russamento è dovuto alla vibrazione dei tessuti molli (palato molle, uvula, pilastri tonsillari posteriori) dell’area oro-faringea al passaggio dell’aria in ispirazione.
Il russamento può essere presente nell’adulto e nel bambino; in quest’ultimo, in genere, è dovuto alla presenza di ipertrofia di tonsille e adenoidi. Inoltre, è tre volte più comune nelle persone obese. Il russamento è molto diffuso (interessa il 40% circa della popolazione, con prevalenza maggiore nel maschio) e può provocare problemi nella vita di relazione, soprattutto con i partner nel sonno. Spesso è proprio quest’ultimo a richiedere un trattamento del russamento.
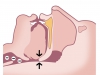
Il russamento non è ancora associato con problemi particolari per la salute, ed è uno dei più comuni sintomi di OSA (70-95% dei pazienti). Non è specifico delle OSA, ma i russatori hanno maggiore possibilità di soffrirne. L’ipopnea è caratterizzata da un’ostruzione parziale delle vie aeree con riduzione del flusso del 50% circa (Figura 2).
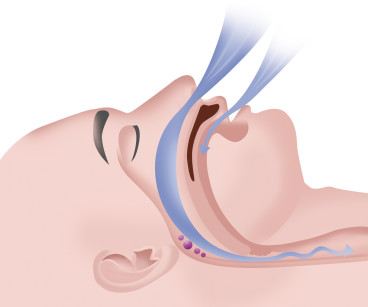
La UARS (Upper Airway Resistence Sindrome) è comune nel bambino, può interessare l’ortodontista ma, essendo un argomento peculiare, non fa parte di questa trattazione.
La OSA (Obstructive Sleep Apnea) o OSAS (Obstructive Sleep Apnea Sindrome) è caratterizzata da ripetuti arresti del respiro durante il sonno. Per episodio di apnea si intende un’interruzione del respiro di almeno 10”.
L’ OSA può essere:
- di origine centrale, dovuta a un’interruzione della stimolazione nervosa dei muscoli respiratori;
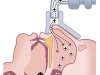
- di origine periferica dovuta a un’ostruzione di tipo meccanico a causa di modifiche dei muscoli durante il sonno (Figura 3).
-
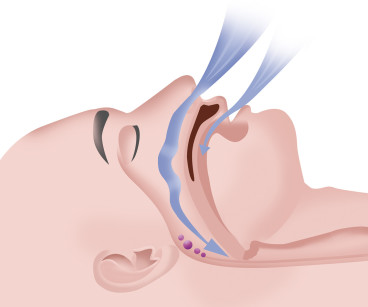
3. Quando si determina un’ostruzione completa delle vie aeree il flusso di aria si interrompe per un certo periodo di tempo e si ha un’apnea.
Di seguito, parlando di OSA ci riferiamo a quest’ultima categoria. La OSA è caratterizzata da ripetuti episodi di parziale o totale ostruzione delle vie aeree superiori associati a cadute dell’ossiemia con conseguenti desaturazioni dell’emoglobina arteriosa.
I ripetuti episodi di ipopnea e apnea causano uno sforzo respiratorio notturno con conseguenti modificazioni della frequenza cardiaca, aumento dei valori della pressione arteriosa, compromissione dell’ossigenazione del sangue e frammentazione del sonno. Recentemente è entrata nell’utilizzo diagnostico la Sleep Endoscopy, che consiste nel verificare endoscopicamente il luogo nel quale avviene l’ostruzione, totale o parziale, delle vie aeree mentre il paziente è addormentato farmacologicamente.
Durante l’esame l’operatore ha la possibilità, eseguendo manualmente un avanzamento mandibolare, di valutare se tale manovra, che simula il meccanismo degli apparecchi orali, elimina l’ostruzione meccanica. La OSA si distingue dal punto di vista clinico in:
- fisiologica: 0-5 (o 10) AHI (Apnea Hypopnea Index);
- lieve: 5 (o 10)-20 AHI;
- media: 20-30 (o 40) AHI;
- grave (severa): +30 (o 40) AHI.
Per AHI (Apnea Hypopnea Index) si intende la somma di ipopnee e apnee per ora di sonno.
Epidemiologia
Secondo Lugaresi (M. Lugaresi, 2008) l’OSA interessa il 25% dei maschi e il 15% delle femmine nella popolazione generale; il dato sale rispettivamente al 60 e al 40% nella popolazione da 41 a 65 anni. Nella fascia di età da 30 a 59 anni coinvolge il 34% della popolazione non obesa e il 60% di quella obesa. Dal punto di vita eziologico riconosciamo dei fattori causali fra i quali possiamo distinguere:
- fattori anatomici, come obesità, deviazione del setto, ipertrofia adenotonsillare, micro-retrognazia;
- fattori funzionali quali ipotonia dei muscoli orofaringei, caduta posteriore della lingua, fumo, alcool.
Dal punto di vista fisiopatologico riconosciamo:
- rumore;
- apnea;
- asfissia (alterazioni respiratorie);
- ipossia e ipercapnia (alterazioni circolatorie);
- interessamento dei centri bulbari (alterazioni cardiache);
- risveglio, inconsapevole stato di veglia, sonno (alterazioni del sonno).
La sintomatologia è caratterizzata da:
- disturbi dello stato di sonno;
- disturbi dello stato di veglia;
- cefalea mattutina;
- irritabilità;
- sonnolenza diurna.
Quest’ultimo sintomo, valutabile mediante la somministrazione di alcuni test fra i quali il più utilizzato è la Scala di Epworth (Figura 4), compromette la qualità della vita dell’individuo e, soprattutto, aumenta drasticamente il rischio di incorrere in incidenti della strada dovuti ai cosiddetti “colpi di sonno”. Esiste un aumentato rischio di malattia cardiovascolare, che diventa elevatissimo nei pazienti con OSA severe.

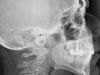
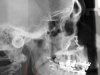
La diagnosi è anamnestica, clinica e polisonnografica. Nonostante alcuni dubbi recenti, è ancora considerata importante la diagnosi cefalometrica sulla teleradiografia latero-laterale che valuta la lunghezza dello spazio aereo posteriore (PAS); questi, viene misurato attraverso una linea tangente il bordo inferiore della mandibola che attraversa le vie aeree: nella norma dovrebbe essere superiore a 9 mm. I dubbi sono dovuti al fatto che la riduzione dello spazio aereo-faringeo sia più importante in senso trasversale che in senso sagittale. Comunque, la cefalometria è ancora considerata un record diagnostico importante e in quest’ottica è evidente il ruolo fondamentale svolto dall’ortodontista. Oltre allo specialista del sonno sono interessati:
- otorinolaringoiatra;
- cardiologo;
- neurologo;
- pneumologo;
- odontoiatra (ortodontista).
La terapia è:
- conservativa: perdita di peso, controllo dell’uso di alcool, controllo delle posizioni del sonno;
- meccanica: CPAP;
- chirurgica: palatoplastica, tonsillectomia e adenoidectomia, osteotomia avanzamento bi mascellare;
- medica: decongestionanti;
- odontoiatrica: apparecchiature orali (MAD).
La CPAP (Continuos Positive Airway Pressure) consiste in un apparecchio che durante la notte, tramite una mascherina, mantiene una pressione positiva nelle vie aeree, tale da non consentire il collassamento dei tessuti molli (Figure 5a e 5b).
Secondo le revisioni della letteratura è il trattamento più efficace, anche delle apparecchiature orali, nel ridurre i sintomi e migliorare la qualità della vita nei pazienti con OSAS medie e gravi; però non tutti i soggetti tollerano la CPAP, che è considerata il gold standard nel trattamento della OSAS.
Fra le terapie che interessano l’ortodontista è da considerare la chirurgia maxillo-facciale di avanzamento bimascellare (Figure 6a-6f).
Essa agisce portando in avanti, insieme alle basi ossee, il palato molle e la base della lingua. Esistono nella letteratura evidenze che supportano l’uso della chirurgia nel trattamento delle OSA; si rimanda per un ulteriore approfondimento ai testi specialistici. Quando l’intervento è efficace, il paziente non dipende più da apparecchiature extra o intra orali. Il ruolo dell’ortodontista può essere fondamentale nella collaborazione con il chirurgo maxillo-facciale per la riuscita del trattamento.
Le apparecchiature orali agiscono riposizionando e mantenendo la mandibola e la lingua in posizione anteriore, aumentano il volume delle vie aeree e diminuiscono la resistenza al flusso aereo; inoltre, accrescono il tono dei muscoli.
Le indicazioni delle apparecchiature orali sono:
- russamento primario;
- OSA lievi o medie:
- quando il paziente le preferisce alla CPAP,
- quando il paziente non risponde alla CPAP,
- quando ci sono controindicazioni alla CPAP;
- OSA severe, quando è fallito il trial iniziale con la CPAP.
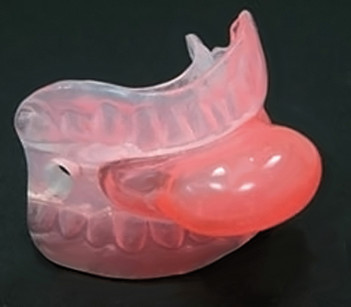
Alcuni dati della letteratura recente indicano che comunque nelle OSA lievi o medie il trattamento con apparecchiature orali può essere considerato la prima scelta (Hoekema, 2008). Esistono numerosissimi tipi di apparecchiature orali in commercio. La FDA ne ha approvati circa 30 per il trattamento delle OSA. I due tipi base sono:
- i riposizionatori mandibolari, che possono essere associati alla CPAP con un connettore;
- i ritentori della lingua (non approvati dalla FDA per OSA) (Figura 7).
I riposizionatori mandibolari posizionano e mantengono la mandibola e la lingua in posizione avanzata (Figure 8, 9,10,11a e11b).

Di seguito verranno specificate le linee guida e le procedure cliniche relative all’utilizzo di quest’ultimo tipo di dispositivi.
Linee guida per l’utilizzo dei MAD nel russamento e nelle OSA
I primi lavori pubblicati sull’utilizzo di dispositivi orali per il trattamento non chirurgico delle OSAS sono piuttosto recenti: il primo, riguardante il tongue-retainer, è stato pubblicato da Cartwright e Samelson solo nel 1982. Questo nuovo spunto professionale attirò l’attenzione e le pubblicazioni riguardanti l’uso dei dispositivi orali crebbero rapidamente di numero.
Nel 1995 l’allora American Sleep Disorders Association (oggi American Academy of Sleep Medicine, AASM) produsse le prime linee guida all’uso dei dispositivi orali da utilizzarsi nel trattamento di russamento e apnee notturne: purtroppo la ricerca effettuata per produrre tali linee guida aveva alcune limitazioni legate alla tipologia di articoli presenti (tutti del V livello di evidenza scientifica) e del breve follow up.
Nel 2002, a fronte di un ulteriore incremento di pubblicazioni, sia nel numero che nella qualità dei trials clinici, la AASM creò una task force per aggiornare le precedenti linee guida, selezionando un totale di 87 lavori, di cui 15 trial clinici randomizzati e controllati di livello I e II. Gli obiettivi di tale review erano fondamentalmente di individuare qual è l’efficacia degli Oral Appliance (OA) nel breve e lungo termine, attraverso quale meccanismo agiscono, la compliance del paziente nell’utilizzo di tali dispositivi, le performance degli OA rispetto alla CPAP, alla chirurgia dei tessuti duri e molli e, infine, quali sono i migliori dispositivi utilizzabili.
L’imponente review uscì su Sleep nel 2006 e decretò l’affidabilità degli OA nell’utilizzo sui pazienti apneici di lieve e moderata gravità che non tolleravano la CPAP, gold standard terapeutico, nei quali non era indicata o per i quali il trattamento con la CPAP o con le misure comportamentali aveva esitato in un fallimento.
Efficacia dei MAD
Prima di leggere e discutere i risultati di questa review è fondamentale ricordare che i dispositivi di avanzamento mandibolare (MAD) usati sono di diverso genere, sia fissi che regolabili, e che i pazienti presentavano un diverso grado di severità della OSAS.
I criteri utilizzati per valutare l’effettivo miglioramento possono essere di due tipi:
- polisonnografico: i più restrittivi pongono il cut-off del successo a AHI<5, ossia completa guarigione, altri a AHI<10; i meno restrittivi si pongono come risposta positiva una diminuzione di almeno il 50% dell’AHI. Altri parametri sono legati alla saturazione d’ossigeno o alla pressione arteriosa;
- clinico: il grado di sonnolenza diurna, le performance psico-fisiche e l’aderenza al trattamento.
Pertanto valutare questi lavori non è stato semplice a causa delle diverse definizioni di “successo” e dei differenti parametri da valutare.
Sintetizzando i risultati della review citata, tra i numerosi valutati, ben otto studi con i MAD che si ponevano come obiettivo AHI<5 hanno avuto il 42% di successo; in 30 studi che si ponevano un AHI<10 il successo medio è stato del 52%. Dieci studi che invece avevano criteri meno restrittivi (riduzione >50% dell’AHI iniziale) hanno ottenuto un successo medio del 65%. Nove lavori hanno distinto questi miglioramenti dividendo i pazienti secondo le tre classi di severità dell’OSAS, rivelando che le possibilità di successo terapeutico sono più ristrette nei pazienti con OSAS grave (AHI>30 o >40, a seconda dei criteri usati in ciascuno studio), con percentuali di successo che oscillano tra il 14 e il 61%, mentre sono maggiori in pazienti con AHI iniziale inferiori, con miglioramenti tra il 57 e l’81%.
Numerosi studi controllati, anche successivi a tale review, sono stati eseguiti per valutare le differenze di efficacia tra MAD e CPAP: dati estrapolati dal lavoro di Marklund del 2011 mostrano come i MAD danno una riduzione dell’AHI da 4.5 a 34 eventi/h, che corrisponde a una diminuzione della frequenza dei disturbi respiratori che oscilla dal 28 all’80%. La CPAP, invece, riduce l’AHI da 18 a 40 eventi/h, fino a raggiungere valori compresi tra 2,4 e 8,0, producendo una riduzione compresa tra 74 e 94%.
Le linee guida raccomandano pertanto l’uso dei MAD ai pazienti con OSA di grado lieve-moderato, nonostante possano essere leggermente meno performanti della CPAP, in quanto sono meglio tollerati, come vedremo successivamente. I pazienti con OSA più severe dovrebbero invece valutare altre strategie terapeutiche e affidarsi ai MAD solo quando queste sono fallite.
Non si può però dimenticare che dal 2006 a oggi il design dei dispositivi orali è diventato più performante e ulteriori studi sono stati effettuati. Analizzando gli altri parametri polisonnografici, come ad esempio il nadir di O2, la saturazione di ossigeno più bassa raggiunta durante un’apnea, alcuni studi indicano un miglioramento con ii MAD che oscilla tra 1 e 11%, nonostante questi rilevamenti non siano stati sempre statisticamente significativi.
Infine, riportiamo l’unico studio randomizzato, di Wilhelmsson del 1999, e successivi report, che paragona i MAD alla chirurgia delle vie aeree superiori su un campione di 95 pazienti. A un anno di follow up l’AHI<5 è raggiunto dal 78% dei pazienti con il MAD contro il 51% dei pazienti sottoposti alla chirurgia, raggiungendo a 4 anni un divario notevole: 62% vs 25%.
Quanto detto finora chiaramente è legato strettamente ai risultati polisonnografici. In realtà, esattamente come per altre patologie, l’obiettivo da raggiungere non consiste solamente in miglioramenti strumentali ma anche clinici, indagando il grado di sonnolenza, la compliance, l’insorgenza di effetti collaterali eccetera, che nel complesso sono quelli maggiormente percepiti soggettivamente dal paziente.
Per quanto riguarda i parametri relativi alla sonnolenza diurna questi si dividono in soggettivi e oggettivi. I primi vengono valutati attraverso il questionario di Epworth ed è possibile che siano soggetti all’effetto placebo, nonostante i miglioramenti ben documentati. La review di Hoffstein del 2007 compara i risultati della ESS di 19 studi con un totale di 854 pazienti: da un punteggio medio di 11.2 si è passati a 7.8 grazie all’utilizzo dei MAD.
Uno studio di Engelman, pubblicato nel 2002 che comprendeva un ampio numero di test funzionali, ha dimostrato la superiorità della CPAP su 7 delle 21 variabili analizzate, mentre per le restanti 14 le differenze non erano significative, tra le quali la preferenza di trattamento, i test di resistenza al sonno e le performance cognitive. Ci sono anche studi che confrontano MAD e dispositivi placebo su outcome clinici e non polisonnografici: i risultati poco chiari fanni ipotizzare una possibile componente di effetto placebo nell’efficacia dei MAD.
Gli effetti sulle funzioni quotidiane di fatto sono stati studiati più con la CPAP che con i MAD e molto è ancora da fare in questo campo, come per esempio i test sul simulatore di guida. Miglioramenti, anche se piccoli, si sono ottenuti anche nelle capacità cognitive, spesso deteriorate dalle apnee, e i risultati anche in questo caso sono molto simili rispetto a quelli ottenuti con la CPAP.
Anche per quanto riguarda il rischio cardiovascolare c’è ancora molto da chiarire e da approfondire in quanto finora sono davvero pochi i lavori eseguiti che esaminano gli effetti dei MAD sulla pressione sanguigna.
In ogni caso sembra che i MAD abbiano un buon impatto sullo stress ossidativo e sulla funzione endoteliale. Inoltre, due studi placebo-controlled e randomizzati mostrano una riduzione, seppur modesta, della pressione sanguigna da 2 a 4 mm Hg dopo un periodo di trattamento con il MAD che andava da 1 a 3 mesi.
È chiaro che l’efficacia complessiva del trattamento necessita di un uso regolare e prolungato del dispositivo scelto, ossia l’aderenza al trattamento, e questo è forse il maggiore punto di forza dei MAD. Le piccole dimensioni, la facilità di utilizzo, l’indipendenza da una sorgente elettrica rendono i MAD preferibili rispetto alla CPAP. Dati estrapolati da questionari di gradimento riportano un’aderenza media del 77% a un anno di trattamento e del 76% a due anni, con un range che oscilla, a seconda degli studi, dal 55% al 93%. L’aderenza sembra comunque diminuire con l’allungarsi della durata del trattamento. Inoltre, pare che la maggioranza dei pazienti indossi il dispositivo tutte le notti (68%), il 23% buona parte delle notti a settimana mentre l’8% poche notti a settimana. Ulteriori dati mostrano che i pazienti utilizzano il MAD per una media di 6.8 ore per notte (range 5.6-7.5). Confrontando i dati relativi all’uso della CPAP emerge come solamente il 46% dei pazienti che utilizza tale dispositivo riesca a utilizzarlo per più di 4 ore per notte durante almeno il 70% di notti. Riassumendo e incrociando tutti i dati a disposizione su questo argomento emerge che su un totale di 3107 pazienti, a 33 mesi dall’utilizzo del MAD, il 56-68% continua a usarlo. McGown ha pubblicato nel 2001 i risultati di un questionario di autovalutazione: su 41 pazienti che avevano usato sia CPAP che MAD, il 71% preferiva il MAD, il 19% la CPAP e il 10% era incerto. Emerge inoltre chiaramente come lo sviluppo di design confortevoli sia uno spunto fondamentale sul quale le aziende del settore devono concentrare la loro attenzione. Detto questo, la compliance rimane un argomento molto delicato: spesso i pazienti a cui viene proposto il MAD sono soggetti con apnee moderate e che presentano sintomi ridotti durante il giorno e la cui richiesta è invece smettere di russare per non disturbare il proprio partner. È possibile quindi l’abbandono dell’uso del dispositivo a seguito dell’interruzione della relazione con il partner o se questo smette di lamentarsi per il russamento. In ogni caso i partner di letto sembrano gradire l’uso dei MAD, con un 82% di soddisfazione della terapia nello studio di De Almeida del 2005. Numerosi lavori focalizzano l’attenzione anche sui meccanismi di azione dei MAD e sugli effetti indesiderati a breve e a lungo termine, ma questi saranno oggetto di successiva analisi.
MAD e russamento
Il meccanismo che porta alle apnee è chiaramente lo stesso, seppur in misura ridotta, che causa il russamento. Nonostante la diagnosi di russamento sia piuttosto semplice, misurare in modo quantitativo e qualitativo tale patologia si è rivelato piuttosto complesso. I parametri che possono essere presi in considerazione sono principalmente le caratteristiche del suono emesso (intensità e frequenza dello spettro) e la relazione con l’atto respiratorio. Nonostante questo la gravità del russamento è legata, di fatto, a chi sta ascoltando e soprattutto è costretto ad ascoltare tale rumore ogni notte; al contrario, le apnee e le ipopnee sono indipendenti da qualsiasi soggettività. Questo spiega come mai la registrazione dell’intensità e della frequenza del russamento fa così raramente parte della routine polisonnografica. In ogni caso non si può dimenticare come il russamento sia in molti casi il sintomo iniziale che il paziente vuole risolvere, essendo magari ignaro della presenza delle apnee; è importante intervenire anche se la polisonnografia ha posto diagnosi di russamento semplice, senza quindi la presenza di ipopnee, apnee e sonnolenza diurna. I pazienti che presentano questo quadro di solito mal tollerano la CPAP, nonostante siano disposti a provarla, poiché troppo intrusiva e disagevole da usare. Questi soggetti vanno comunque trattati. È chiaro che il trattamento non può prescindere dalla riduzione di peso, dalla limitazione di alcool, tabacco e altre sostanze eccitanti ma il MAD può costituire una brillante terapia, visto che peraltro in origine i MAD erano stati ideati proprio per il trattamento del russamento invece che delle apnee. Uno studio di Bates del 2006 che indagava il grado di soddisfazione del paziente e del partner di letto indica che il 70% di entrambi riferisce un miglioramento. Nonostante sia molto difficile confrontare i risultati ottenuti da diversi e disomogenei studi randomizzati e controllati pubblicati in merito, a causa della diversità di obiettivi che ogni studio si era preposto, è possibile sintetizzare che la maggior parte dei pazienti ottiene un miglioramento, sia che venga misurato soggettivamente che oggettivamente e che tale risultato si attesta intorno al 45%, nonostante il russamento non cessi del tutto.
Meccanismi d’azione
Molto è stato scritto sul meccanismo d’azione dei MAD. Posto che l’ostruzione delle vie aeree superiori può essere a qualsiasi livello, uno dei punti più frequenti è alla base della lingua o dietro al palato molle. I motivi possono dividersi in anatomici (ristrette dimensioni dei passaggi d’aria) o fisiologici (aumentata collassabilità delle vie aeree dovuta a una carenza di controllo neuromuscolare centrale), ma nella maggior parte dei casi si tratta di una combinazione dei due fattori. Numerosi studi con differenti tecniche di imaging mostrano il meccanismo d’azione dei MAD che, avanzando la mandibola, allargano lo spazio retro linguale e retro palatale, soprattutto in senso latero-laterale, prevenendone la collassabilità. Un miglioramento è presente in molti pazienti, anche se non in tutti, anche nella componente postero-anteriore, che può essere visibile dalla cefalometria misurando il PAS, il Posterior Airway Space. La cefalometria ha mostrato anche un abbassamento della postura linguale e la riduzione della distanza tra il piano mandibolare e l’osso ioide. Esiste anche un esiguo numero di studi che mostra un incremento del tono elettromiografico del muscolo genioglosso, suggerendo un suo ruolo nel mantenimento del calibro delle vie aeree orofaringee. Gli intricati equilibri dei muscoli che regolano il calibro delle vie aeree non sono sempre prevedibili: in alcuni casi, infatti, l’avanzamento mandibolare può persino peggiorare l’ostruzione così come in altri, soprattutto quando il livello di ostruzione è più basso, non influire sulla collassabilità.
La centralità dell’avanzamento mandibolare come meccanismo d’azione è comprovata in un numero di studi controllati con placebo, sottili mascherine termo stampate che non avevano alcun effetto sull’AHI. Numerosi studi confermano come il grado di protrusione mandibolare sia direttamente proporzionale con il miglioramento di eventi respiratori notturni. Uno studio di Walker-Engstrom confronta i risultati con due dispositivi, uno tarato sul 50% di protrusione e l’altro sul 75%, ottenendo rispettivamente il 31% e il 52% di pazienti che raggiungevano un AHI inferiore a 10. Uno studio recente che ha valutato l’effetto dell’aumento della verticale con sleep endoscopy a livello delle vie aeree, ha evidenziato che per molti pazienti questo aumento ha un effetto negativo accrescendo la probabilità di ostruzione (Vroegop, Vanderveken et al., 2012).
Fattori predittivi
Nonostante l’indiscutibile efficacia dei MAD, rimane una percentuale di pazienti che non rispondono al trattamento e ai quali non andrebbe proposto, oltre a quei pazienti, circa il 35%, per i quali i MAD sono comunque controindicati (patologie parodontali gravi, numero insufficiente di denti presenti in arcata, problematiche temporo-mandibolari). Uno degli sforzi della ricerca clinica dovrebbe essere pertanto indirizzato a identificare quei fattori che possono essere predittivi di un trattamento soddisfacente e facilitare così la selezione del paziente per il quale questi è indicato. Finora sembrano rispondere meglio le pazienti di sesso femminile, giovani, con un BMI (Body Mass Index) più basso, con una circonferenza del collo minore, con un AHI <30 e soggette ad apnee posizionali e con il collasso del tratto oro-faringeo. Nella valutazione che precede la decisione terapeutica può essere indicata una teleradiografia del cranio in proiezione latero-laterale: pazienti con uno spazio aereo posteriore <9 mm, con la maxilla più lunga, un minore overjet, un palato molle piuttosto corto e una distanza ridotta tra piano mandibolare e osso ioide sembrerebbero avere maggiori possibilità di successo. Anche chi presenta una minore resistenza dei flussi respiratori nasali sembra essere favorito nel successo terapeutico. Altre indicazioni possono essere ottenute durante la polisonnografia, che ci dà la possibilità di associare gli eventi respiratori alla posizione assunta durante il sonno. Il concentrarsi di tali eventi durante la posizione supina, invece che durante il decubito laterale, dà il nome alle cosiddette apnee “posizionali”. I MAD, impedendo la retrusione mandibolare legata alla forza di gravità e al tono muscolare, sono particolarmente performanti proprio in presenza di apnee posizionali.
Inoltre, i MAD hanno minori possibilità di successo in pazienti con un alto Body Mass Index (BMI), nonostante questo dato non sia confermato in tutti i lavori. Inoltre, pare esserci una correlazione tra BMI e posizionalità: più è alto il BMI meno ci saranno differenze nella severità delle apnee a seconda della posizione di decubito. L’aumento di peso, infine, può ridurre l’efficacia del MAD.
Esistono anche alcune manovre diagnostiche che permettono di identificare la sede dell’ostruzione e di simulare il dispositivo di avanzamento mandibolare. Una versione può essere condotta durante un’indagine di risonanza magnetica nucleare eseguendo la manovra di Muller, un’espirazione forzata con naso e bocca chiusa. La presenza di collasso delle vie aeree superiori eseguendo la manovra con la mandibola protrusa è associata, secondo uno studio di Sanner del 2002, al fallimento della terapia con MAD. Un’alternativa valida può essere effettuata addormentando il paziente in sala operatoria ed eseguendo una fibroscopia naso-faringea per valutare il livello di ostruzione in condizioni basali. Attraverso la manovra del “pull up” mandibolare è possibile simulare l’avanzamento mandibolare e valutarne gli effetti sulla collassabilità delle vie aeree.
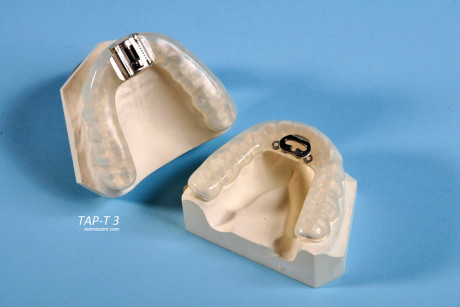
MAD a protrusione fissa vs MAD a protrusione variabile
In commercio esistono numerosi dispositivi tra i quali il dentista che si occupa di Medicina del Sonno può scegliere ed è pertanto importante per lui conoscerli e saper prescrivere per ciascun paziente quello più performante per la sua tipologia di apnea.
Finora non si è quasi parlato del tongue-retainer, in quanto si tratta di un dispositivo che non viene quasi più indicato o utilizzato a causa della scomodità d’uso e della minore efficacia rispetto ad altri. Per quanto riguarda i mandibular advancement device sono disponibili due tipologie: a protrusione fissa e a protrusione variabile. Entrambi i dispositivi sono personalizzati sulle arcate dentarie del paziente, ma i primi hanno il vantaggio di un costo minore, una maggiore velocità della terapia e una maggiore semplicità di utilizzo, nonostante l’impossibilità di modificare il grado di avanzamento una volta realizzato il dispositivo; i secondi, al contrario, sono gravati da un costo maggiore, ma permettono l’aggiustamento del grado di protrusione successivamente alla consegna del dispositivo, rivelandosi così più efficaci. Riportiamo di seguito i risultati di un interessante studio retrospettivo pubblicato da Lettieri et al. nel 2011 che compara i due tipi di dispositivi su un totale di 805 pazienti con diagnosi di OSA e con parametri antropometrici e demografici statisticamente sovrapponibili (età media = 41-43 anni;
sesso maschile = 86%; BMI = 29; ESS = 13-14;
AHI = 30; nadir SpO2 = 83%).
203 pazienti erano stati trattati con MAD a protrusione fissa personalizzati con un range di protrusione compreso tra il 60 e l’80% del massimo avanzamento, a seconda della tollerabilità del singolo paziente. A 602 soggetti era stato invece consegnato un dispositivo ad avanzamento calibrato, il Thornton Adjustable Positioner (TAP), secondo modello. I pazienti seguivano domiciliarmente un protocollo per un graduale aumento dell’avanzamento mandibolare di 0,5 mm per notte, sino a ottenere un buon equilibrio tra tolleranza nella posizione trovata ed effetti benefici, attraverso un diario che teneva conto della sonnolenza e della qualità del sonno. Il grado di protrusione veniva controlla ed eventualmente modificato durante una polisonnografia di taratura.
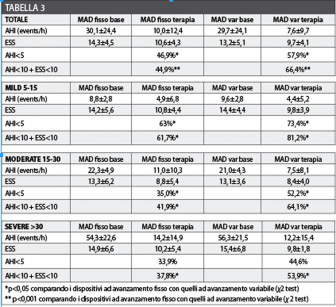
L’endpoint primario dello studio era il raggiungimento di un AHI<5 eventi/ora mentre il secondario era ridurre l’AHI<10 con una ESS<10. I risultati mostrano come entrambi i dispositivi comportano un miglioramento dell’AHI, nonostante i MAD a protrusione variabile siano più efficaci con una significatività statistica nell’outcome primario per i gradi lievi e moderati e nell’outcome secondario per tutti e tre i gradi di severità delle OSA, con p<0,05 (Tabella 3).
Ulteriori dati dello studio mostrano come i portatori di MAD variabili hanno avuto un decremento medio del 74,4% nell’AHI mentre quelli con i MAD fissi del 64,5% (p=0,08). Infine, il miglioramento sembra essere pressoché sovrapponibile in presenza di un AHI di baseline compreso tra 5 e 10. In conclusione, i MAD a protrusione fissa sembrano essere indicabili soltanto in caso di pazienti russatori semplici o in presenza di AHI inferiore a 10.
Utilizzo dei MAD nel russamento e nelle OSA: procedure cliniche
Il protocollo clinico da seguire con i pazienti che devono sottoporsi a eventuale terapia con MAD prevede:
- anamnesi;
- esame clinico;
- impronte e morso di costruzione;
- consegna del MAD;
- visite di controllo.
Anamnesi ed esame clinico
Nella raccolta dei dati anamnestici dobbiamo valutare il grado di severità dell’OSA del paziente (in base al referto del medico del sonno), la presenza di patologie sistemiche ed eventuali trattamenti pregressi per OSA (CPAP, chirurgia ecc.) per decidere se è un buon candidato al trattamento con MAD. Come è gia stato descritto nella parte iniziale di questa monografia, il candidato ideale alla terapia con MAD è affetto da russamento primario e/o OSA di grado lieve o moderato. Il paziente con OSA di grado severo dovrebbe essere trattato con MAD solo se non riesce a tollerare la CPAP. Durante l’esame clinico dobbiamo valutare lo stato di salute di denti, parodonto, tessuti molli, muscoli masticatori e articolazioni temporo-mandibolari. Gli esami radiologici necessari sono OPT e teleradiografia.
Per una buona ritenzione del MAD è importante avere almeno 8-10 elementi parodontalmente sani per arcata con delle corone cliniche non troppo corte. Recentemente è stato introdotto sul mercato un MAD che può essere realizzato anche in pazienti con edentulia totale superiore (Figura 11b). Un’alternativa per i pazienti edentuli è l’utilizzo di un tongue retainer device (TRD) (Figura 7), che con un meccanismo di “suzione” blocca la lingua e la trattiene in posizione avanzata allontanandola dalla parete faringea diminuendo cosi le probabilità di ostruzione delle vie aeree. Secondo alcuni studi i TRD sono efficaci, ma sono poco tollerati dai pazienti. Le ricostruzioni protesiche come ponti e/o corone devono essere cementate definitivamente per ridurre la probabilità di distacco durante la rimozione del MAD.
Per escludere la presenza di disordini temporo-mandibolari, che rappresentano una controindicazione relativa al trattamento con MAD, bisogna eseguire una palpazione dei muscoli masticatori, delle articolazioni temporo-mandibolari, valutare la presenza di rumori articolari, limitazioni funzionali e deviazioni durante il tragitto di apertura e chiusura della bocca. Nella valutazione del range dei movimenti mandibolari, oltre alla distanza interincisale in massima apertura e alle lateralità bisogna considerare anche la massima protrusione. Una limitata protrusione potrebbe ridurre le probabilità di successo della terapia con MAD.
Impronte e morso di costruzione
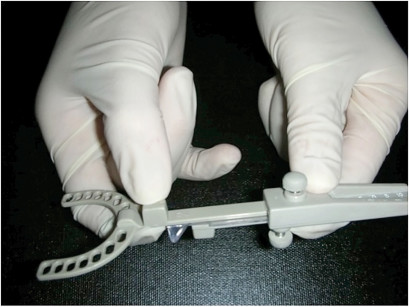
Per la rilevazione delle impronte possiamo utilizzare alginato o PVS. È importante fornire al laboratorio delle impronte di qualità, con buoni dettagli dei denti e dei tessuti circostanti. Per i MAD che presentano il meccanismo di avanzamento palatale (Figura 9) è fondamentale inserire anche il palato duro nell’impronta. Uno strumento utile per la registrazione del morso di costruzione è il George Gauge. Questo strumento consiste di una forchetta monouso per l’arcata superiore, un “morsetto” da adattare agli incisivi inferiori e un corpo dotato di una scala millimetrata per misurare la protrusione del paziente (Figura 12.)
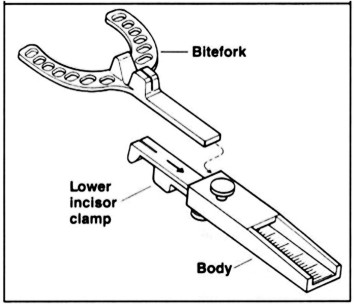
Come prima cosa dobbiamo provare la forchetta monouso sull’arcata superiore e assicurarci che si adatti bene all’anatomia degli incisivi (Figura 13). Dopo dobbiamo adattare il “morsetto” agli incisivi inferiori (Figura14) bloccandolo con la vite inferiore. A questo punto inseriamo la forchetta monouso nel corpo centrale del George Gauge (Figura 15).
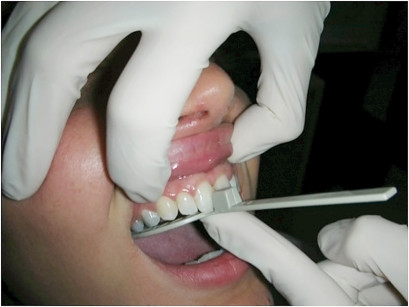
Per la valutazione del range di protrusione del paziente dobbiamo chiedergli di fare movimenti di protrusione e retrusione con il GG inserito in bocca. In base alla capacità di protrusione decidiamo a che valore fare il morso di costruzione da inviare al laboratorio; solitamente viene fatto al 50/70% del range di protrusione (Figura 16).
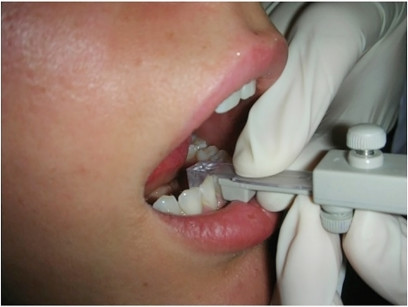
Per la registrazione del morso possiamo usare del “putty” o del PVS per registrazioni occlusali. La forchetta monouso con il morso di costruzione va inviata al laboratorio insieme alle impronte o modelli. Il corpo centrale del George Gauge e il “morsetto” inferiore possono essere sterilizzati a freddo. Le forchette monouso più utilizzate hanno uno spessore interincisale di 5 mm e di conseguenza aumentano la verticale dello stesso valore. In alcuni casi, per necessità cliniche e/o tecniche, potrebbe essere necessario aumentare ulteriormente la dimensione verticale. È stato evidenziato, con studi effettuati in sleep endoscopy, che l’aumento della verticale può avere un effetto negativo a livello delle vie aeree superiori aumentando la probabilità di ostruzione (Vroegop, Vanderveken et al., 2012).
Consegna del MAD
Al momento della consegna al paziente dobbiamo verificare il buon adattamento del MAD ai denti, il contatto uniforme della parte superiore e inferiore (per gli apparecchi che lo prevedono tipo IST/Herbst e Somnodent) e la sua buona ritenzione. Se il paziente avverte dei punti in cui il MAD è “troppo stretto” possiamo ritoccarlo facendo attenzione a non compromettere la ritenzione. È molto importante istruire il paziente su come inserire, rimuovere, pulire e avanzare gradualmente il MAD. Per la prima settimana il soggetto deve usare il MAD senza avanzarlo, poi può muoverlo di 0,5 mm (circa 2 giri di vite) ogni 3/4 giorni fino al raggiungimento della posizione “terapeutica”. Durante la fase di avanzamento si valutano i sintomi soggettivi del paziente (russamento, sonnolenza diurna, cefalea al risveglio ecc.), ma si possono anche utilizzare il questionario di Epworth o strumenti, come l’ApneaLink, per monitorare l’efficacia del MAD.
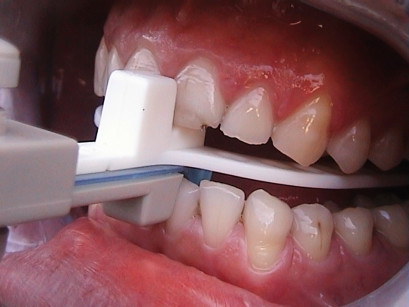
Una volta raggiunta la posizione “terapeutica” possiamo inviare nuovamente il paziente presso il Centro di Medicina del Sonno per un esame di controllo (polisonnografia o monitoraggio ambulatoriale) con il MAD.
Visite di controllo
Durante la fase di avanzamento il paziente deve essere visto ogni 2/4 settimane.
Al termine di questo periodo può essere controllato ogni sei mesi per monitorare la comparsa di eventuali effetti collaterali.
Effetti collaterali
I MAD sono solitamente ben tollerati anche se possono insorgere effetti collaterali che il più delle volte sono lievi e temporanei (de Almeida, Lowe et al., 2005). I più comuni sono: ipersalivazione, dolore muscolare e articolare, mobilità e\o indolenzimento dei denti.
Uno studio recente ha confermato che sintomi di disordini temporo-mandibolari (DTM) possono insorgere nella fase iniziale del trattamento (Doff, Veldhuis et al., 2011), ma tendono a regredire nel tempo e non sono una controindicazione al trattamento. Questi sintomi di DTM, solitamente di natura muscolare, possono essere gestiti con terapia farmacologica breve con FANS, termoterapia con impacchi caldi ed esercizi di stretching. In alcuni casi gli effetti collaterali possono essere tali da portare all’interruzione del trattamento con MAD. Un effetto collaterale meno frequente è quello dei cambiamenti occlusali legati all’utilizzo prolungato del MAD (Otsuka, Almeida et al., 2007). Spesso il paziente riferisce di non poter far toccare i denti posteriori (posterior open bite) al mattino dopo la rimozione del MAD. La causa di questo morso aperto posteriore non è chiara, ma si pensa che sia secondaria a un “accorciamento” dei muscoli pterigoidei laterali e\o all’accumulo di fluido nel compartimento posteriore dell’ATM. Nella maggior parte dei casi questo open bite è temporaneo e il paziente torna alla sua occlusione abituale dopo alcuni minuti. Alcuni esercizi di stretching e di chiusura “forzata”, o l’utilizzo di alcuni dispositivi (AM Aligner), possono accelerare il ritorno all’occlusione abituale. In circa il 10% dei pazienti questi cambiamenti occlusali - retroclinazione degli incisivi superiori, proclinazione degli inferiori,estrusione dei molari, appiattimento della curva di Spee ecc. - sono permanenti (Almeida, Lowe et al., 2006). Alcuni pazienti notano i cambiamenti occlusali solo dopo che sono stati menzionati dal loro dentista; per altri, invece, questi sono fastidiosi e in tal caso può essere necessario un trattamento ortodontico, protesico e\o chirurgico. È molto importante mettere al corrente il paziente della possibilità di sviluppare malocclusioni in seguito all’utilizzo dei MAD e far firmare un consenso informato prima dell’inizio del trattamento. Nei soggetti con occlusione di Classe II, div. 1, questi cambiamenti occlusali possono risultare “positivi” dal punto di vista ortodontico. Bisogna sempre considerare che con i MAD trattiamo una patologia medica importante (OSA) che, se non curata, può causare danni alla salute del paziente (ipertensione arteriosa sistemica, cardiopatia ischemica e scompenso cardiaco, aritmie cardiache, ictus ecc.) con conseguenze molto più gravi di una banale malocclusione.
Caso clinico
Giunge alla nostra osservazione nel luglio del 2010 il signor P.F. riferendo diagnosi di OSAS eseguita c/o altra struttura. Il paziente è già portatore con successo di MAD (modello Dr. Russ – QuattroTi Dentech), ma richiede un nuovo dispositivo, possibilmente più confortevole. Il paziente al momento della diagnosi aveva un peso corporeo di 93 kg per un’altezza di 178 cm producendo un BMI di 29.4. Il punteggio ottenuto sulla scala di Epworth era di 15. I risultati significativi del primo esame polisonnografico (23/7/2009) sono stati i seguenti, tenendo presente che la definizione di ipopnea adottata è, in conformità alle linee guida dell’AASM del 2007, una riduzione di almeno il 50% del flusso respiratorio, associato a una desaturazione di almeno il 3%.
Il 95% del tempo di sonno (sleep time) è trascorso in decubito supino, pertanto la componente posturale non è valutabile. Il pattern ventilatorio è caratterizzato da eventi di tipo ostruttivo (indice apnea/ipopnea: 59 eventi/ora). Le cicliche desaturazioni ossiemoglobiniche sono di media entità (attorno al 93%) con valori minimi di 66%. Il 3% della notte trascorre con SaO2<90%. La frequenza cardiaca media è stata di 71 bpm con un range tra 105-35 bpm, presentando quindi una marcata bradicardia.
Da questi dati viene posta diagnosi di sindrome da apnee ostruttive di tipo severo con desaturazioni ossiemoglobiniche di severa entità; pertanto al paziente viene prescritto con urgenza l’uso della CPAP. Dopo pochi giorni di adattamento viene ripetuto un nuovo esame polisonnografico (29/7/2009) con lo scopo di tarare con precisione il dispositivo. Durante tale indagine il ventilatore viene tarato con una pressione di 7 cm H2O, ottenendo un’architettura del sonno con una normale ciclicità e l’ipnogramma, il pattern ventilatorio e la saturazione ossiemoglobinica risultano normalizzati. L’AHI ottenuto è 8,2 eventi/ora, il nadir pO2 sale a 88% e il paziente trascorre solo lo 0,3% del tempo di sonno con una saturazione di O2 inferiore al 90%. Si normalizza anche la marcata bradicardia rilevata nell’esame precedente (65 bpm come frequenza minima).
Dopo alcuni mesi di uso della CPAP il paziente richiede un trattamento più confortevole e meno invasivo: gli viene quindi prescritto un MAD tipo Dr. Russ prodotto dall’azienda QuattroTi Dentech: il dispositivo è costituito da due bite gemelli (uno superiore e uno inferiore) vincolati da un giunto che permette i movimenti (non illimitati) di lateralità e la protrusione controllata da una vite che il paziente può autoregolare. L’esame polisonnografico eseguito con questo dispositivo indossato (29/4/2010) riporta che il 34% del sonno è trascorso in decubito supino. L’architettura del sonno presenta normale ciclicità, con normale latenza (95 minuti) della fase REM, la cui durata totale è di 34 minuti suddivisi in cicli, nella norma anche la quota di micro risvegli (13,8 per ora di sonno).
Il pattern ventilatorio è caratterizzato dal permanere di eventi di tipo ostruttivo, ma con AHI molto più bassi (10,9), che si verificano esclusivamente con decubito supino, potendo finalmente porre diagnosi di apnea posizionale. Le cicliche desaturazioni ossiemoglobiniche sono di media entità, valori intorno all’87%, con minimi del 73%. Il 4,7% della notte trascorre con SaO2<90%.
Le conclusioni rilevano la persistenza di eventi respiratori di tipo prevalentemente ostruttivo nel solo decubito supino, con indice di apnea-ipopnea di grado lieve (moderato in supino) e desaturazioni ossiemoglobiniche di media entità. Nella norma la macro e la microstruttura del sonno. Nel mese di luglio 2011 il paziente viene sottoposto in regime di day surgery a trattamento chirurgico mini invasivo per il consolidamento del palato molle con radiofrequenze, tre applicazioni orizzontali e due verticali alla potenza di 10 watt e uvulectomia parziale. Il decorso post-operatorio è stato nella norma in assenza di complicazioni. Tre mesi dopo circa il paziente si presenta presso l’Istituto Stomatologico Italiano (Figure 17 e 18) presentando tutta la documentazione clinica già prodotta e richiedendo un dispositivo più confortevole; in data 10-11-2011 vengono prese le impronte per la realizzazione del dispositivo di avanzamento mandibolare tipo Somnodent.

Al paziente viene proposto a mezzo di George Gauge un avanzamento del 70% della massima protrusione che però all’atto della registrazione provocava discomfort; pertanto si è deciso di ridurre l’avanzamento del morso di costruzione al 40% (Figura 19).
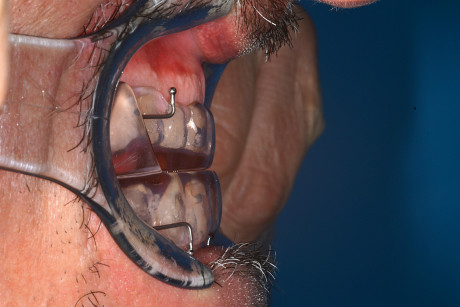
Il dato ottenuto veniva registrato con materiale Occlufast Rock, prodotto dalla Zhermack. Successivamente veniva consegnato il MAD (Figure 20 e 21) al paziente che da subito dimostrava un’ottima compliance, probabilmente essendo già portatore di un altro oral appliance, e progressivamente produceva l’avanzamento mandibolare.
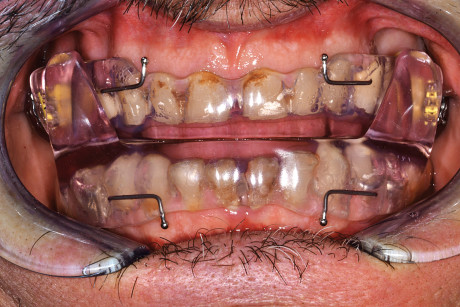
Dai primi controlli si rileva che non è stato necessario utilizzare i ganci per gli elastici che erano stati preventivamente fatti costruire sul Somnodent.
Il paziente viene sottoposto nuovamente alla scala di Epworth con un esito di punteggio 4, la partner lamenta episodi di tipo roncopatici occasionali che si verificano soprattutto nella fase di addormentamento in decubito supino ma che al mattino non sono più presenti.
I dati dell’Apnea-Link registrati in data 1 febbraio 2012 ottenuti indossando il Somnodent sono: indice di apnea/ipopnea 9 e indice di desaturazione (ODI) 10. L’elemento più interessante appare dall’analisi dei dati di desaturazione laddove si evidenzia che solo il 2% del tempo di sonno decorre con un So2 inferiore o uguale a 90% con un nadir di 76%. La saturazione media rilevata è, invece, del 95%. Il paziente appare molto soddisfatto del trattamento proposto e attualmente asserisce che sarebbe in grado di tollerare un ulteriore avanzamento della mandibola che tuttavia non appare possibile con questo dispositivo proprio perché la sua realizzazione è stata eseguita con un morso di costruzione in propulsiva ridotta su richiesta specifica del paziente stesso.
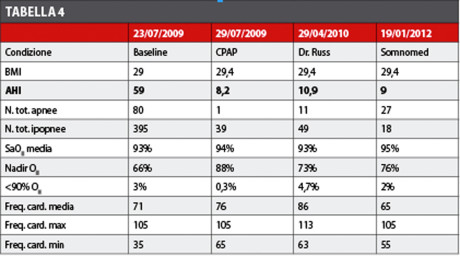
Anche i dati polisonnografici sono incoraggianti circa il miglioramento del grado di OSAS, così come l’aspetto sociale data la notevole riduzione della patologia roncopatica. La Tabella 4 sintetizza i valori degli esami eseguiti dal paziente.
Corrispondenza
Dr. Domenico Viscuso
P.zza Del Liberty, 8 - 20121 MIlano
Tel. 02 76028142
d.viscuso@libero.it
www.domenicoviscuso.it
1. Aarab G, Lobbezoo F, et al. Oral appliance therapy versus nasal continuous positive airway pressure in obstructive sleep apnea: a randomized, placebo-controlled trial. Respiration 2011;81(5): 411-419.
2. Aarab G, Lobbezoo F, et al. Long-term follow-up of a randomized controlled trial of oral appliance therapy in obstructive sleep apnea. Respiration 2011;82(2): 162-168.
3. Ahrens A, McGrath C, et al. A systematic review of the efficacy of oral appliance design in the management of obstructive sleep apnoea. Eur J Orthod 2011;33(3): 318-324.
4. Almeida F.R, Lowe AA, et al. Long-term sequellae of oral appliance therapy in obstructive sleep apnea patients: Part 2. Study-model analysis. Am J Orthod Dentofacial Orthop 2006;129(2): 205-213.
5. Almeida F.R, Lowe AA, et al. Long-term sequellae of oral appliance therapy in obstructive sleep apnea patients: Part 1. Cephalometric analysis. Am J Orthod Dentofacial Orthop 2006;129(2): 195-204.
6. Bates CJ, McDonald JP. Patients’ and sleeping partners’ experience of treatment for sleep-related breathing disorders with a mandibular repositioning splint. Br Dent J 2006;200(2):95-101.
7. Chan AS, Cistulli PA. Oral appliance treatment of obstructive sleep apnea: an update. Curr Opin Pulm Med 2009;15:591-6.
8. Chen H, Lowe AA, et al. Three-dimensional computer-assisted study model analysis of long-term oral-appliance wear. Part 2. Side effects of oral appliances in obstructive sleep apnea patients. Am J Orthod Dentofacial Orthop 2008;134(3): 408-417.
9. Clark GT, Sohn JW, et al. Treating obstructive sleep apnea and snoring: assessment of an anterior mandibular positioning device. J Am Dent Assoc 2000;131(6): 765-771.
10. de Almeida FR, Lowe AA, et al. Long-term compliance and side effects of oral appliances used for the treatment of snoring and obstructive sleep apnea syndrome. J Clin Sleep Med 2005;1(2):143-152.
11. Doff MH, Veldhuis SK, et al. Long-term oral appliance therapy in obstructive sleep apnea syndrome: a controlled study on temporomandibular side effects. Clin Oral Investig 2011 May 3.
12. Engleman HM, McDonald JP, et al. Randomized crossover trial of two treatments for sleep apnea/hypopnea syndrome: continuous positive airway pressure and mandibular repositioning splint. Am J Respir Crit Care Med 2002;166(6):855-9.
13. Fransson AM, Tegelberg A, et al. Effects of a mandibular protruding device on the sleep of patients with obstructive sleep apnea and snoring problems: a 2-year follow-up. Sleep Breath 2003;7(3): 131-141.
14. Gauthier L, Laberge L, et al. Mandibular advancement appliances remain effective in lowering respiratory disturbance index for 2.5-4.5 years. Sleep Med 2011;12(9): 844-849.
15. Hiyama S, Tsuiki S, et al. Effects of mandibular advancement on supine airway size in normal subjects during sleep. Sleep 2003;26(4):440-445.
16. Hoekema A, Stegenga B, et al. Obstructive sleep apnea therapy. J Dent Res 2008;87(9):882-887.
17. Hoekema A, Voors AA, et al. Effects of oral appliances and CPAP on the left ventricle and natriuretic peptides. Int J Cardiol 2008;128(2):232-239.
18. Hoffstein V. Review of oral appliances for treatment of sleep disordered breathing. Sleep Breath 2007;11(1):1-22.
19. Kato J, Isono S, et al. Dose-dependent effects of mandibular advancement on pharyngeal mechanics and nocturnal oxygenation in patients with sleep-disordered breathing. Chest 2000;117(4):1065-1072.
20. Kushida CA, Morgenthaler TI, et al. Practice parameters for the treatment of snoring and Obstructive Sleep Apnea with oral appliances: an update for 2005. Sleep 2006;29(2):240-243.
21. Lam B, Sam K, et al. The efficacy of oral appliances in the treatment of severe obstructive sleep apnea. Sleep Breath 2011;15(2):195-201.
22. Lettieri CJ, Paolino N, et al. Comparison of adjustable and fixed oral appliances for the treatment of obstructive sleep apnea. J Clin Sleep Med 2011;7(5):439-445.
23. Lugaresi E. Il sonno e i suoi disturbi. Bologna: Ed. Il Mulino, 2008.
24. Marklund M, Verbraecken J, et al. (2011) Non-CPAP therapies in obstructive sleep apnoea: mandibular advancement device therapy. Eur Respir J 2011;37:1000-1028.
25. McGown AD, Makker HK, et al. Long-term use of mandibular advancement splints for snoring and obstructive sleep apnoea: a questionnaire survey. Eur Respir J 2001;17(3):462-6.
26. Milton K, et al. Validation of the Apnea Link for the Screening of Sleep Apnea: a Novel and Simple Single-Channel Recording Device. J Clin Sleep Med 2007;3(4):387-392.
27. Mostafiz W, Dalci O, et al. Influence of oral and craniofacial dimensions on mandibular advancement splint treatment outcome in patients with obstructive sleep apnea. Chest 2011;139(6):1331-1339.
28. Nikolopoulou M, Naeije M, et al. The effect of raising the bite without mandibular protrusion on obstructive sleep apnoea. J Oral Rehabil 2011;38(9):643-647.
29. Otsuka R, Almeida FR, et al. The effects of oral appliance therapy on occlusal function in patients with obstructive sleep apnea: a short-term prospective study. Am J Orthod Dentofacial Orthop 2007;131(2):176-183.
30. Rama AN, Tekwani SH, et al. Sites of obstruction in obstructive sleep apnea. Chest 2002;122(4):1139-1147.
31. Robertson CJ. Dental and skeletal changes associated with long-term mandibular advancement. Sleep 2001;24(5):531-537.
32. Sanner BM, Heise M, et al. MRI of the pharynx and treatment efficacy of a mandibular advancement device in obstructive sleep apnoea syndrome. Eur Respir J 2002;20(1):143-50.
33. Sutherland K, Cistulli P. Mandibular advancement splints for the treatment of sleep apnea syndrome. Swiss Med Wkly 2011:141:w13276.
34. Sutherland K, Lee RW, et al. Effect of weight loss on upper airway size and facial fat in men with obstructive sleep apnoea. Thorax 2011;66(9):797-803.
35. Vroegop AV, Vanderveken OM, et al. Effects of vertical opening on pharyngeal dimensions in patients with obstructive sleep apnoea. Sleep Med 2012;13(3):314-316.
36. Walker-Engström ML, Ringqvist I, et al. A prospective randomized study comparing two different degrees of mandibular advancement with a dental appliance in treatment of severe obstructive sleep apnea. Sleep Breath 2003;7(3):119-30.
37. Wilhelmsson B, Tegelberg A, et al. A prospective randomized study of a dental appliance compared with uvulopalatopharyngoplasty in the treatment of obstructive sleep apnoea. Acta Otolaryngol 1999;119(4):503-9.









Volevo sapere quanto tempo di uso quotidiano bisogna aspettare per valutare i risultati di un MAD tramite polisonnografia? Grazie