Questa rara condizione congenita è caratterizzata dalla sostituzione del normale tessuto osseo con connettivo fibroso frammisto a trabecole ossee irregolari. Oggi la TAC Cone Beam rappresenta il mezzo più efficace per la sua valutazione, mentre la scintigrafia ossea risulta utile per verificare la presenza e distribuzione delle lesioni scheletriche. Attraverso l’esposizione di un caso clinico vengono passate in rassegna le procedure diagnostiche e le opzioni di trattamento farmacologico e chirurgico.
Vincenzo Del Buono1, Joseph Garibaldi1, Alessandro Merlini2, Luca Giorgis3
1Direttore medico di I livello, Struttura complessa di Odontostomatologia, Ospedale Galliera, Genova
2Libero professionista, Genova
3Libero professionista, Chiavari (GE)
La displasia fibrosa (FD) è una rara condizione congenita benigna caratterizzata dalla sostituzione del normale tessuto osseo con connettivo fibroso frammisto a trabecole ossee irregolari1. Questa patologia, descritta per la prima volta da Von Recklinghausen nel 1891, ha una base genetica non ereditaria, poiché è causata dalla mutazione post zigotica del gene GNAS che codifica per la subunità alfa della proteina Gs; tale alterazione produce un incremento dell’AMP ciclica che influenza la proliferazione e differenziazione dei preosteoblasti2,3. A seconda del periodo evolutivo nel quale avviene tale mutazione può presentarsi in tre forme distinte: monostotica, qualora coinvolga un solo osso, poliostotica o come sindrome di McCune-Albright, forma poliostotica caratterizzata da un coinvolgimento cutaneo (macchie caffè-latte) ed endocrino4.
La FD non presenta una significativa prevalenza di sesso e tende, nella maggioranza dei casi, ad avere una progressione lenta nel periodo di sviluppo che va ad affievolirsi ulteriormente con il sopraggiungere della pubertà. Nella forma monostotica le ossa mascellari sono i siti maggiormente coinvolti e la manifestazione clinica più frequente è quella di un’area di rigonfiamento asintomatica che può spesso coinvolgere e provocare la migrazione di uno o più elementi dentari. A seconda della localizzazione e progressione della lesione però i segni e sintomi possono essere molto vari fino a includere deformità e asimmetria facciale, alterazione della visione, indebolimento dell’udito, congestione e/o ostruzione nasale, dolore, parestesie e malocclusione5.
Descrizione del caso
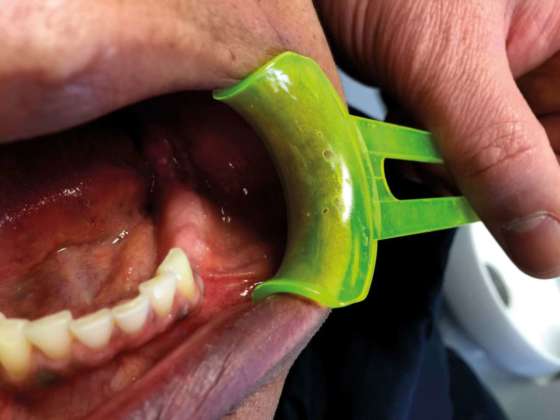
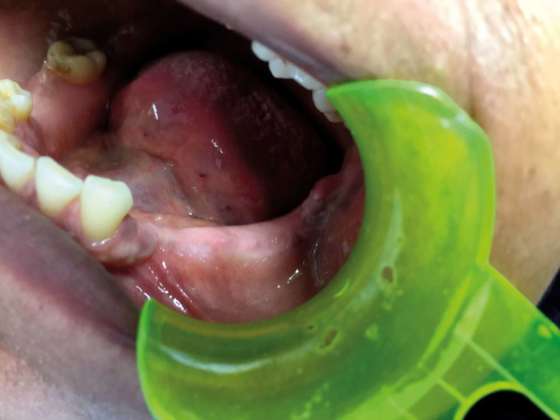
Donna di circa cinquant’anni di origine brasiliana, giunta alla nostra osservazione con una deformazione asintomatica del corpo mandibolare sinistro. All’anamnesi patologica non sono state evidenziate patologie di rilievo. L’ortopantomografia evidenzia un’ampia area radiotrasparente di aspetto simil cistico ma con contorni non definiti, nella quale è possibile apprezzare una formazione radiopaca irregolare.
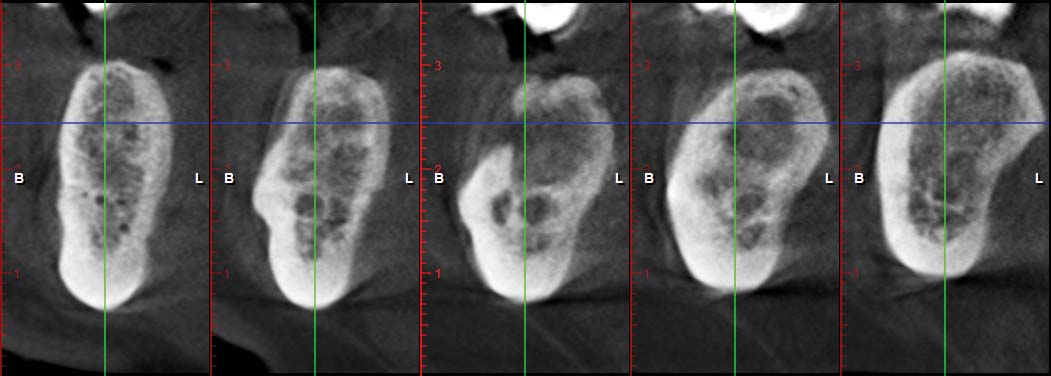
Viene subito richiesto un approfondimento diagnostico mediante TAC Cone Beam che mostra nel corpo mandibolare sinistro un’ampia area osteolitica tondeggiante lunga 20mm e di ampiezza massima pari a 15x15mm con all’interno una zona radiopaca riconducibile a un elemento dentario incluso (Figura 1). La lesione contrae rapporti di stretta vicinanza con il nervo alveolare inferiore che sembra biforcarsi in prossimità dell’elemento dentario ritenuto (Figura 2). Oltre all’area radiopaca appena citata è possibile visualizzarne un’altra, a carattere però non deformante, situata pochi millimetri posteriormente alla precedente che va a interessare anche il ramo mandibolare.
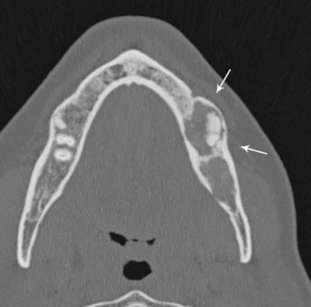
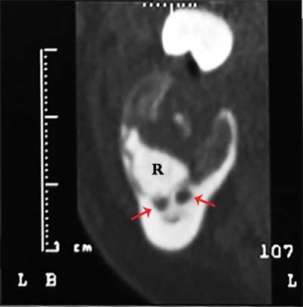
In aggiunta agli esami già in nostro possesso la paziente viene invitata a effettuare una scintigrafia ossea per valutare la captazione del radiofarmaco e l’eventuale presenza di altre lesioni a livello scheletrico, come indicato dal protocollo ospedaliero per i casi di sospetta displasia fibrosa.
Dall’esame scintigrafico effettuato viene evidenziata una significativa asimmetria della distribuzione del tracciante osteotropo a carico del mascellare inferiore sinistro, con un’area di marcata ipercaptazione in corrispondenza del corpo mandibolare e un’ulteriore focalità di più modesto iperaccumulo e minor estensione in prossimità dell’angolo mandibolare (Figura 3).
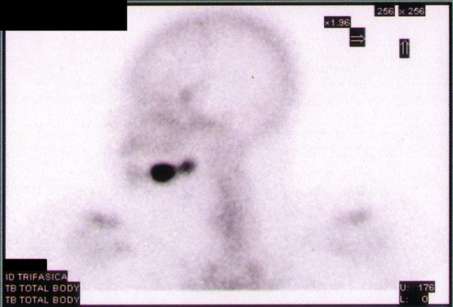
Per confermare il sospetto diagnostico di displasia fibrosa si è provveduto a effettuare un accertamento bioptico prelevando un cuneo di tessuto fibroso dalla zona del corpo mandibolare che è stato poi inviato al patologo per l’esame istologico.
Accertata la natura della lesione si è quindi ritenuto opportuno un approccio chirurgico conservativo, mirato al ripristino delle dimensioni ossee del corpo mandibolare senza intervenire sul ramo, dove la lesione non aveva un’estensione tale da provocare alterazioni estetiche.
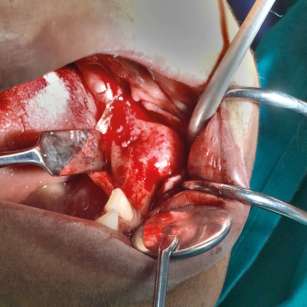

L’intervento chirurgico ha previsto un’osteotomia con asportazione del segmento ipertrofico e un curettage della lacuna ossea con asportazione di particolato fibro-osseo e di un elemento dentario incluso (Figure 4, 5). Si è quindi provveduto a chiudere il lembo mediante una sutura a punti singoli che sono poi stati rimossi a distanza di una settimana; la paziente è stata rivista e monitorata fino alla completa guarigione della ferita. Il tessuto asportato è stato inviato al reparto di Anatomia Patologica per l’esame istologico che ha evidenziato la presenza di tessuto osseo strutturato per lo più in trabecole di spessore variabile e di forma irregolare anastomizzate tra loro o tendenti alla fusione, con formazione di ampi lembi di osso compatto talora bordati da una rima di osteoblasti. Tali trabecole appaiono interposte a uno stroma di tipo fibroso costituito da cellule fusiformi con nuclei monomorfi; non sono state, inoltre, rilevate aree di necrosi o mitosi, a conferma della precedente diagnosi di displasia fibrosa (Figure 6, 7).
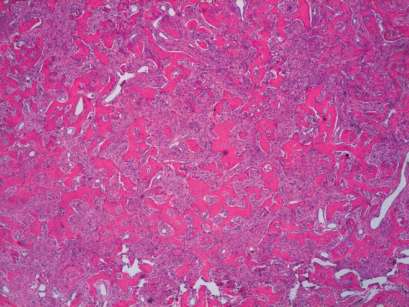
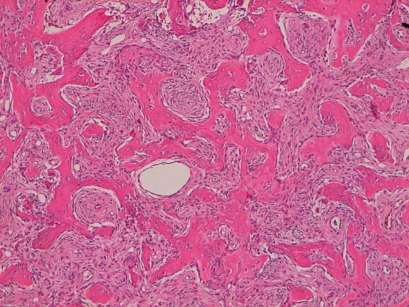
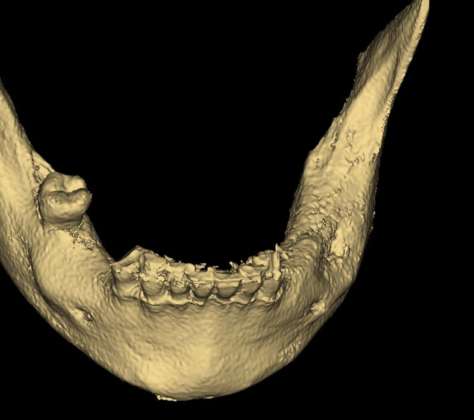
Il risultato finale è soddisfacente con un ripristino dell’estetica facciale e nessuna conseguenza neurologica. Dopo 3 anni dall’intervento viene eseguito un esame Cone Beam di controllo che mostra il mantenimento di una buona morfologia alveolare nel tempo e la parziale riossificazione del difetto (Figure 8-11).
Discussione
L’indagine radiografica rappresenta il mezzo più efficace per la valutazione della FD craniofacciale (CFD) e in particolar modo la TAC Cone Beam (CBCT) che permette una precisa stima dell’estensione e delle caratteristiche delle lesioni. Da un punto di vista radiografico solitamente la FD si presenta con quello che viene tipicamente definito aspetto a “vetro smerigliato” a causa della sovrapposizione delle numerose trabecole ossee scarsamente calcificate distribuite in maniera disorganizzata, inoltre i margini non sono ben demarcati poiché sfumano impercettibilmente nell’osso normale circostante. Va comunque tenuto presente che l’aspetto radiografico non è sempre uguale ma può modificarsi nel tempo con l’evoluzione della patologia. A tale proposito, Lee et al. hanno effettuato uno studio su 26 pazienti mostrando come nelle lesioni dovute a CFD vi sia una transizione radiografica durante la seconda e terza decade di vita che varia, con l’avanzare dell’età, da un aspetto a vetro smerigliato o omogeneo, a uno misto radiotrasparente/radiopaco che si stabilizza in età adulta6-8. Oltre agli esami radiologici classici la scintigrafia ossea rappresenta un utile mezzo per verificare la presenza e/o distribuzione delle lesioni a livello scheletrico, poiché normalmente le aree affette da FD mostrano una maggior captazione del radiofarmaco. Questo esame è estremamente utile per fare diagnosi differenziale tra una forma monostotica o poliostotica e valutare in maniera generale l’estensione delle zone affette9. Non vi sono linee guida uniformemente accettate riguardo al trattamento della CFD; gli approcci possibili sono 3 e includono il monitoraggio, la terapia farmacologica e la terapia chirurgica.
Monitoraggio
In taluni casi in base all’età, alla sede, all’estensione, al tasso di crescita della lesione e all’attitudine del paziente verso la chirurgia può essere indicato limitarsi al solo monitoraggio nel tempo mediante esami diagnostici radiografici periodici quali la TAC Cone Beam e la scintigrafia ossea. Alcuni Autori inoltre consigliano, nei bambini, il monitoraggio fino alla pubertà per attendere che le lesioni diventino quiescenti prima di intervenire con una terapia chirurgica10.
Terapia farmacologica
Le terapie farmacologiche attualmente utilizzate sono palliative e si basano, oltre ai farmaci antalgici tradizionali, su molecole che inibiscono l’attività osteoclastica quali i bifosfonati e in particolare le molecole alendronato, pamidronato e acido zoledronico. Gli studi clinici effettuati sull’efficacia dei bifosfonati hanno mostrato in generale risultati disomogenei ma promettenti, ottenendo generalmente una riduzione del dolore correlato alla FD con vari altri effetti citati quali una diminuzione del tasso di fratture, una diminuzione dei markers di turnover osseo, un incremento della densità ossea e una diminuzione del tasso di crescita delle lesioni. Ciò nonostante, la maggior parte di questi studi sono aperti e perciò mancano del controllo verso placebo o di metodi di ricerca ben definiti che possano dare maggior sicurezza ai risultati ottenuti11. Recentemente uno studio randomizzato a doppio cieco ha messo in dubbio la reale efficacia del trattamento con bifosfonati della FD in modo particolare per quanto riguarda i parametri clinici quali dolore, forza dei muscoli degli arti inferiori e test funzionali12. Ad ogni modo la reale efficacia dei farmaci bifosfonati nel trattamento della FD resta controversa e tuttora non vi sono linee guida sulle modalità di trattamento o indicazioni precise sulle dosi da utilizzare. Per questo motivo sono necessari ulteriori studi prima di poter incoraggiare il loro utilizzo nella pratica clinica quotidiana2,7,13. Negli ultimi anni anche i nuovi farmaci inibitori del RANK Ligando (denosumab) hanno trovato applicazione nel trattamento della FD come alternativa ai farmaci bifosfonati. Ad oggi il materiale disponibile in letteratura sull’efficacia di questo tipo di farmaci è esiguo e limitato ad alcuni casi clinici che hanno mostrato, in generale, un miglioramento in pazienti già trattati, senza particolare efficacia, con bifosfonati. Sono comunque necessari ulteriori studi prima di poter formulare conclusioni definitive sugli effetti e sulla sicurezza di queste nuove tipologie di farmaci. Non va inoltre dimenticato che tutte le molecole citate non sono affatto prive di effetti collaterali, tra cui quello di osteonecrosi delle ossa mascellari13-18.
Terapia chirurgica
La terapia chirurgica è il trattamento chiave per la CFD e mira a prevenire le complicanze funzionali e a migliorare l’estetica. Comprende vari approcci, da quelli più conservativi quali il curettage e il rimodellamento dei margini ossei, che presentano un maggior rischio di recidiva, all’escissione radicale con ricostruzione immediata che garantisce la maggior percentuale di successo2,10.
Particolarmente utile per la scelta della terapia da adottare risulta l’algoritmo proposto nel 1990 da Chen e Noordhoff19,20 che viene tuttora preso come riferimento dalla maggior parte degli studi sul tema. Questi due autori hanno pensato di dividere il distretto cranio-facciale in 4 zone basandosi sulle conseguenze funzionali ed estetiche della patologia in relazione alle caratteristiche anatomiche peculiari di ciascuna area.
- Zona 1: è l’area al di sopra dell’osso alveolare mascellare comprendente le ragioni frontale, nasale, orbitale, etmoidale, zigomatica e mascellare superiore, dove il chirurgo può ricostruire adeguatamente il difetto utilizzando innesti d’osso senza alterare estetica e funzionalità. Per questo motivo viene consigliato, in questa zona, una resezione radicale della lesione.
- Zona 2: è la parte di cranio coperta da cuoio capelluto dove l’apparenza estetica non è importante come nella zona 1. Qui vengono considerate, in base alle valutazioni del chirurgo, due diverse opzioni: quella conservativa e quella radicale.
- Zona 3: è la parte centrale della base del cranio comprendente le regioni petrosa, mastoidea e pterigoidea dove sono localizzati i nervi craniali e i grossi vasi sanguigni. Questa zona è caratterizzata da un accesso chirurgico particolarmente rischioso per il paziente per cui è consigliato evitare l’approccio chirurgico se la lesione non mostra sintomi.
- Zona 4: comprende, come nel caso clinico presentato, la parte del cranio che ospita gli organi dentari e quindi mandibola e mascella. La resezione di una di queste ossa richiede la sostituzione protesica degli elementi persi che non potrà in alcun modo sostituire la funzionalità della dentatura naturale per cui è a ogni modo da preferirsi una terapia di tipo conservativo.
Recentemente è stata proposta da Valentini et al. una revisione di questa classificazione in favore di un trattamento più radicale delle lesioni localizzate nella zona 1 e 4. Secondo gli Autori la resezione radicale rappresenterebbe l’unica tecnica per ottenere la risoluzione della terapia considerando anche le possibilità offerte dalle moderne tecniche ricostruttive che consentono di ottenere risultati estetici e funzionali adeguati, comportando, tuttavia, un allungamento dei tempi di recupero21.
La più temibile complicanza della FD è la rara possibilità di trasformazione maligna che si sviluppa prevalentemente nella forma poliostotica con una frequenza varia tra lo 0,4 e il 6,7%; a ogni modo nella maggior parte della letteratura pertinente si ritiene che la frequenza effettiva sia di fatto inferiore all’1%22. Fra le varie sedi di insorgenza il distretto craniofacciale risulta quello maggiormente coinvolto seguito dal femore, tibia e pelvi. In questi casi la FD evolve verso una lesione sarcomatosa, più frequentemente un osteosarcoma; sono comunque stati riportati in letteratura casi di fibrosarcoma, condrosarcoma e fibroistiocitoma maligno23. Alcuni cambiamenti nella presentazione clinica possono suggerire una possibile trasformazione maligna quali un rapido incremento delle dimensioni della lesione, l’insorgenza di dolore o indolenzimento, alterazioni sensoriali e cambiamenti nelle immagini radiologiche24. In passato si è pensato di utilizzare la radioterapia come possibile trattamento della FD ma è stata in seguito dimostrata una associazione con l’incidenza di trasformazione maligna ed è stata da allora abbandonata25. Data la rarità e scarsa chiarezza dei sintomi, nel caso di lesione sarcomatosa, la diagnosi differenziale risulta particolarmente ostica ed è determinante per una corretta diagnosi l’analisi immunoistochimica. Si ritiene inoltre necessario in questi casi una terapia chirurgica resettiva con ampi margini per minimizzare il rischio di recidive23.
Conclusione
La FD è una rara patologia che frequentemente può coinvolgere il distretto facciale. Le lesioni sono generalmente asintomatiche, salvo non coinvolgano strutture nobili neurovascolari, ma possono determinare complicanze funzionali ed estetiche di rilievo. La radiologia tridimensionale e la scintigrafia ossea possono aiutare il clinico nell’individuazione di questa patologia, la diagnosi tuttavia non sempre è agevole e non può in alcun modo prescindere dall’esame istopatologico.
L’indicazione al trattamento chirurgico non è assoluta, ma deve essere attentamente valutata dal chirurgo in base alla localizzazione delle lesioni e alle implicazioni estetiche e funzionali che queste possono comportare, riservando un approccio più radicale ai casi di sospetta evoluzione neoplastica.
Corrispondenza
giorgis.odonto@gmail.com
Riassunto
La displasia fibrosa (FD) è una rara condizione congenita benigna caratterizzata dalla sostituzione del normale tessuto osseo con connettivo fibroso frammisto a trabecole ossee irregolari. Questa patologia può presentarsi in tre forme distinte: monostotica, poliostotica o come sindrome di McCune-Albright. Nella forma monostotica le ossa mascellari sono i siti maggiormente coinvolti e la manifestazione clinica più frequente è quella di un’area di rigonfiamento asintomatica che può spesso coinvolgere uno o più elementi dentari. L’indagine radiografica per mezzo di TAC Cone Beam rappresenta il mezzo più efficace per la valutazione della FD craniofacciale (CFD) oltre a questa la scintigrafia ossea rappresenta un utile esame per verificare la presenza e distribuzione delle lesioni scheletriche. Vi sono tre possibili approcci per il trattamento della CFD: il monitoraggio, la terapia farmacologica e il trattamento chirurgico. Le terapie farmacologiche sono basate sui farmaci antalgici tradizionali e su molecole che inibiscono l’attività osteoclastica quali i bifosfonati (alendronato, pamidronato e acido zoledronico) e i nuovi inibitori del RANK ligando (denosumab). La chirurgia è il trattamento chiave per la CFD e comprende vari approcci, da quelli più conservativi, quali il curettage e il rimodellamento dei margini ossei, all’escissione radicale con ricostruzione immediata. La trasformazione maligna della FD è rara ma ben documentata in letteratura; nei casi sospetti l’analisi immunoistochimica è essenziale per formulare una diagnosi corretta. In questo lavoro presentiamo le procedure diagnostiche e il trattamento chirurgico di una paziente di circa 50 anni affetta da displasia fibrosa monostotica, localizzata nel processo alveolare del mascellare inferiore di sinistra.
Craniofacial fibrous dysplasia: pathogenesis, diagnosis, and treatment options
Summary
Fibrous dysplasia (FD) is a rare, benign, congenital condition where normal bone tissue is replaced with fibrous connective tissue mixed with irregular cancellous bone. It may appear in three distinct forms: monostotic, polyostotic or as McCune-Albright syndrome. In monostotic form, the maxillae are the sites subject to greatest involvement, and the most frequent clinical manifestation is that of an area of asymptomatic swelling that most often involves one or more teeth. Radiographic investigation with CBCT is the most effective method for the evaluation of the craniofacial fibrous dysplasia (CFD) as well as bone scan is a useful examination for verifying the presence and distribution of skeletal lesions.
There are three possible approaches for the treatment of CFD: monitoring, pharmacological therapy and surgery. The pharmacological therapies are based on traditional antalgic drugs and molecules that inhibit osteoclastic activity such as bisphosphonates (alendronate, pamidronate and zoledronic acid) and new RANK Ligand inhibitors (denosumab). Surgery is the key treatment for CFD and encompasses various approaches, from the more conservative, such as the curettage and remodeling of the bone margins, to radical excision with immediate reconstruction. Malignant transformation of FD is rare but well documented in the literature; in suspected cases immunohistochemical analysis is essential to formulate a correct diagnosis. In this manuscript we present diagnostic procedures and surgical threatment of a female patient aged around 50 with a monostotic fibrous dysplasia located on the alveolar process of the left lower maxilla.
- Riminucci M, Fisher LW, Shenker a, et al. Fibrous dysplasia of bone in the McCune-Albright syndrome: abnormalities in bone formation. Am J Pathol 1997;151:1587–600.
- Adetayo OA, Salcedo SE, Borad V, et al. Fibrous dysplasia: an overview of disease process, indications for
surgical management, and a case report. Eplasty 2015;15:e6. - Schwindinger WF, Francomano C, Levine M. Identification of a mutation in the gene encoding the alpha subunit of the stimulatory G protein of adenylyl cyclase in McCune-Albright syndrome. Proc Natl Acad Sci U S A 1992;89:5152–6.
- Yang L, Wu H, Lu J, et al. Prevalence of different forms and involved bones of craniofacial fibrous dysplasia. J Craniofac Surg 2017;28:21–5.
- MacDonald-Jankowski D. Fibrous dysplasia: a systematic review. Dentomaxillofacial Radiol 2009;38:196–215.
- Lee JS, Butman JA, Collins MT, et al. Abstracts of the American Association of Oral and Maxillofacial Surgeons 84th Annual Meeting. October 2-5, 2002. Chicago, Illinois, USA. J Oral Maxillofac Surg 2002;60:90.
- Lee J, FitzGibbon E, Chen Y, et al. Clinical guidelines for the management of craniofacial fibrous dysplasia. Orphanet J Rare Dis 2012;7:S2.
- Burke AB, Collins MT, Boyce AM. Fibrous dysplasia of bone: craniofacial and dental implications. Oral Dis 2017;23:697–708.
- Bousson V, Rey-Jouvin C, Laredo JD, et al. Fibrous dysplasia and McCune-Albright syndrome: Imaging for positive and differential diagnoses, prognosis, and follow-up guidelines. Eur J Radiol 2014;83:1828–42.
- Ricalde P, Horswell BB. Craniofacial fibrous dysplasia of the fronto-orbital region: A case series and literature review. J Oral Maxillofac Surg 2001;59:157–67.
- Couturier A, Aumaître O, Gilain L, et al. Craniofacial fibrous dysplasia: A 10-case series. Eur Ann Otorhinolaryngol Head Neck Dis 2017;134:229–35.
- Boyce AM, Kelly MH, Brillante BA, et al. A randomized, double blind, placebo-controlled trial of alendronate treatment for fibrous dysplasia of bone. J Clin Endocrinol Metab 2014;99:4133–40.
- Ganda K, Seibel MJ. Rapid biochemical response to denosumab in fibrous dysplasia of bone: Report of two cases. Osteoporos Int 2014;25:777–82.
- Boyce AM, Chong WH, Yao J, et al. Denosumab treatment for fibrous dysplasia. J Bone Miner Res 2012;27:
1462–70. - Benhamou J, Gensburger D, Chapurlat R. Transient improvement of severe pain from fibrous dysplasia of bone with denosumab treatment. Jt Bone Spine 2014;81:549–50.
- Park BY, Cheon YW, Kim YO, et al. Prognosis for craniofacial fibrous dysplasia after incomplete resection: age and serum alkaline phosphatase. Int J Oral Maxillofac Surg 2010;39:221–6.
- Metwally T, Burke A, Tsai JY, et al. Fibrous Dysplasia and Medication-Related Osteonecrosis of the Jaw. J Oral Maxillofac Surg 2016;74:1983–99.
- Eller-Vainicher C, Rossi DS, Guglielmi G, et al. Prompt clinical and biochemical response to denosumab in a young adult patient with craniofacial fibrous dysplasia. Clin Cases Miner Bone Metab 2016;13:253–6.
- Chen YR, Noordhoff MS. Treatment of craniomaxillofacial fibrous dysplasia: how early and how extensive? Plast Reconstr Surg 1990;86:835-42-4.
- Chen YR, Noordhoff MS. Treatment of craniomaxillofacial fibrous dysplasia: how early and how extensive? Plast Reconstr Surg 1991;87:799–800.
- Valentini V, Cassoni A, Terenzi V, et al. Our experience in the surgical management of craniofacial fibrous dysplasia: What has changed in the last 10 years? Acta Otorhinolaryngol Ital 2017;37:436–43.
- Qu N, Yao W, Cui X, et al. Malignant Transformation in Monostotic Fibrous Dysplasia. Medicine (Baltimore) 2015;94:e369.
- Ruggieri P, Sim FH, Bond JR, et al. Malignancies in fibrous dysplasia. Cancer 1994;73:1411–24.
- Ricalde P, Magliocca KR, Lee JS. Craniofacial fibrous dysplasia. Oral Maxillofac Surg Clin North Am 2012;24:427–41.
- Chapurlat RD, Meunier PJ. Fibrous dysplasia of bone. Bailliere’s Best Pract Res Clin Rheumatol 2000;14:385–98.