Riassunto
La radioterapia nelle neoplasie della testa e del collo è una possibilità di trattamento. In questo articolo vengono analizzate le possibili complicanze che insorgono a livello del cavo orale. Scopo del lavoro è quello di identificare una metodologia e dei criteri diagnostico-terapeutici che aiutino l’odontoiatra nella preparazione del paziente che si deve sottoporre a un trattamento radiante.
È stato rilevato come solo l’11,2% dei pazienti che devono essere sottoposti al trattamento non necessitano di cure odontoiatriche. L’efficacia dello screening dentale pre radioterapia è ben documentato. Il compito dello stomatologo si è nel tempo modificato se infatti qualche anno fa la sua attenzione era rivolta unicamente all’eliminazione dei foci odontogeni, che con la loro presenza potevano interferire con il decorso postoperatorio, oggi l’obbiettivo è posto anche alla conservazione degli elementi dentari che risulteranno poi determinanti per una corretta riabilitazione protesica. L’eliminazione delle cause e la gestione delle complicanze durante e dopo il trattamento sono oggetto di valutazione e discussione. Particolare attenzione viene posta alla gestione della xerostomia e alle indicazioni per le terapie odontoiatriche. Anche se la gestione delle complicanze più gravi impone l’utilizzo di strutture protette, la prevenzione e il controllo trova nel dentista di fiducia un valido alleato spesso insostituibile.
Summary
Head and neck tumors radiotherapy is an efficacious and reliable treatment nowadays. Only 11,2% of patients does not need dental treatment before multymodality therapy of head and neck cancer. Aim of this study is to evaluate guidelines and protocols to prepare patients scheduled for radiotherapy. Dental management is performed throughout atraumatic extraction procedures and meticulous follow up.
Prevention and careful strategies are available to the dental practitioner to stave off the dental side effect. Particular attention is given to the management of xerostomia, that is often seen in this patients, beside an indication of dental care treatment plane.
A variety of dental complications may occur in these patients therefore an oral examination is strongly recommended.
The nature and impact of these complications are analizated.
Nel corso degli ultimi anni, il sempre maggior interesse verso terapie meno mutilanti e più orientate alla conservazione d’organo ha portato all’utilizzo di una chirurgia conservativa alla quale spesso viene associato un protocollo radio- e chemio-terapico2.
In particolare, la radioterapia nel distretto oro-facciale viene utilizzata sia come terapia complementare nel trattamento delle neoplasie in stadio avanzato sia come prima scelta in associazione a protocolli chemioterapici.
Presso un esiguo numero di Centri ad alta specializzazione e di fronte a piccole neoplasie della lingua, in assenza di metastasi linfonodali laterocervicali, è possibile eseguire la brachiterapia, ovvero una radioterapia che prevede l’infissione di aghi all’interno del tumore.
La radioterapia, solitamente, si articola nell’arco di 2-3 mesi continuando il suo effetto (inteso come capacità di modificare la struttura irradiata) per circa 24 mesi. L’efficacia dello screening dentale pre-radioterapia è ben documentato46.
Nel tempo, il compito dello stomatologo si è modificato; infatti, se qualche anno fa la sua attenzione era rivolta unicamente all’eliminazione dei foci odontogeni, che con la loro presenza potevano interferire con il decorso post-operatorio, oggi l’obiettivo è posto anche alla conservazione degli elementi dentali che risulteranno poi determinanti per una corretta riabilitazione protesica.
L’importanza di un approccio multidisciplinare, anche in questo ambito, ha pertanto una sua logica: infatti, è importante che l’odontoiatra conosca in quale sede verrà eseguita una mandibulotomia o una mandibulectomia così da preparare adeguatamente il paziente all’atto chirurgico.
È altresì basilare che si individuino dei criteri che permettano allo specialista di identificare quali elementi presentino patologie che, se adeguatamente trattate, non aumentino il rischio di complicanze precoci o tardive.
Complicanze della radioterapia
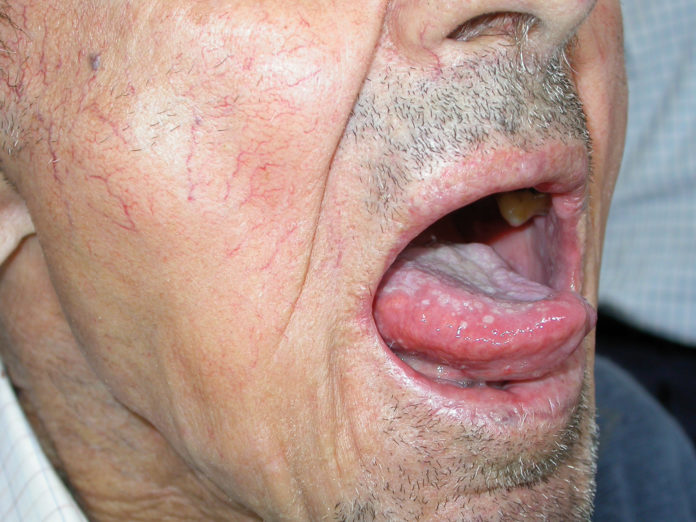
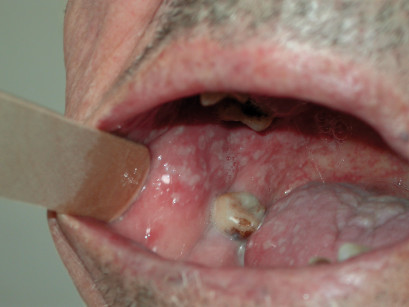
Il paziente sottoposto a terapia radiante può andare incontro a complicanze sia acute sia croniche. Le complicanze acute sono principalmente rappresentate da alterazioni infiammatorie (mucositi) (figure 1 e 2) e infettive (da aumentata patogenicità della flora saprofitica).
Quelle a lungo termine sono, invece, correlate ad alterazione della vascolarizzazione e del trofismo cellulare, soprattutto dei tessuti duri. I cambiamenti indotti dalle radiazioni, determinando ipovascolarizzazione e ipocellularità, riducono le capacità rigenerative e di rimodellamento, aumentando proporzionalmente il rischio di infezioni e necrosi.
Diventa così evidente come una visita (correlata da eventuali terapie) debba essere eseguita presso uno stomatologo prima dell’inizio dell’irradiazione; infatti, risulta chiaro come numerose patologie e un’igiene scadente facilmente si tramutino in complicanze durante e dopo il trattamento4.
La conseguenza sicuramente più temibile è l’osteoradionecrosi (ORN)3,12,13,24,27, fenomeno causato dall’azione diretta delle radiazioni che, provocando una riduzione della vascolarizzazione, determina un’alterazione del trofismo osseo associato a una riduzione dall’attività osteoblastica e osteoclastica.
Scopo del lavoro
Scopo del lavoro è stato quello di identificare una metodologia e dei criteri diagnostico-terapeutici che aiutino l’odontoiatra nella preparazione del paziente che si deve sottoporre a un trattamento radiante.
Analizzando la salute orale dei pazienti che devono essere sottoposti a trattamento radiante si nota come, in quasi tutti, sia necessario un trattamento odontoiatrico e come la compliance verso le cure sia spesso stata, fino a quel momento, scarsa o inesistente.
È stato rilevato che solo l’11,2%1 dei pazienti che devono essere sottoposti al trattamento non necessita di cure odontoiatriche. Le possibili infezioni odontogene che intercorrono durante e dopo la radioterapia possono richiedere procedure chirurgiche invasive che determinano un aumento della morbilità.
È utile ricordare come questi trattamenti, per loro specifica natura, determinano sempre, per un buon periodo, una grave difficoltà all’alimentazione e, se a questa si associa una ridotta funzionalità dell’apparato stomatognatico, si intuisce facilmente il disagio provato dal paziente. I protocolli adottati, oltre a preservare l’integrità della mucosa orale e delle labbra, prevengono le carie e le problematiche parodontali considerando nel contempo il dolore, il disagio e la prevenzione delle infezioni47,48.
La visita viene effettuata anticipatamente, al fine di terminare le cure almeno 20 giorni prima dell’inizio del trattamento radiante. L’obiettivo della valutazione è di:
- identificare i fattori di rischio che portano all’insorgenza di complicanze;
- programmare le terapie necessarie;
- adottare un protocollo di igiene orale e prevenzione delle complicanze;
- pianificare i controlli periodici.
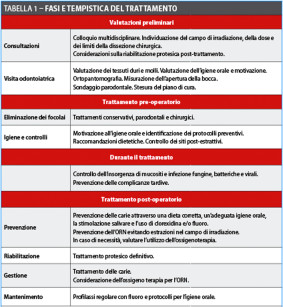
Sia per motivi descrittivi sia considerando un criterio temporale è sembrato opportuno articolare il protocollo attraverso i seguenti passaggi (tabella 1):
- visita pre-trattamento;
- igiene orale e motivazione;
- terapia chirurgica;
- terapia conservativa;
- accorgimenti durante la terapia radiante;
- controlli periodici e valutazione a lungo termine.
Visita pre-trattamento
La visita deve essere sempre accompagnata da un’ortopantomografia e, qualora sussistano dubbi diagnostici, da radiogrammi endorali. L’esame obiettivo, oltre a valutare lo stato dei tessuti duri dentali, non deve tralasciare eventuali alterazioni dei tessuti molli.
Scopo primario è quello di ridurre il più possibile gli interventi odontoiatrici nei 24 mesi successivi al termine della terapia radiante21,22.
Utile, in questa sede, è sia l’identificazione del campo di irradiazione sia la determinazione della prognosi quod vitam, al fine di una corretta applicazione delle indicazione terapeutiche.
Dentizione
La valutazione degli elementi dentali deve essere rivolta all’identificazione di eventuali patologie dei tessuti duri, oltre al rifacimento di trattamenti incongrui. Fondamentale è l’individuazione di potenziali foci della mucosa orale o del parodonto.
Parodonto
Nei pazienti parodontalmente compromessi una valutazione iniziale con il monitoraggio della profondità delle tasche e l’interessamento della forcazione risulta significativo, soprattutto per una rivalutazione a distanza.
Mucosa orale
È importante considerare condizioni che potrebbero interferire con una futura protesizzazione rimovibile quali ulcere, fibromi, iperplasie mucose e spicole ossee.
Il fine è principalmente quello di anticipare eventuali interventi di chirurgia pre-protesica.
Funzionalità stomatognatica
La valutazione della massima apertura deve essere annotata, soprattutto se il campo di irradiazione coinvolge, oltre ai muscoli masticatori, anche l’articolazione temporo mandibolare (ATM), in quanto è predicibile l’insorgenza di trisma.
La visita preliminare termina con la stesura del piano di cura.
I principi guida che devono orientare nella sua compilazione sono:
- il mantenimento del maggior numero di denti possibile;
- evitare estrazioni dopo la radioterapia;
- la prevenzione di complicanze durante il trattamento radiante, che ne potrebbero inficiare la prosecuzione;
- tutti gli elementi con prognosi non prevedibile dovrebbero essere estratti a priori. La conservazione degli elementi dovrebbe, inoltre, essere direttamente proporzionale sia alla motivazione sia alla capacità di attuare i protocolli di igiene orale richiesti;
il tipo di radiazione, il campo di esposizione e la dose sono, altresì, criteri per determinare l’avulsione, infatti, la probabilità di insorgenza dell’osteoradionecrosi è massima se la dose irradiata supera 65 Gy.
Igiene orale
Oltre a valutare il livello di placca e il sanguinamento, risulta importante considerare le tecniche di spazzolamento, la motivazione e le capacità del paziente nel poter effettuare una corretta igiene orale, riducendo le complicanze che possono originare da situazioni permanenti (iposalivazione) o temporanee (mucositi).
Utile ricordare come l’associazione alcol-tabacco (principale fattore eziologico del carcinoma orale) abbia un effetto deleterio a livello del cavo orale.
È determinante che prima dell’inizio della terapia, con l’ausilio di varie procedure (scaling, root-planing, curettage) si ottenga la miglior salute parodontale possibile. Un periodo di tre settimane dall’ultimo trattamento è da considerarsi sufficiente
per l’ottenimento di una buona guarigione dei tessuti.
L’istruzione e la motivazione a una corretta igiene sono, insieme all’utilizzo di gel fluorati (principalmente fluoruro di sodio al 1%), la principale arma nella prevenzione dei processi cariosi post-trattamento9,37.
L’utilizzo di una mascherina in acetato personalizzata è consigliata per praticità ed efficacia avendo l’accortezza di estendere il bordo 3 mm oltre il margine gengivale, assicurandosi così un’adeguata copertura cervicale.
Lo spazzolamento dei denti deve avvenire con spazzolino morbido 2-3 volte al dì per circa 3 minuti sciacquando frequentemente la bocca con acqua tiepida.
Se possibile utilizzare 2 volte al dì un collutorio antisettico senza alcol.
Terapia chirurgica
Considerando che, secondo molti autori, l’estrazione post radioterapia è uno dei principali fattori di osteoradionecrosi8
si comprende come le indicazioni a una terapia chirurgica preventiva devono prevedere, oltre a un programma terapeutico risolutivo nel medio termine (2-3 anni), anche il mantenimento di un’adeguata capacità funzionale.
Le principali indicazioni alla terapia chirurgica sono:
- evidenti lesioni periapicali;
- residui radicolari non completamente in inclusione ossea o che presentano aree di radiotrasparenza;
- elementi con gravi compromissione parodontale (tasche > di 5mm, interessamento di III grado della formazione, mobilità di III grado);
- elementi in prossimità di masse tumorali;
- cisti odontogene e non;
- elementi, soprattutto ottavi, che in passato abbiano, per la loro non completa inclusione ossea o mucosa, presentato episodi di pericoronarite.
Alcuni autori consigliano una politica estrattiva verso tutti quegli elementi che presentano una significativa compromissione parodontale46.
Nel caso di estrazioni chirurgiche, particolare attenzione deve essere posta all’utilizzo di presidi che accelerino la guarigione delle ferite, cercando di evitare soprattutto l’esposizione dell’osso o la rimanenza di spicole.
Infatti, a causa del trattamento radiante, non c’è da aspettarsi un normale rimodellamento osseo, necessario per una corretta guarigione.
In generale, viene considerato sufficiente un periodo di tre settimane per l’ottenimento di un buon sigillo mucoso.
L’utilizzo di antibiotico terapia non è necessario se non specificatamente indicato.
Nel caso che alcuni elementi fondamentali per la riabilitazione protesica presentino modeste reazioni apicali può trovare indicazione l’endodonzia chirurgica a patto, che non sia presente compromissione parodontale.
Terapia conservativa e protesica
Oltre al trattamento delle lesioni cariose esistenti e alle eventuali terapie canalari, particolare attenzione va posta ai restauri conservativi e protesici incongrui che determinano il ristagno di cibo e di placca. La concomitante presenza di iposalivazione, conseguente al trattamento, riduce il potere di autodetersione e disinfezione salivare facilitando l’insorgenza di infezioni parodontali o carie secondarie. La ribasatura di protesi mobili, parziali o totali, è indicata per ridurre compressioni locali cercando di evitare ribasature morbide che aumentano la frizione mucosa oltre a determinare un maggior ristagno di placca.
La costituzione di nuovi manufatti protesici deve essere comunque rimandata ad almeno sei mesi dalla fine del trattamento radiante.
Accorgimenti durante il trattamento radioterapico
Durante la radioterapia risulta importante sia il mantenimento di una corretta igiene orale sia la riduzione del disagio che progressivamente insorge durante la terapia.
La pulizia del cavo orale deve essere frequente (ogni 4 ore) ed effettuata utilizzando spazzolini morbidi, coadiuvata da sciacqui per rimuovere frequentemente residui organici, batteri e frustoli epiteliali. Vari autori hanno utilizzato diverse tipologie di collutori ottenendo risultati confortanti e sovrapponibili:
- perossido d’idrogeno e acqua (1:4)49;
- bicarbonato di sodio (un cucchiaino in una tazza d’acqua o in 500 ml);
- mezzo cucchiaino di sale e un cucchiaino di bicarbonato diluiti in un litro d’acqua;
- mezzo cucchiaino di sale e due cucchiaini di bicarbonato diluiti in quattro tazze d’acqua.
Il bicarbonato viene utilizzato per aumentare il pH e rendere più efficace la capacità tampone intraorale. È consigliato evitare collutori in sospensione alcolica che, potendo irritare le mucose, aumentano i disagi del paziente50.
La clorexidina, pur essendo un potente antisettico attivo sui batteri Gram positivi, negativi, funghi e lieviti, non risulta efficace contro spore, virus e batteri acid-fast 49,51.
È stata dimostrata, inoltre, la sua inefficacia in pazienti xerostomici (a causa del trattamento radiante)52.
La mucosite è l’evento che sempre si associa durante e dopo il trattamento e la cui intensità è correlabile con la dose impiegata23,25,26.
Solitamente si protrae per 6-8 settimane dalla fine della terapia ma già dopo 4 settimane il 90-95% dei pazienti mostra una completa risoluzione della malattia40,41,11.
La guarigione dipende, oltre che dalla gravità, anche dal numero di globuli bianchi presenti.
Il ghiaccio tritato, utile nel trattamento sintomatologico può essere abbinato alla capsicina nel trattamento del dolore.
Alcuni autori consigliano, al fine di prevenire l’insorgenza di mucositi gravi, l’assunzione, quattro volte al giorno, di PTA, soprattutto se la maggior parte della mucosa orale è esposta al campo radiante.
Il composto che tende a eliminare selettivamente i bacilli Gram negativi contiene polimixin E, tobramicina e anfotericina B (una compressa di PTA da 1 grammo contiene 2 mg polimyin E, 1,8 mg tobramicina e 10 mg di anfotericina)9,52.
Una volta che la mucosite si è sviluppata, al fine di alleviare il dolore, è indicata una sospensione di sucralfato (1 g in 5 ml). In caso di dolenzia allo spazzolamento (determinato dalla mucosite) sono utili:
- sedute di igiene orale professionale;
- utilizzo di clorexidina in soluzione acquosa allo 0,1% due volte al giorno;
- utilizzo di anestetici topici (come lidocaina in crema) prima dello spazzolamento.
La concomitante presenza di leucopenia facilita una sovrainfezione che può essere batterica, virale o fungina45.
La candidosi è l’infezione di più frequente riscontro30 e spesso ricorre per la presenza di xerostomia.
La forma acuta va distinta dalla mucosite e se ne differenzia per la simmetria e bilateralità delle lesioni.
La terapia si avvale dell’uso per almeno di due settimane di una sospensione contenete nystatina, mentre la terapia sistemica con ketaconazolo è consigliata solo nei casi resistenti.
Le ulcere orali sono frequenti e spesso trovano come causa patogenetica una riattivazione dell’herpes simplex (HSV). L’aclicovir è il trattamento di scelta e può essere usato in via profilattica solo nei pazienti che presentano un’alta reattività (sieropositivi, trapiantati, leucopenici).
Facilmente, i pazienti troveranno difficoltà ad alimentarsi sia per l’iposalivazione sia per la presenza di mucositi46.
È preferibile evitare cibi acidi, con alto potere cariogeno ed effettuare pasti piccoli e frequenti. L’astensione da alcol e tabacco è fortemente raccomandata. I lubrificanti sono richiesti per il mantenimento dell’integrità delle labbra; i più comunemente usati sono la vaselina e gli oli naturali.
Se la perdita di peso eccede il 10% è utile valutare supplementi nutrizionali, onde evitare eccessiva defedazione del paziente.
È consigliato settimanalmente, anche in assenza di sintomatologia, un controllo odontoiatrico.
La presenza di disgeusia è di frequente riscontro e la causa trae origine, oltre che da alterazione dei recettori gustativi, anche dalla concomitante presenza di xerostomia, infezioni locali e problematiche dentali.
La disgeusia insorge rapidamente, quando la dose radiante supera i 30 Gy, ma nella maggior parte dei casi viene riacquistata nei quattro mesi successivi44.
È opportuna l’astensione dall’utilizzo di protesi mobile durante tutto il ciclo radioterapico, qualora il campo irradiato interessi buona parte della mucosa orale.
La prevenzione del trisma impone preposti esercizi finalizzati al mantenimento di un’adeguata mobilità articolare.
Presidi come cunei di gomma, tappi di sughero, bite con molla trovano indicazione nei pazienti in cui l’uso delle dita (indice e pollice che incrociandosi divaricano le arcate) risulta difficoltosa.
Controlli periodici e valutazione a lungo termine
Le patologie che insorgono in questa fase sono principalmente le carie da radiazione, le problematiche parodontali e l’osteoradionecrosi. Poco si conosce sull’effetto diretto delle radiazioni ionizzanti sui denti maturi42. Si concorda sulla progressiva atrofia pulpare associata a una minor reattività agli insulti esterni. Anche il dolore risulta meno severo in presenza di patologie che determinano atrofia pulpare. Le carie dentali presentano un aspetto caratteristico, associate a una rapida progressione.
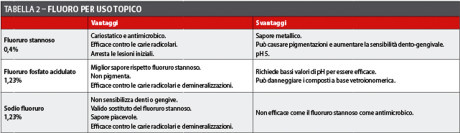
Tramite controlli periodici si può ravvivare la motivazione all’igiene orale e programmare l’applicazione topica di fluoro. Il successo nella prevenzione della carie è determinato dalla concentrazione di fluoro e dalla sua frequenza di applicazione36. Si consiglia di utilizzare paste dentifricie fluorate modicamente diluite in acqua34.
Non esiste un protocollo comune per i trattamenti a base di fluoro né per la tipologia di composto fluorato da utilizzare (tabella 2). Più concordanza è stata trovata sull’utilizzo di una maschera preformata in acetato, sul tempo di permanenza in bocca (5-10 minuti) e sull’applicazione a lungo termine del trattamento.
Per le otturazioni, i materiali da prediligere sono quelli a base di cemento vetroionomerico per la loro capacità di rilasciare fluoro e che con l’aggiunta di composito (compomeri) consentono anche un buon risultato estetico. In caso di elevato carico occlusale, l’amalgama d’argento (previo sottofondo in cemento vetroionomerico) è da preferire alle resine composite per la sua capacità di mantenere un buon sigillo marginale.
Anche la ricopertura preventiva con capsule si è dimostrata inefficace, in quanto i margini di chiusura rimangono ugualmente esposti al rischio di carie.
In caso di irradiazione a denti in formazione si può avere un arresto dello sviluppo che solitamente si concretizza con un’anomalia smalto-dentinale42.
La periodicità dei richiami dovrebbe essere quindicinale per i primi due mesi e mensile per il primo anno.
L’attesa di almeno sei mesi (meglio un anno)10 per un’eventuale protesizzazione mobile deve combinarsi a una scrupolosa igiene del manufatto oltre che con l’astensione dal suo utilizzo notturno.
Particolarmente insidiosi possono risultare eventuali decubiti che devono essere precocemente trattati e corretti.
Il livello di iposalivazione è strettamente collegato alla dose radiante massima ricevuta dalle ghiandole salivari maggiori28. Solitamente diventa severo, non mostrando anche successivamente segni di remissione, se la dose supera i 40 Grey. Si è notato che è maggiore la funzionalità residua delle ghiandole non totalmente irradiate29,44.
Se le parotidi determinano la maggior parte del flusso salivare stimolato; le ghiandole sottomandibolari sono fondamentali per il flusso basale.
L’estrema sensibilità delle ghiandole al trattamento radiante porta ad alterazioni quantitative e qualitative della saliva32,33. L’irradiazione di 2,25 Gy ha dimostrato essere sufficiente a causare una riduzione del flusso del 50% entro le 24 ore40,41,42. Il bicarbonato è il principale sistema tampone che la saliva utilizza con gli acidi prodotti dalla placca, ma è efficace solo se presente in alte dosi. Nel paziente xerostomico di verifica una diminuzione del pH salivare e un aumento della concentrazione di sali43.
La strategia terapeutica è rivolta sia alla stimolazione della capacità residua sia alla risoluzione della secchezza orale, ricordando che spesso non esiste correlazione lineare tra sensazione di secchezza e reale riduzione del flusso salivare35,53.
Trattamenti sintomatici come frequenti sciacqui (camomilla, acqua, tea ecc.) sono consigliati anche se palliativi.
Utile è una valutazione clinica diretta del grado di iposalivazione che viene attuata attraverso la valutazione delle mucose (secchezza, atrofia), la qualità salivare e la produzione dopo stimolo38,39.
La stimolazione della funzionalità residua ghiandolare può avvenire attraverso presidi tattili-gustativi (chewing-gum sugarfree, cibi acidi)31 o farmacologici (pilocarpina). I sostituti salivari a base di mucina o carbossimetilcellulosa sono risultati efficaci e particolarmente utili nelle ore notturne.
L’applicazione topica di fluoro dovrebbe essere inversamente proporzionale al flusso salivare ed essere anche parzialmente mantenuta fino a che quest’ultimo non rientra nella normalità. Diversi studi dimostrano l’utilità dell’applicazione, a giorni alterni, di NaF all’1%. La diagnosi di ORN avviene allorquando l’esposizione dell’osso alveolare all’ambiente orale è superiore a 3-6 mesi anche con la sospensione dell’uso di alcol e tabacco e con l’utilizzo di sciacqui con collutori antisettici.
L’incidenza dell’ORN nei siti estrattivi post-radioterapici è di circa il 23%14,15,16,18.
I fattori che contribuiscono all’insorgenza dell’ORN nei mascellari sono:
- la dose irradiata;
- il tipo di radiazioni utilizzate;
- la sede del tumore;
- l’estrazione di elementi dentali nella zona di irradiazione;
- la tecnica chirurgica utilizzata;
- la presenza di lesioni periapicali.
Circa un terzo dell’ORN avviene spontaneamente e dei rimanenti due terzi l’avulsione è la principale causa traumatica6,7,54. La necessità di tale terapia post-trattamento è determinata sia da errata programmazione sia da mancata compliance del paziente.
Anche se non vi è una stretta correlazione fra ORN e distanza della terapia radiante si è rilevato che il suo decremento è direttamente correlabile alle misure adottate. Importante risulta l’attenzione per i tessuti molli, la «delicatezza» chirurgica, la chiusura per prima intenzione della ferita e l’assenza di osteotomia. L’uso indiscriminato e prolungato di antibioticoterapia (in presenza di ORN conclamata) è ingiustificato e dovrebbe essere limitato solo ai casi con infezione in atto. Consigliato è invece il trattamento locale della ferita con antisettici e pulizia dei detriti di cibo e di osso necrotico (debridment).
La profilassi antibiotica pre- e post-intervento è consigliata utilizzando molecole ad ampio spettro (amoxicillina + acido clavulanico o cefalosporine) e coprendo un intervallo temporale ampio (da alcuni giorni prima a dieci giorni dopo). L’ossigeno-terapia è spesso utilizzata per la terapia dell’ORN in quanto determina un’accelerazione dei processi di guarigione5,17,19,20,54.
Nonostante l’evidente utilità profilattica, la sua difficoltà applicativa ne limita l’utilizzo a pazienti sottoposti a forte dose radiante (> 65 Gy). La comparsa di trisma è correlata all’irradiazione dei muscoli masticatori e può avvenire anche tardivamente (dopo 3-6 mesi), insorgendo in maniera inaspettata; si consiglia, pertanto, il continuo monitoraggio dell’apertura massima.
Conclusioni
L’individuazione di un protocollo per il trattamento dei pazienti sottoposti a terapia radiante trova la sua indicazione nelle numerose sequele conseguenti la terapia.
Il ruolo del dentista libero-professionista risulta determinante per la cronica carenza di strutture pubbliche o convenzionate.
Anche se la gestione delle complicanze più gravi impone l’utilizzo di strutture protette, la prevenzione e il controllo trova nel dentista di fiducia un valido alleato spesso insostituibile.
Infatti, l’età media dei pazienti è elevata rendendo credibile la presenza di in un’odontoiatra di fiducia.
Il fatto di poter permettere allo stesso professionista di integrare o completare le terapie da lui precedentemente svolte, oltre a garantire una continuità terapeutica, risulta clinicamente efficace.
Obiettivo di questo scritto è quello di dare un pratico aiuto al professionista, al fine di poter affrontare tematiche che, spesso a causa della loro scarsa frequenza, risultano poco trattate nei nostri studi monoprofessionali.
Corrispondenza
dottor Lorenzo Damia
via Mauro Macchi, 59
20124 Milano
e-mail: lorenzodamia@katamail.com
2. Thorn JJ, Hansen HS, Specht L, Bastholt L. Osteoradionecrosis of the Jaws: clinical characteristics and relation of the field of irradiation. J Oral Maxillofacc Surg 2000; 58: 1088-1093.
3. Marx RE. Osteoradionecrosis: a new concept of its pathophysiology. J Oral Maxillofacc Surg 1983; 41:283-288.
4. Cecchetti F, Mari M, Germano F, Motta A, Arcuri C. Pazienti sottoposti a radio e chemioterapia – manifestazioni orali. Dental Cadmos 2004; 9:53-66.
5. Marx RE, Johnson RP, Kine SN. Prevention of osteoradionecrosis: a randomised prospective clinical trial of hyperbaric oxygen versus pennicillin. J Am Dent Assoc 195,111:149.
6. Hee-Kyun Oh, Chambers MS, Garden AS, Wong P, Martin JW. Risk of osteoradionecrosis after extraction of impacted third molars in irradiated head and neck cancer patients. J Oral Maxillofacc Surg 2004; 62:139-144.
7. Sulainam F, Huryn JM, Zlotolow IM. Dental extraction in the irradiated head and neck patient: a retrospective analysis of memorial sloan-kettering cancer center protocols, criteria and end results. J Oral Maxillofacc Surg 2003; 61:1123-1131.
8. Koga DH, Salvajoli JV, Alves FA. Dental extractions and radiotherapy in head and neck ancology: review of the literature. Oral Diseases (2008); 14:40-44.
9. Jansma J et al. Protocol for the prevention and treatment of oral sequelae resulting from head and neck radiation therapy. Cancer October 15,1992; Volume 70 N° 8: 2171-2180.
10. Rothwell BR. Prevention and treatment of the orofacial complications of radiotherapy. J Am Dent Assoc 1987; 114: 316-322.
11. Clarkson JE, Worthington HV, Eden OB. Intervention for preventing oral mucositis for patients with cancer reciving treatment. Journal of Evidence-Based Dental Practice; Volume 3 Number 3;171-172.
12. Beumer J, Harrison R, Sanders B, Kurrasch M. Osteoradionecrosis: predisposing factors and outcomes of therapy. Head Neck Surg 1984; 6:819-827.
13. Murray CG, Herson J, Daly TE, Zimmerman S. Radiation necrosis of the mandible: a 10 year study. Part II. Dental factors; onset, duration and management of necrosis. Int J Radiat Oncol Biol Phys 1980; 6: 549-553.
14. Murray CG, daily TE, Zimmerman SO. The relationship between dental desease radiation necrosis of the mandible. Oral Surg Oral Med Oral Pathol 1980; 49: 99-104.
15. Epstein JB, Rea G, Wong FL, Spinelli J, Stevenson-Moore P. Osteonecrosis: Study of the relationship of dental extraction in patients reciving radiotherapy. Head and Neck Surg 1987; 10:48-54.
16. Beumer J 3rd, Harrison R, Sanders B, Kurrasch M. Preradiation dental extractions and the incidence of bone necrosis. Head Neck Surg 1983; 5:514-21.
17. Johnson RP. Adjunctive hyperbaric oxygen in irradiated patients requiring dental extraction: outcomes and complications. J Oral Maxillofac Surg 2001; 59:523-524.
18. Epstein JB. Osteonecrosis of the jaws: clinical characteristics and relation to the field of irradiation.; J Oral Maxillofac Surg 2000; 58:1093-1095.
19. Chavez JA, Adkinson CD. Adjunctive hyperbaric oxygen in irradiated patients requiring dental extractions: outcomes and complications.; J Oral Maxillofac Surg 2001; 59:518-22.
20. Kishore Shetty, Heber Tuft. Dental Managment of the pediatric post radiation therapy -rhabdomyosarcoma patients: Case reports and review of literature. Oral Oncol EXTRA (2005) 41:42-248.
21. Hancock PJ, Epstein JB, Robins Sadler G. Oral and dental managment related to radiation therapy for head and neck cancer. J Can Dent Ass October 2003, Vol. 69, n° 9.
22. Rieger JM, Zalmanowitz JG, Wolfaardt JF. Functional outcomes after organ preservation treatment in head and neck cancer: a critical review of the literature. Int. J. Oral Maxillofac. Surg. 2006; 35:581-587.
23. Sabbi Vanessa. Prevenzione e trattamento della mucosite orale nei pazienti neoplastici. Best Practice 1998 Volume 2, issue 3, 1-6.
24. Kluth EV, Jain PR Stuchell RN, et. al. A study of factors contributing to the development of osteradionecrosis of the jaws. J Prosthet. Dent. 59:194,1988.
25. Andrews N, Griffiths C. Dental complications of head and neck radiotherapy. Part I. Aust. Dent. J; 2001; 46;88-94.
26. Andrews N, Griffiths C. Dental complications of head and neck radiotherapy. Part II. Aust. Dent. J; 2001; 46;174-181.
27. Toljanic JA, Ali M, Haraf DJ et al. Osteonecrosis of the jaws as a risk factor in radiotherapy: a report of eight retrospective review. Oncol Rep 1998; 5:345.
28. Smith PM. Mechanism of secretion by salivary glands. In: Edgar WM, O’Mullane DM, eds. Saliva and Oral Health. 2nd ed. London; BDJ, 1996:9-25.
29. Valdez IH, Atkinson JC, Ship JA, Fox PC. Major salivary gland function in patients with radiation-induced xerostomia: flow rates and sialochemistry. Int J Radiat Oncol Biol Phys. 1993; 25: 41-47.
30. Epstein JB, Freilich MM, Le ND. Risk factors for oropharyngeal candidias in patients who reciving radiation therapy for malignant conditions of the head and neck. Oral Surg Oral Med. Oral Pathol. 1993;76:169-174.
31. Sreebny L. Xerostomia: diagnosis, managment and clinical complications. In Edgar WM, O’Mullane DM, eds. Saliva and Oral Health. 2nd edn. London; BDJ, 1996:43-66.
32. Kirstila V, Lenander-Lumikari M, Soderling E, et al. Effects of oral hygiene products containing lactoperoxidase, lysosime and lactoferrin on the composition of whole saliva and on subjective oral symptoms in patients with xerostomia. Acta Odontol Scand 1996; 54:391-397.
33. Kirstila V, Lenander-Lumikari M, Tenovuo J. Effects of a lactoperoxidase-system-containing toothpaste on dental plaque and whole saliva in vivo. Acta Odontol Scand 1994; 52:346-353.
34. Ten Carte B. The role of saliva in mineral equilibria – Caries and calcolus formation. In Edgar WM, O’Mullane DM, eds. Saliva and Oral Health. 2nd edn. London; BDJ, 1996:123-136.
35. Wind DA. Management of xerostomia: an overview. Practical Hygiene 1996; 5:23-27.
36. Newbrun E. Current treatment modalities of oral problems of patients with Sjogren’s syndrome: caries prevention. Adv Dent Res 1996; 10:29-34.
37. Epstein JB, van der Meij EH, Emerton SM, et al. Compliance with flouride gel use in irradiated patients. Spec Care Dentist 1995; 15:218-222.
38. Dawes C. Clearance of substance from oral cavity – implications for oral health. In Edgar WM, O’Mullane DM, eds. Saliva and Oral Health. 2nd ed. London; BDJ, 1996; 67-79.
39. Edgar M, Higham SM. Saliva and the control of plaque pH. In Edgar WM, O’Mullane DM, eds. Saliva and Oral Health. 2nd ed. London; BDJ, 1996:81-94.
40. Million and Cassisi: The effect of radiation on normal tissues of the head and neck. Managment of head and neck cancer: A multidisciplinary approach. Philadelphia: JP Lippincott, 1984:173-204.
41. Dreizen S. Description and incidence of oral complication. NCI monographs 1990;9:11-15.
42. Dawes C. Factors influencing salivary flow rate and composition. In Edgar WM, O’Mullane DM, eds. Saliva and Oral Health. 2nd ed. London; BDJ, 1996: 27-41.
43. Johnson DR, Moore WJ, eds. Anatomy for dental students. Oxford: Oxford University Press, 1983:174.
44. Conger AD. Loss and recovery of taste acuity in patients irradiated to the oral cavity. Rad Res 1973;53:338-347.
45. Silveran S. Oral defences and compromises: an overview NCI Monographs 1990; 9:17-19.
46. Beumer J, Curtis T, Harrison RE. Radiation therapy of the oral cavity: sequelae and managment, part 1. Head and Neck Surgery 1979; 1: 301-312.
47. Miaskowski C. Managment of mucositis during therapy. NCI Monographs 1990; 9:87-90.
48. Hickey AJ, Toth BB, Lindquist SF, Effect of intravenous hyperalimentation and oral care on the development of oral stomatitis during cancer chemotherapy. J Prosthet Dent 1982; 47:188-193.
49. Ziga SE. Nursing management of acute oral complications of cancer. NCI monographs 1990;9;133-138.
50. Bavier AR. Nursing management of acute oral complications of cancer. NCI monographs 1990;9;123-128.
51. Ferretti GA, Brown AT, Raybould TP et al. Oral antimicrobical agents – clorhexidine. NCI Monographs 1990; 9:51-55.
52. Nectarios A, Chris G. Dental complications of head and neck radiotherapy. Part II. Austr Dent J 2001; 46:(3):174-182.
53. Spijkervet FKL. Effective use of selective oral flora elimination on mucositis. In Spijkervet FKL e Irradiation Mucositis, 1st ed. Copenhagen: Munksgaard 1991:84-102.
54. Myers RAM, Marx RE. Hyperbaric oxygen in postradiation head and neck surgery. NC1 Monographs 1990; 9:151-157.