Alessandro Luigi Rossi1
Laura Serioli2
Andrea Montinari2
Alberto Clivio2
Matteo Chiapasco3
1Specialista in Chirurgia Odontostomatologica, Unità di Chirurgia Orale, Clinica Odontoiatrica - Dipartimento di Medicina, Chirurgia e Odontoiatria A.O. San Paolo - Università degli Studi di Milano
2Medico Frequentatore - Unità di Chirurgia Orale, Clinica Odontoiatrica - Dipartimento di Medicina, Chirurgia e Odontoiatria A.O. San Paolo - Università degli Studi di Milano
3Specialista in Chirurgia Maxillo-Facciale, Direttore Unità di Chirurgia Orale, Clinica Odontoiatrica - Dipartimento di Medicina, Chirurgia e Odontoiatria A.O. San Paolo - Università degli Studi di Milano
Obiettivi. Scopo di questo lavoro è una revisione della letteratura relativa alle patologie benigne ostruttive e da stravaso delle ghiandole salivari, alle loro varianti cliniche, ai loro quadri istologici, all’eziopatogenesi e alle relative alternative terapeutiche.
Metodi. La ricerca è stata eseguita utilizzando come motori di ricerca Pubmed e Cochrane e utilizzando come parole chiave: mucocele, sialocisti e ranula. I lavori scientifici valutati sono tutti in lingua inglese e italiana pubblicati tra il 1970 e il 2010. Sono state incluse nella ricerca revisioni sistematiche della letteratura, studi clinici, case report e case series.
Risultati e conclusioni. Le patologie delle ghiandole salivari minori sono alquanto frequenti nella popolazione (per i mucoceli la frequenza si aggira intorno allo 0,4- 0,8%) e si tratta spesso di lesioni originate dalle ghiandole salivari stesse o dalle loro componenti duttali. Le caratteristiche cliniche e la ricorrenza sono in genere patognomoniche per la diagnosi. Una prima importante classificazione viene fatta sulla base eziopatogenetica, distinguendo cisti da stravaso e cisti da ritenzione. Un’ulteriore suddivisione altrettanto importante riguarda le varianti di mucoceli e ranule; vengono descritte nel nostro lavoro le loro caratteristiche cliniche e istologiche. Infine, sono state analizzate le possibilità terapeutiche considerando le tecniche tradizionali e quelle più innovative evidenziandone vantaggi e svantaggi.
Ranulas and mucoceles of the oral cavity: etiology variations and treatment. Review of the literature
Objective. The purpose of this review was to analyze publications related to cysts of minor salivary glands, to their variability, to the histologic features, to the etiopathogenesis and relative therapeutic choice.
Methods. The research was made in Pubmed and Cochrane using as keywords: mucocele, sialocyst and ranula. Publications evaluated were in italian and english language published between 1970 and 2010. Sistematic review of the literature, clinical studies, case report and case series were included in the present study.
Results and conclusions. Pathologies affect minor salivary glands are quite common in the population (the frequency for mucocele is about 0,4-0,8%). This kind of lesion often originate from the salivary gland or from their duct. Clinical features and recurrence are pathognomonic for the diagnosis. A first classification is based on eziopathogenesis, distinguishing between extravasation and retention cysts. Another important classification in mucoceles and ranulas is presented in this work, explaning clinical and histologic features. Therapeutic choice are analyzed, considering the traditional technique versus new one, underling advantages and disvantages.
Il cavo orale presenta oltre alle ghiandole salivari maggiori (parotide, sottomandibolare e sottolinguale) un numero molto maggiore di ghiandole salivari minori localizzate nella sottomucosa di labbra, mucosa geniena, palato e pavimento orale. Queste ghiandole possono andare incontro a fenomeni degenerativi che danno luogo a neoformazioni di aspetto cistico caratterizzate da cavità ripiene di liquido mucinoso1. I disturbi delle ghiandole salivari minori, dette anche accessorie, sono alquanto comuni e nella stragrande maggioranza dei casi si tratta di patologie benigne1 originate dalle ghiandole stesse. Queste lesioni comprendono due entità patologiche con diversi quadri istologici: i mucoceli e le ranule.
Materiali e metodi
Per questa revisione è stata presa in considerazione la letteratura riguardante mucoceli e ranule, in tutte le loro forme e varianti, con particolare riguardo a studi contenenti loro eziopatogenesi e trattamento. Sono stati inclusi nella ricerca revisioni sistematiche della letteratura, studi clinici e studi case report, considerando la letteratura più recente ma non tralasciando revisioni sistematiche o studi con elevato numero di casi clinici. Sono stati utilizzati come motori di ricerca Pubmed e Cochrane inserendo come parole chiave: mucocele, sialocisti e ranula.
Risultati
Mucocele, dal latino mucus-coele2, è una cavità ripiena di muco o di materiale mucoide, è il risultato della rottura di un dotto di una ghiandola salivare con stravaso di muco nei tessuti molli circostanti3. All’esame clinico si manifesta come un rigonfiamento tondeggiante e circoscritto della mucosa, circondato da epitelio o ricoperto da tessuto di granulazione1,4, trasparente o di colorito bluastro di dimensione variabile, fluttuante e soffice alla palpazione. Sono lesioni asintomatiche, tendono a recidivare, possono causare discomfort interferendo con l’eloquio, la masticazione o la deglutizione. Rappresentano la patologia più comune associata alle ghiandole salivari minori e sono la seconda lesione benigna in ordine di frequenza tra le neoformazioni dei tessuti molli del cavo orale dopo il fibroma traumatico1,3,4. Colpiscono in egual misura entrambi i sessi e tutte le classi d’età, con un picco di incidenza tra i 10 e 29 anni2.
L’incidenza di tali lesioni è circa di 2.5/1000 individui (soprattutto nelle ghiandole secernenti mucosa: 0,4%-0,8% della popolazione)1. La ranula, dal latino rana2, è un mucocele localizzato nella parte anteriore del pavimento orale, lateralmente alla linea mediana. Il nome è legato alla somiglianza di questa lesione mucosa al ventre gonfio di una rana2,3. Ha origine da un danno di uno dei dotti escretori della ghiandola sottolinguale o più raramente della ghiandola sottomandibolare3. Clinicamente si presenta come una tumefazione bluastra1,5 del pavimento orale, a crescita lenta5, fluttuante, unilaterale e di dimensioni variabili3,6; nel caso in cui raggiunga dimensioni considerevoli può oltrepassare la linea mediana e determinare uno spostamento della lingua3.
Anche questa lesione è spesso asintomatica, può però causare discomfort e può ulcerarsi durante la masticazione; come i mucoceli può andare incontro a rottura spontanea rilasciando materiale mucoso3 dando una falsa impressione di guarigione. Studi condotti1 sulla popolazione colpita hanno evidenziato una predilezione per il sesso femminile (56,47%) e un’incidenza in tutte le fasce d’età (sono riportati casi di ranule pediatriche all’età di 17 giorni5 fino a 80 anni1).
Eziopatogenesi di mucoceli e ranule
Dal punto di vista eziologico e istopatologico è possibile effettuare una distinzione in base all’origine dei mucoceli. Essi possono presentarsi in seguito a un trauma o a un’ostruzione della ghiandola salivare minore. Sulla base di questa suddivisione si parla rispettivamente di “cisti da stravaso” e di “cisti da ritenzione”1-4 o sialocisti. Tale classificazione non viene correntemente adottata da tutti gli Autori; alcuni, infatti, utilizzano il termine “mucocele” per entrambi i tipi di lesione creando non poche difficoltà di comparazione ed elaborazione di dati7. Le più comuni sono le prime, che rappresentano circa l’80% dei mucoceli1,2,4,6,8,9. Il trauma del dotto escretore della ghiandola salivare accessoria provoca fuoriuscita e accumulo di muco nel circostante tessuto connettivo e conseguente risposta infiammatoria. Sono pseudo cisti le cui pareti sono costituite da tessuto di granulazione contenenti saliva e caratterizzate dalla presenza di un infiltrato infiammatorio costituito da neutrofili e macrofagi3.
La lesione è completamente localizzata all’interno della lamina propria3. All’esame clinico si presentano come rigonfiamenti bluastri, traslucenti, di dimensioni variabili comprese tra 1 e 1.5 cm4,8,10; la sede d’insorgenza più frequente è il labbro inferiore con un’incidenza del 60-80%1,3,11; altre sedi tipiche sono: guancia, superficie ventrale della lingua12, pavimento orale e trigono retromolare11. Questa forma di mucocele è più frequente nei pazienti di età inferiore ai 30 anni. La ghiandola salivare adiacente è danneggiata e può presentare dilatazione del dotto, fibrosi e segni di flogosi aspecifica3. Le cisti da ritenzione sono il risultato di un’ostruzione del dotto escretore dovuto a sialolitiasi, cicatrici periduttali o tumore invasivo1,11. Il restringimento dell’orifizio duttale non permette un adeguato flusso salivare con conseguente distensione duttale che può anche causare l’ingrossamento della ghiandola. Formano cavità cistiche ben definite caratterizzate dal punto di vista istologico da una parete epiteliale con un doppio strato di cellule cuboidali o squamose (epitelio del dotto)3, contenenti cellule mucose o frammenti di calcoli salivari e il tessuto connettivo della cisti può presentare un infiltrato infiammatorio2,11,12.
La cavità cistica può avere aspetto uniloculare o multiloculare3. All’esame obiettivo la mucosa appare normocromica senza segni di infiammazione periferica, mobile alla palpazione con dimensioni variabili tra i 3 e i 10 mm7,10. A differenza delle cisti da stravaso sono uniformemente distribuite in tutti i territori caratterizzati dalla presenza di ghiandole salivari accessorie7,10,raramente si localizzano al labbro inferiore; le regioni in cui si presentano sono: labbro superiore, palato, mucosa alveolare, gengiva aderente, pavimento orale e seno mascellare. Colpiscono con maggiore frequenza i soggetti anziani3. Il restringimento del dotto si può presentare in pazienti che fanno uso frequente di collutori contenenti perossido d’idrogeno, soluzioni antiplacca e paste dentifrice per il controllo del tartaro che possono essere potenti irritanti1,11. Inoltre, in letteratura sono riportate alcune varianti di mucocele: mucocele superficiale13, mucocele della ghiandola di Blandin-Nuhn12 e mucocele con mixoglobulosi13. La prima variante, il mucocele superficiale13, descritto per la prima volta nel 1988, è un tipo di lesione che si osserva soprattutto nel palato molle e nella zona retromolare e può presentarsi in forma singola o multipla3,7,13.
Pare avere maggiore incidenza nel sesso femminile in un’età inferiore ai 30 anni13. All’esame obiettivo si manifesta come una lesione bollosa sottoepiteliale7 di piccole dimensioni (1-4 mm di diametro)3,7,13. La sua patogenesi è legata a uno stravaso di muco nella parte alta della lamina propria che crea un sollevamento e un distacco della lamina epiteliale3. Questa lesione è stata dettagliatamente descritta da Eveson13 e presenta caratteristiche cliniche peculiari: dimensioni inferiori a 5mm e aspetto vescicoloso chiaro/traslucente7,13. Altra variante riportata in letteratura è il mucocele con mixoglobulosi13: questo è caratterizzato da strutture globulari eosinofile localizzate nel lume o a crescita esofitica dalla parete del mucocele7. Recentemente sono state osservate modificazioni in senso metaplastico all’interno di mucoceli orali: in questa situazione si evidenzia una parziale sostituzione della parete di tessuto di granulazione con una membrana con pieghe villose, una banda sottile di matrice eosinofila e un’area sottostante caratterizzata dalla presenza di istiociti, fibroistiociti e/o cellule giganti7. Il mucocele della ghiandola di Blandin-Nuhn12 origina da un gruppo di ghiandole salivari localizzate sulla superficie ventrale della lingua, su entrambi i lati rispetto alla linea mediana; si tratta di ghiandole a secrezione mucosa e sierosa.
La ritenzione salivare associata a gonfiore può portare questa ghiandola a risalire in superficie mostrandosi come una massa soffice, indolore, fluttuante, di forma ovale e di colore rosa-bluastro14. Colpisce entrambi i sessi in egual misura e, nonostante sia considerata una variante rara, alcuni studi dimostrano che è il secondo tipo di mucocele più frequente14,15. I mucoceli si presentano come rigonfiamenti soffici, lisci, asintomatici, di colore che va dal blu intenso al normale colore della mucosa orale. La mucosa sovrastante è normocromica nel caso in cui la lesione sia localizzata in profondità, mentre assume colorito bluastro nel caso in cui la lesione sia più superficiale6. Il colore blu intenso deriva dalla cianosi dei tessuti e dalla congestione vascolare associata, con stiramento dei tessuti sovrastanti e la tipica traslucenza dovuta all’accumulo di fluidi sottostante. Sono caratterizzati dalla capacità di modificare rapidamente le loro dimensioni, sia nel senso di espansione, che di rapida riduzione. Nella maggior parte dei casi queste lesioni vanno incontro a rottura spontanea o traumatica poche ore dopo la loro formazione con fuoriuscita di fluido mucoide e viscoso2,13; questo può dare un’errata impressione di guarigione poiché la lesione decresce o scompare.
In tale situazione, invece, il secreto si accumula nuovamente e la lesione va incontro a recidiva2,6,11,12,16,17. Nel caso in cui vada incontro a ripetute rotture la lesione può diventare nodulare, di consistenza dura alla palpazione, e in questa situazione la rottura diventa più difficile2,14,15 (Grafico 1). Dal punto di vista eziologico la ranula è prodotta dalla rottura traumatica del dotto escretore o dalla rottura di acini ghiandolari in seguito a ostruzione della ghiandola sottolinguale (circa il 90% dei casi) o, in un minore numero di situazioni, a livello della ghiandola sottomandibolare3,19. La fuoriuscita di muco nel circostante tessuto connettivo induce una reazione infiammatoria nella quale i macrofagi demoliscono la componente organica mentre quella inorganica e l’acqua vengono drenate dal sistema linfatico; il tessuto di granulazione forma tessuto fibroso, il quale riduce la fuoriuscita di saliva e talvolta può anche sigillare l’origine dello stravaso. In genere l’attività secretoria della ghiandola sottolinguale persiste nonostante la fibrosi e in alcuni casi si instaura un equilibrio tra la fuoriuscita di saliva e la sua rimozione da parte dei macrofagi e del sistema linfatico19.
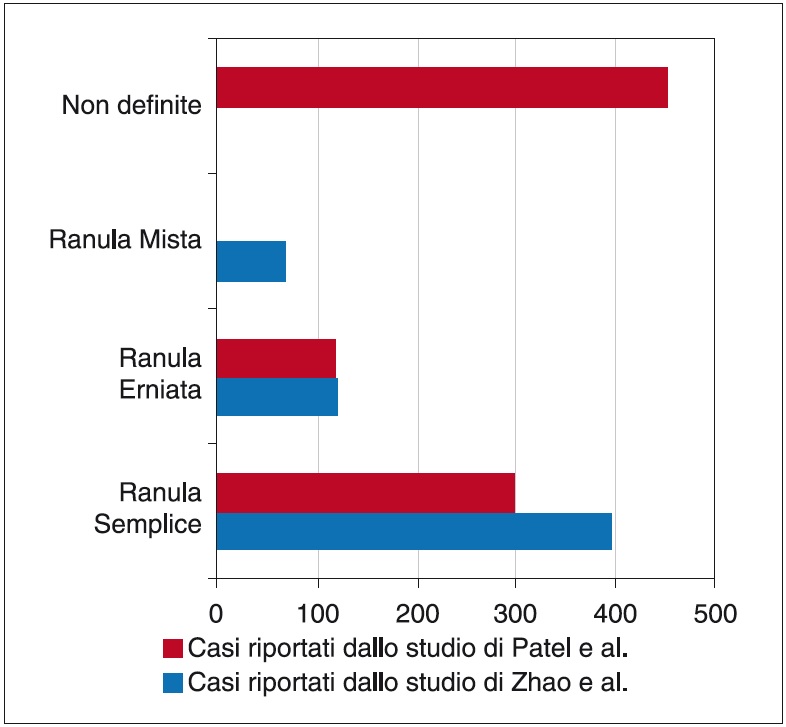
Diversamente, l’attività secretoria della ghiandola sottomandibolare è meno resistente e un’ eventuale fuoriuscita di materiale mucinoso è bloccata dalla formazione del tessuto fibroso19. La classificazione delle ranule è legata alla loro estensione e al rapporto con il muscolo miloioideo e le fasce cervicali19: si parla di ranula semplice1,5, ranula erniata o profonda5,19 e ranula mista1,5 (Grafico 2). La prima, la più frequente in tutte le classi di età1, è una cisti da ritenzione o pseudo cisti da stravaso localizzata interamente al di sopra del muscolo miloioideo3,5,19,20, clinicamente si osserva solo a livello intraorale5, è di colorito bluastro, soffice e fluttuante1. In alcuni pazienti si può osservare un’erniazione della ranula attraverso lo iato del muscolo miloioideo e le fasce cervicali, che determina la comparsa di una tumefazione a livello del collo in zona sottomandibolare laterale: in questo caso si parla di ranula erniata o profonda3. Le caratteristiche di questa lesione sono: colore normale della mucosa, soffice e non mobile rispetto ai piani profondi, sintomatica1. Sono state proposte numerose ipotesi riguardanti l’origine di questa lesione: deiscenza parziale congenita o fragilità del muscolo miloioideo5 e trauma meccanico del dotto di Rivino19.
La ranula mista mostra un rigonfiamento intraorale e a livello del collo1. Gli aspetti istologici della ranula sono legati al meccanismo patogenetico che ne ha determinato l’origine3. Si viene a formare una pseudo cisti caratterizzata da una parete di tessuto connettivo o di granulazione1 e assenza di rivestimento epiteliale, anche se in alcuni casi è stato osservato epitelio di rivestimento duttale1. Il tessuto connettivo circostante mostra segni di flogosi1, la cavità cistica contiene muco, istociti, polimorfo nucleati e linfociti1. Gli acini salivari mostrano segni di infiammazione cronica e i dotti appaiono dilatati. Non sono state evidenziate differenze istologiche nei tre diversi sottotipi di ranule1.
Diagnosi
L’anamnesi e l’esame obiettivo sono i punti cruciali del processo diagnostico, grazie alla facile accessibilità e ispezionabilità delle lesioni. In casi particolari, la diagnosi può richiedere l’ausilio di tecniche diagnostiche di primo e secondo livello come radiografia, ecografia, tomografia computerizzata (TC) e risonanza magnetica nucleare (RMN) per visualizzare con maggiore dettaglio forma, diametro, posizione della lesione e rapporti con le strutture anatomiche adiacenti21. L’ecografia mostra i mucoceli come cavità cistiche che possono contenere processi fibrillari prodotti dai fibroblasti. Altra tecnica diagnostica utile è rappresentata dall’agoaspirato con ago sottile per valutare pazienti con ingrossamenti e noduli delle ghiandole salivari. La differenziazione tra mucoceli e lesioni di origine vascolare è fondamentale in sede pre-operatoria per evitare sanguinamenti profusi22. In alcune situazioni può rendersi necessario eseguire una biopsia incisionale per escludere lesioni come il cistoadenolinfoma di Warthin, il cui trattamento è delegato all’ambito maxillo-facciale6.
Alcuni Autori includono nella diagnosi differenziale anche carcinoma epidermoide e adenoma pleomorfo3. Il mucocele superficiale, per la sua presentazione clinica, può andare in diagnosi differenziale con malattie vescicolo bollose come il pemfigoide delle membrane mucose3,7. Il mucocele della ghiandola di Blandin- Nuhn entra in diagnosi differenziale con il granuloma piogenico o papilloma squamoso in base al grado di vascolarizzazione e alla profondità della lesione14. In genere ranula semplice e ranula mista non creano problemi diagnostici1, la ranula profonda, invece, entra in diagnosi differenziale con altre lesioni come cisti dermoide3,6, neoplasie benigne e maligne delle ghiandole salivari, neoplasie mesenchimali, cisti del dotto tireoglosso, malformazioni vascolari e linfatiche1.
La diagnosi generalmente è clinica ma in caso di dubbio diagnostico è utile eseguire esami di secondo livello e un agoaspirato: nella ranula la sostanza prelevata ha colorito giallastro e consistenza mucosa con un’elevata quantità di amilasi e proteasi5 compatibili con la secrezione ghiandolare.
Trattamento
La letteratura descrive diverse possibilità di intervento per i muco celi; la scelta terapeutica è legata a diversi fattori, primo tra tutti le dimensioni della lesione. Vediamo, qui di seguito, le alternative che abbiamo.
- Escissione completa1.
- Marsupializzazione associata o meno all’utilizzo di garze iodoformiche1 (marsupializzazione con zaffatura). Questa tecnica è da privilegiare nel caso in cui ci si ritrovi in corrispondenza di strutture anatomiche importanti (arteria labiale, nervo mentale); in tal caso l’escissione diretta o la dissezione della lesione potrebbero comportare l’insorgenza di complicanze intra-operatorie. Molti sostengono che questa tecnica sia idonea anche per il trattamento di mucoceli del palato in cui l’accesso chirurgico può risultare problematico. La marsupializzazione permette di rendere meno invasive le procedure chirurgiche successive11,23; inoltre, se associata all’utilizzo di garze iodoformiche previene la precoce chiusura della ferita con guarigione spontanea in 7-10 giorni24,25.
- Criochirurgia. Viene utilizzata una sonda a punta arrotondata con diametro di 10mm. Alcuni Autori riportano l’esecuzione di 3 applicazioni nello stesso sito nella medesima seduta, senza necessità di anestesia1,26-28. I pareri riguardanti tale metodica sono contrastanti, alcuni riportano successi26-28, altri, invece, associano a questo tipo di trattamento un elevato tasso di recidiva con conseguente necessità di reintervento2.
- Ablazione con laser CO2. Questa metodica gode di grande successo per il trattamento delle lesioni dei tessuti molli del cavo orale e anche per interventi di chirurgia maggiore. I vantaggi riportati sono un campo operatorio esangue, incisioni precise, permette di semplificare le manovre chirurgiche, riduce l’edema e il dolore post-operatorio e minimizza le cicatrici chirurgiche2,29.
- Iniezione di corticosteroidi intralesionale. È una procedura che non offre garanzie di successo ed è associata a un’elevata incidenza di recidive2.
- Colla di fibrina. L’iniezione intralesionale dopo il drenaggio permette una più agevole escissione30,31.
- Agente sclerosante OK-432. Si tratta di un preparato liofilizzato di varietà a bassa virulenza di Streptococcus Pyogenes incubati con benzilpenicillina. L’iniezione intralesionale previa aspirazione del contenuto porta a un’atrofia degli acini ghiandolari e conseguente guarigione32-34.
Alcuni Autori consigliano un approccio iniziale atraumatico attraverso criochirurgia o iniezione intralesionale di corticosteroidi28,35, che ha portato però alla comparsa di numerose recidive con necessità di reintervento con metodica tradizionale. L’utilizzo della procedura convenzionale di escissione chirurgica permette l’enucleazione completa del mucocele attraverso un’accurata dissezione e con la totale rimozione del tessuto patologico prima di procedere alla chiusura della ferita. La lesione deve essere asportata in toto e deve includere anche le ghiandole salivari adiacenti: questo riduce l’incidenza di recidive3,11. La difficoltà di questa procedura è legata alla delicatezza della parete della lesione, con alto rischio di rottura del mucocele, collasso delle pareti e perdita di tutti i riferimenti anatomici e conseguente recidiva. Il laser CO2 è scarsamente penetrante, quindi il suo utilizzo è particolarmente indicato nelle forme superficiali . Sono stati condotti negli anni numerosi studi2 di confronto tra la tecnica chirurgica standard e l’utilizzo del laser. Quest’ultimo permette procedure rapide (3-5 minuti)2 e semplificate rispetto al bisturi che richiede una tecnica meticolosa e precisa con necessità di sutura al termine dell’intervento; altri vantaggi sono minimo danneggiamento delle strutture adiacenti, campo operatorio esangue e pulito, minore edema e dolore post-operatorio2; per questo il laser è particolarmente indicato nei pazienti pediatrici e geriatrici, meno disponibili a sopportare procedure lunghe e indaginose.
Inoltre, tale tecnica riduce il rischio di complicanze (la letteratura riporta parestesia al labbro e sanguinamento) e l’incidenza di recidive; la guarigione della ferita risulta completa in due settimane. L’utilizzo dell’agente sclerosante OK-432 è ad oggi poco documentato in letteratura, con un limitato numero di pubblicazioni scientifiche, le quali però riportano un successo con regressione totale che va dal 69,3% al 100%1,34. Gli effetti collaterali riportati sono iperpiressia persistente (21,9%) e sintomi di infiammazione locale. Le possibilità terapeutiche nel caso della ranula sono diverse e il successo varia dallo 0 al 100% in base al tipo di intervento5,19,20. La spiegazione della disparità di questi risultati è legata alla mancanza di una base scientifica pre-operatoria che valuti anatomia locale e fisiopatologia della lesione18. Rispetto ai mucoceli, il trattamento chirurgico delle ranule merita qualche attenzione in più a causa della maggiore estensione della lesione e delle numerose strutture anatomiche che possiamo trovare in stretta contiguità alla lesione (caruncola linguale, nervo linguale, arterie e vene sottolinguali, rami del nervo ipoglosso)6.
Le possibilità terapeutiche per la ranula orale, sia essa semplice, profonda o mista, sono le seguenti.
- Sialoadenectomia sublinguale18. Questa metodica, non associata alla rimozione della ranula, porta a guarigione nella quasi totalità dei casi (alcuni Autori18 riportano successo nel 100% dei casi) poiché alla base della lesione c’è la ghiandola danneggiata. Nei casi in cui è stata osservata recidiva si è dimostrata una incompleta enucleazione della ghiandola che si prolungava nello iato del muscolo miloioideo19.
- Escissione della ranula associata a sialoadenectomia sublinguale6,19. Secondo alcuni Autori6 rappresenta il trattamento più efficace. La dissezione, tuttavia, può risultare indaginosa per la difficoltà nell’individuare un piano di clivaggio e per il rischio di ledere strutture anatomiche importanti: il rapporto costi-benefici in questa situazione non è favorevole, si tratta di una tecnica operatore-dipendente e per questo non rappresenta la prima scelta terapeutica. Può essere indicata in caso di recidive multiple dopo trattamenti più semplici6.
- Escissione della ranula6. Anche in questo caso l’intervento è fattibile, ma di difficile esecuzione in quanto la parete della ranula è difficilmente clivabile.
- Sialoadenectomia sottomandibolare19. Questa procedura mira alla genesi di una fibrosi post-operatoria che chiuda l’apertura della ghiandola sottolinguale.
- Marsupializzazione6,19. Rappresenta il trattamento più frequente al fine di ridurre la morbilità post-operatoria e consiste nell’asportazione del solo tetto della lesione. La tecnica chirurgica è semplice, ma associata a un’elevata incidenza di recidive che può raggiungere il 90%.
- Marsupializzazione con zaffatura con garze iodoformiche6,19. Questa tecnica viene utilizzata per ridurre l’incidenza di recidiva e prevede il posizionamento di una medicazione che impedisce nelle prime fasi della guarigione la chiusura della ferita chirurgica. Con questa metodica la percentuale di recidive si riduce drasticamente, al di sotto del 10%18.
- Marsupializzazione con CO2 laser. L’utilizzo del laser alla base della ranula coagula i tessuti e chiude l’apertura della ghiandola sottolinguale con conseguente fibrosi. Il laser riduce le complicanze post-operatorie: edema, dolore e sanguinamento5.
- Agente sclerosante OK-432. L’iniezione nel lume della ranula produce infiammazione e fibrosi con un successo che varia dal 77% nel caso di ranula semplice al 59% nei casi di ranula erniata18,19. Questa tecnica è gravata da un minor rischio di complicanze post-operatorie33,34.
- Iniezione di nitrato d’argento18,19. Il nitrato d’argento coagula i tessuti e induce una reazione infiammatoria con fibrosi19.
- Iniezione di tossina botulinica nella ranula e nella ghiandola sottolinguale19. Questa tecnica ha come scopo l’inibizione della secrezione salivare regolata dal sistema parasimpatico. Questo però non blocca totalmente la secrezione salivare, in quanto la ghiandola sottolinguale ha attività secretoria spontanea, si viene quindi a creare un equilibrio tra lo stravaso mucoso e la rimozione di questo da parte dei macrofagi.
- Attesa20. Per i pazienti pediatrici è opportuno osservare la lesione per 5-6 mesi; solo se la ranula non mostra segni di risoluzione spontanea durante questo periodo si può procedere con la chirurgia. Nel caso di ranule sintomatiche e di diametro superiore ai 2 cm sono sufficienti 3 mesi di osservazione prima di procedere con la chirurgia.
- Scleroterapia20. Non esistono a oggi studi in letteratura che descrivano i risultati di questa tecnica non chirurgica. Nei casi pediatrici viene effettuata in anestesia generale per la scarsa collaborazione del piccolo paziente20.
Dall’analisi delle varie possibilità terapeutiche si evince che l’asportazione della ranula e della ghiandola salivare danneggiata annessa rappresentano il trattamento di elezione per i casi di ranula orale semplice e profonda. L’asportazione della ranula non è strettamente necessaria poiché non si tratta di una vera e propria cisti; questo riduce notevolmente le possibili complicanze di lesioni neurologiche. Tra le possibili complicanze abbiamo la lesione del nervo linguale con conseguente ipoestesia-anestesia linguale, lesione del dotto di Wharton e della caruncola linguale, ematoma, sanguinamento e infezione postoperatoria18.
Conclusioni
Ranule e mucoceli del cavo orale sono lesioni di riscontro abbastanza frequente. È possibile attuare una distinzione in base all’eziopatogenesi: per i mucoceli parliamo di cisti da stravaso e cisti da ritenzione, per le ranule parliamo di ranula semplice, ranula profonda e ranula mista. Il trattamento di questo tipo di lesioni viene eseguito nella maggior parte dei casi tramite metodiche tradizionali più o meno conservative che prevedono l’asportazione della lesione associata o meno all’asportazione della ghiandola salivare.
Corrispondenza
Alessandro Luigi Rossi
Unità di Chirurgia Orale
Clinica Odontoiatrica - Dipartimento di Medicina,
Chirurgia e Odontoiatria
A.O. San Paolo - Università degli Studi di Milano
via Beldiletto, 1/3 - 20142 Milano
Tel. 02.50319014
alessandroluigirossi@gmail.com
1. Re Cecconi D, Achilli A, Tarozzi M, Lodi G, Demarosi F, Sardella A, Carrassi A. Mucoceles of the oral cavity: A large case series (1994-2008) and a literature review. Med Oral Patol Oral Cir Bucal 2010;14:551-6.
2. Yagüe-Garcìa J, España-Tost AJ, Berini-Aytés L, Gay-Escoda. Treatment of oral mucocele – scalpel versus CO2 laser. Med Patol Oral Cir Bucal Sep 2009;14:469-74.
3. Ficarra G. Manuale di Patologia e Medicina Orale. 3a edizione Ottobre. Milano: Mc Graw-Hill, 2006.
4. Granholm C, Olsson Bergland K,Walhjjalt H, Magnusson B. Oral mucoceles; extravasation cysts and retention cysts. A study of 298 cases. Swedish Dental J 2009;33:125-30.
5. Zhao YF, Jia Y, Chen XM, Zhang WF. Clinical review of 580 ranulas. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2004 Sep;98:281-87.
6. Chiapasco M. Manuale illustrato di Chirurgia Orale, Seconda Edizione. Milano: Elsevier Masson, 2006.
7. Chi A, Lambert PR 3rd,Richardson MS, Neville BW. Oral mucoceles: a clinicopathologic review of 1,824 cases, including unusual variants. J Oral Maxillofac Surg 2011 Apr;69:1086-93.
8. Regezi J, Sciubba J, Jordan R. Oral Pathology; Clinical-Pathologic Correlations, 5th Edition. W.B. Sounders Company, 2007.
9. Seifert G, Donath K, von Gumberz C. Mucoceles of the minor salivary glands. Extravasation mucoceles (mucus granulomas) and retention mucoceles (mucus retention cysts)(author’s transl). HNO 1981 Jun; 29:179-91.
10. Seifert G, Miehlke A, Haubrich J, Chilla R. Diseases of the salivary glands; pathology, diagnosis, treatment, facial nerve surgery. Stuttgart: George Thieme Verlag, 1986.
11. Baurmash HD. Mucoceles and ranulas. J Oral Maxillofac Surg 2003;61:369-78.
12. Guimarães MS, Hebling J, Filho VA, Santos LL, Vita TM, Costa CA. Extravasation mucocele involving the ventral surface of the tongue (glands of Blandin-Nuhn). Int J Paediatr Dent 2006;16:435-9.
13. Bermejo A, Aguirre JM, Lòpez P, Saez MR. Superficial mucocele: report of 4 cases. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1999;88:469-72.
14. de Camargo MP, Bönecker M, Furuse C, Thomaz LA, Teixeira RG, de Araújo VC. Mucocele of the gland of Blandin-Nuhn: histological and clinical findings. Clin Oral Invest 2009 Sept;13:351-3.
15. Jinbu Y, Kusama M, Itoh H, Matsumoto K, Wang J, Noguchi T. Mucocele of the glands of Blandin Nuhn: clinical and histopathologic analysis of 26 cases. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2003;95:467-70.
16. Jinbu Y, Tsukinoki K, Kusama M, Watanabe Y. Recurrent multiple superficial mucocele on the palate: Histopathology and laser vaporization. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2003;95:193-7.
17. Harrison JD. Salivary mucoceles. Oral Surg Oral Med Oral Pathol 1975;39:268-78.
18. Patel MR, Deal AM, Shockley W. Oral and Plunging Ranulas: What is the Most Effective Treatment? The Laryngoscope 2009;119:1501-9.
19. Harrison JD. Modern management and pathophysiology of ranula: literature review. Head Neck 2010 Oct;32:1310-20.
20. Seo JH, Park JJ, Kim HY, Jeon SY, Kim JP, Ahn SK, Hur DG, Kim DW, Lee JS. Surgical management of intraoral ranulas in children: an analysis of 17 pediatric cases. Int J of Pediatric Otorhinolaryngol 2010;74:202-5.
21. Baurmash H. The etiology of superficial oral mucoceles. J Oral Maxillofac Surg 2002;60:237-8.
22. Shah GV. MR imaging of salivary glands. Magn Reson Imaging Clin N Am 2002;10:631-62.
23. Delbem AC, Cunha RF, Vieira AE, Ribeiro LL. Treatment of mucus retention phenomena in children by the micro-marsupialization technique: case reports. Pediatr Dent 2000;22:155-8.
24. Baurmash HD. Marsupialization for treatment of oral ranula: a second look at the procedure. J Oral Maxillofac Surg 1992;50:1274-9.
25. Layfield LJ, Gopez EV. Cystic lesion of the salivary glands: cytologic features in fineneedle aspiration biopsies. Diagn Cytopathol 2002;27:197-204.
26. Pandit RT, Park AH. Management of pediatric ranula. Otolaryngol Head Neck Surg 2002;127:115-8.
27. Bodner L, Tal H. Salivary gland cysts of the oral cavity: clinical observation and surgical management. Compendium 1991;12:150-2.
28. Twetman S, Isaksson S. Cryosurgical treatment of mucocele in children. Am J Dent 1990;3:175-6.
29. Niccoli-Filho W, Morosolli AR. Surgical treatment of ranula with carbon dioxide laser radiation. Lasers Med Sci 2004;19:12-4.
30. Cataldo E, Mosadomi A. Mucoceles of the oral mucous membrane. Arch Otolaryngol 1970;91:360-5.
31. Takimoto T, Ishikawa S, Nishimura T, Tanaka S, Yoshizaki T, Komori T, et al. Fibrin glue in the surgical treatment of ranulas. Clin Otolaryngol Allied Sci 1989;14:429-31.
32. Baurmash HD. A case against sublingual gland removal as primary treatment of ranulas. J Oral Maxillofac Surg 2007;65:117-21.
33. Rho MH, Kim DW, Kwon JS, Lee SW, Sung YS, Song YK, et al. OK-432 sclerotherapy of plunging ranula in 21 patients: it can be a substitute for surgery. AJNR Am J Neuroradiol 2006;27:1090-5.
34. Roh JL. Primary treatment of ranula with intracystic injection of OK-432. Laryngoscope 2006;116:169-72.
35. Wilcox JW, History JE. Nonsurgical resolution of mucoceles. J Oral Surg 1978;36:478.





