Riassunto
La cheratocisti odontogena, dal 2005 classificata dall’Organizzazione Mondiale della Sanità come tumore odontogeno cheratosico, è una lesione benigna, localmente aggressiva, con un’alta tendenza alla recidiva. La sua variante ortocheratinizzata non è inclusa nella classificazione tumorale ed è considerata una cisti odontogena. Poiché l’enucleazione chirurgica si rivela spesso insufficiente per il suo trattamento, ulteriori metodiche sono state proposte con l’intento di rimuovere ogni residuo epiteliale e ridurre il rischio di recidiva, tra cui: l’ostectomia periferica, l’utilizzo della soluzione di Carnoy o della crioterapia con azoto liquido in aggiunta all’enucleazione, la resezione del tumore en-bloc. L’obiettivo del presente lavoro è eseguire una revisione delle pubblicazioni disponibili per far luce sul trattamento più indicato per il tumore odontogeno cheratosico e su eventuali linee guida fornite dalla letteratura scientifica.
Summary
Current protocols in the treatment of keratocystic odontogenic tumor (keratocyst): a literature review
The odontogenic keratocyst, classified by the World Health Organization as keratocystic odontogenic tumor since 2005, is a benign lesion, locally aggressive, with a high tendency to recur. Its ortho-keratinized variant is not included in the tumor classification and it is considered as an odontogenic cyst. As the surgical enucleation is often insufficient for its treatment, additional methods have been proposed with the aim to remove any epithelial remnants and to reduce the risk of recurrence, including: the peripheral ostectomy, the use of Carnoy’s solution or cryotherapy with liquid nitrogen and the resection of the tumor en-bloc. The aim of this paper is to perform a review of available publications to shed light on the best treatment for the keratocystic odontogenic tumor and on any guidelines provided by the scientific literature.
La cheratocisti odontogena, descritta per la prima volta da Philipsen nel 1956, è una lesione benigna, localmente aggressiva, con un’alta tendenza alla recidiva, tanto che dal 2005 è stata riclassificata dall’Organizzazione Mondiale della Sanità come tumore odontogeno cheratosico. La sua variante ortocheratinizzata non è inclusa nella classificazione tumorale ed è considerata una cisti odontogena. Si localizza nelle ossa mascellari ma vi è evidenza di sviluppo di cheratocisti anche nei tessuti molli. Rappresenta tra il 2 e l’11% delle cisti mascellari, può presentarsi a tutte le età con un rapporto uomo:donna di circa 2:1. Origina probabilmente da resti della lamina dentaria che persistono nei tessuti subepiteliali al termine dell’odontogenesi e può manifestarsi in varie forme cliniche; è di solito uniloculare ma può essere anche pluriloculare e talvolta associarsi ad altre patologie sotto forma di sindrome (sindrome di Gorlin-Goltz o sindrome nevo-baso-cellulare). Quest’ultima è caratterizzata da carcinomi baso-cellulari cutanei, presenza di cheratocisti odontogene multiple, coste bifide, protuberanze in regione parietale e frontale, calcificazioni della falce cerebrale, fossette palmari e plantari, ereditarietà autosomica dominante. Spesso asintomatiche, le cheratocisti, che d’ora in avanti chiameremo tumori cheratosici, possono essere scoperte occasionalmente in seguito a indagini radiografiche oppure si possono manifestare clinicamente in stadi avanzati, dopo aver già eroso le corticali mascellari o creato dislocazione di strutture anatomiche o di elementi dentari o a seguito di sovrainfezione. Il comportamento aggressivo di questa lesione è stato ascritto all’alta cellularità del suo epitelio e a un’attività mitotica rilevante; numerosi studi hanno inoltre dimostrato, a supporto della sua natura tumorale, l’evidenza della perdita di alcuni alleli in determinati geni per la soppressione dei tumori o alterazioni epigenetiche di geni oncosoppressori1. Il metodo tradizionale per il trattamento del tumore cheratosico, se escludiamo la marsupializzazione (peraltro usata raramente, anche alla luce della riclassificazione della lesione come tumore), è l’enucleazione chirurgica ma, a causa delle frequenti recidive, questo approccio si rivela spesso insufficiente. Il sottile epitelio che la delimita spesso non riesce a essere completamente rimosso e cisti satelliti o cisti figlie possono svilupparsi in seguito all’enucleazione della lesione primaria. Ulteriori trattamenti sono stati proposti, come l’ostectomia periferica, la resezione del tumore e dell’osso periferico in blocco, oppure l’utilizzo della soluzione di Carnoy o della crioterapia con azoto liquido in aggiunta all’enucleazione. Tutti hanno l’intento di rimuovere completamente ogni residuo epiteliale per ridurre il rischio di recidiva. L’obiettivo del presente lavoro è eseguire una revisione delle pubblicazioni disponibili per far luce sul trattamento più indicato per il tumore odontogeno cheratosico e su eventuali linee guida fornite dalla letteratura scientifica.
Materiali e metodi
Criteri di inclusione. La base di questa revisione è rappresentata dagli articoli clinici pubblicati in lingua inglese nei quali si fa espressamente riferimento al trattamento del tumore cheratosico. Sono stati inclusi: revisioni della letteratura, studi retrospettivi, studi prospettici e case series ed esclusi i case report a causa dell’insufficiente informazione fornita da una limitata casistica per poter trarre conclusioni significative sul trattamento.
Tipo di interventi. Sono stati analizzati gli studi relativi alle varie metodiche di trattamento del tumore cheratosico associate o meno ad altre sindromi (sindrome di Gorlin-Goltz o carcinoma nevo-baso-cellulare). Sono stati invece esclusi dalla trattazione tutti quegli articoli riferiti al trattamento, oltre che dei tumori cheratosici, anche di altre cisti odontogene, che non facessero distinzioni nette tra le metodiche di trattamento adottate nel caso dei tumori cheratosici.
Metodo di ricerca. Gli articoli pubblicati in lingua inglese sono stati selezionati con una ricerca computerizzata su PUBMED senza limiti temporali. Le parole chiave utilizzate per la ricerca comprendono: odontogenic keratocyst, keratocyst, odontogenic tumor, treatment, surgery. Ulteriori articoli sono stati identificati dalla bibliografia degli articoli selezionati.
Criteri di selezione ed estrazione dei dati. I titoli e gli abstract di tutti gli articoli selezionati sono stati esaminati. Gli studi che rispondevano ai criteri di inclusione o dei quali vi erano sufficienti dati nel titolo e nell’abstract per prendere una chiara decisione sono stati analizzati “full text”.
Risultati
Sono stati individuati più di 2000 titoli di articoli: tra questi sono stati selezionati 210 studi e infine 49 pubblicazioni sono state incluse nella presente revisione. Numerosi studi in letteratura trattano i tumori cheratosici: molti si concentrano sulle caratteristiche istologiche di queste lesioni, sul comportamento aggressivo che ne evidenzia la similitudine con gli altri tumori odontogeni, sulla ricerca e sulle future possibilità terapeutiche basate su un approccio molecolare per ridurre la necessità di chirurgie invasive1-3. Al contrario, pochi articoli trattano con un approccio sistematico il trattamento. Sebbene non venga sempre specificato il numero di pazienti inclusi nello studio e il numero complessivo delle lesioni trattate, sono stati analizzati oltre 2400 casi di tumori odontogeni cheratosici su più di 2300 pazienti. Sono state identificate 8 revisioni1,2,4-9, 1 studio prospettico10, 38 studi retrospettivi11-48 e 2 case series49-50. Molti studi retrospettivi analizzano, all’interno di un arco temporale, i tumori cheratosici trattati con metodiche differenti e la percentuale di recidive10-13,17-22,24,26,27,30,32-33,35,37,39-42,44-46,48. L’incidenza di recidive riportate dopo il trattamento dei tumori cheratosici varia tra lo 0% e il 62%, in base alla metodica utilizzata. Alcuni Autori analizzano un’unica modalità di trattamento: l’enucleazione14,15,36,47, la marsupializzazione50, l’enucleazione associata a crioterapia con azoto liquido25,34,49, l’iniziale enucleazione seguita nei casi di recidive dalla resezione29,43, la resezione28. L’utilizzo di decompressione o marsupializzazione è stato proposto sia come trattamento preliminare alla enucleazione per ridurre il volume della cavità cistica23,31 sia come trattamento definitivo50. La decompressione e l’irrigazione dei tumori cheratosici per alcuni mesi sembrano essere in grado di cambiare l’istologia dell’epitelio cistico esitando spesso in una perdita della cheratinizzazione51. È dimostrato che isole epiteliali o microcisti siano localizzate esclusivamente nella mucosa cistica e non nell’osso e che per ridurre il rischio di recidiva sia importante rimuovere ogni possibile residuo mucoso.
Alla luce di questa evidenza viene argomentato in letteratura un approccio chirurgico razionale al trattamento di questa lesione da Stoelinga e Voorsmith10,38,44,52. Poiché il tumore odontogeno cheratosico deve essere messo in diagnosi differenziale con l’ameloblastoma, viene inoltre proposto un albero decisionale per il trattamento delle due tipologie di lesioni53. Vengono citati anche trattamenti meno comuni, come la “Brosch procedure” che prevede la rimozione della corticale vestibolare alla lesione per permettere al chirurgo di visualizzare ed enucleare completamente il tumore54, oppure l’enucleazione e il curettage di lesioni di grandi dimensioni sotto visione endoscopica, sempre nell’intento di poter visualizzare meglio l’intera area di intervento55. Sebbene alcuni studi suggeriscano l’utilizzo di innesti ossei dopo l’enucleazione, è dimostato che la rigenerazione ossea avviene spontaneamente dopo la rimozione di lesioni cistiche anche ampie senza necessità di utilizzare materiali da riempimento56. Questo semplifica la procedura chirurgica, riduce i costi economici e biologici e il rischio di complicanze post-operatorie. L’utilizzo della resezione “en-bloc” come trattamento iniziale sembrerebbe esageratamente invasiva se non richiesta da particolari situazioni anatomiche, mentre tecniche come l’utilizzo del liquido di Carnoy dopo l’enucleazione presenterebbero un rapporto costi-benefici adeguato all’intento di eliminare i residui cellulari senza incrementare il rischio chirurgico, e comunque nel rispetto delle strutture anatomiche che non devono venirvi in contatto. Allo stesso modo anche la mucosa sovrastante la cisti dovrebbe essere accuratamente rimossa.
Discussione
Alcuni fattori rendono di difficile interpretazione i risultati: la maggior parte degli studi in letteratura è di tipo retrospettivo, non fornisce sufficienti dettagli sul tipo di chirurgia eseguita, riporta un follow-up variabile senza precisare la percentuale di pazienti seguiti in quell’arco di tempo. Nonostante l’incidenza di recidive sia massima nei primi 5 anni, la letteratura riporta casi tardivi, successivi a questo periodo, fino a 25 anni dopo il trattamento iniziale10,21; il follow-up, variabile da studio a studio, prevede spesso dei range che non coprono archi temporali così lunghi. I pazienti affetti contemporaneamente da sindromi, come quella di Gorlin-Goltz, vengono talvolta esclusi dallo studio, talvolta inclusi, non conferendo uniformità ai risultati: nel caso di pazienti sindromici l’incidenza di recidive è maggiore e non dovrebbe essere comparata con casi di isolati tumori cheratosici in pazienti sani. Ugualmente alcuni studi includono solo lesioni con epitelio paracheratosico, altri indifferentemente tutti i tipi istologici oppure non viene specificato il criterio di inclusione. In letteratura esiste una certa confusione riguardo ai protocolli da adottare nel trattamento del tumore odontogeno cheratosico, alcuni Autori propongono delle opzioni di trattamento basate sulla loro esperienza clinica. Vengono proposte modalità di trattamento conservative, come l’enucleazione del tumore cheratosico, l’enucleazione seguita da terapie aggiuntive, la marsupializzazione e la decompressione, oppure modalità più radicali, come la resezione “en-bloc”.
Enucleazione
L’enucleazione consiste nella rimozione chirurgica della lesione, mediante un delicato scollamento dell’epitelio cistico dalle pareti ossee circostanti, mantenendone quando possibile le pareti integre. La rimozione del tumore cheratosico “intero” riduce il rischio di lasciare in situ isole epiteliali che potrebbero dare origine a una recidiva. La lesione enucleata deve essere poi sottoposta a esame istologico. In caso di tumori cheratosici più ampi che hanno già raggiunto il piano periostale e creato dislocazione o erosione delle corticali ossee, la completa escissione risulta difficoltosa a causa delle aderenze del suo epitelio al tessuto periostale o mucoso. Il tentativo di preservare gli elementi dentari adiacenti o le strutture neurovascolari e la difficoltà di accesso in alcune sedi può sommarsi al tentativo di limitare l’estesione del campo chirurgico e portare a una incompleta rimozione, per esempio nei settori posteriori dei mascellari e a livello del ramo mandibolare. Nei casi di sconfinamento al di fuori della capsula periostale la mucosa sovrastante, che viene a fondersi con la parete cistica, deve essere accuratamente rimossa perché costituisce una delle principali fonti di recidiva; in caso di contiguità con elementi dentari, va valutata la più idonea modalità di trattamento per non lasciare residui in loro prossimità (per esempio, estrazione oppure terapia canalare e apicectomia). Il curettage della parete ossea residua con cucchiai chirurgici affilati dovrebbe essere sempre eseguito, soprattutto nei casi in cui la lesione non sia stata rimossa intera. L’obiettivo deve essere quello di eliminare dall’osso e dalla mucosa adiacente tutte le eventuali isole epiteliali o microcisti per minimizzare i rischi di recidiva. L’enucleazione del tumore cheratosico “intero” porta a una frequenza di recidive decisamente inferiore rispetto alla enucleazione dello stesso in pezzi39.
Terapie aggiuntive all’enucleazione
Le più comuni terapie riportate in aggiunta all’enucleazione sono: l’utilizzo della soluzione di Carnoy, l’ostectomia periferica, la crioterapia e l’elettrocauterizzazione.
- La soluzione di Carnoy (una miscela di alcool etilico, cloroformio, acido acetico glaciale e cloruro ferrico) viene utilizzata sulle pareti ossee dopo l’enucleazione chirurgica oppure nella cavità cistica prima della sua rimozione; si tratta di una soluzione cauterizzante che, senza penetrare in profondità, sembra essere in grado di eliminare ogni residuo epiteliale. L’applicazione va evitata in corrispondenza di fasci neurovascolari; nelle cavità policistiche i setti ossei devono essere preventivamente eliminati per consentire una corretta azione del liquido.
- L’ostectomia delle pareti ossee circostanti alla cisti è di ulteriore ausilio per eliminare meccanicamente eventuali resti epiteliali non rimossi con la precedente enucleazione.
- L’elettrocauterizzazione viene consigliata quando le corticali ossee vengono erose dal tumore cheratosico per evitare recidive nei tessuti molli.
- La crioterapia consiste nell’utilizzo di una criosonda all’ossido di azoto a una temperatura di circa -20 °C o inferiore sulle pareti ossee dopo l’enucleazione o sui tessuti molli se la lesione ha perforato il piano osseo sconfinando oltre la capsula periostale. La crioterapia sembra essere in grado di produrre una necrosi cellulare a livello osseo, ma di mantenere integra la componente inorganica; avviene una morte cellulare per danneggiamento diretto dato dalla formazione di cristalli di ghiaccio intra ed extra-cellulari, disturbi osmotici ed elettrolitici. Questa metodica consente una relativa assenza di sanguinamento ed esiti cicatriziali; tuttavia, a causa della difficoltà nel controllare la quantità di azoto liquido applicato nella cavità, la necrosi e il gonfiore che ne risultano possono essere imprevedibili.
Tutte le tecniche descritte sembrano ridurre in modo significativo l’incidenza delle recidive successive alla rimozione chirurgica del tumore odontogeno cheratosico, se paragonate alla sola enucleazione.
Marsupializzazione e decompressione
La marsupializzazione e la decompressione hanno lo scopo di ridurre il volume della cavità cistica decomprimendola; la marsupializzazione è però intesa come trattamento definitivo, mentre la decompressione come trattamento preliminare alla successiva enucleazione e si avvale del posizionamento di un drenaggio provvisorio all’interno della cavità. Il vantaggio di queste tecniche risiederebbe nel cambiamento istologico che sono in grado di indurre sull’epitelio cistico31,51, che per esempio in alcuni casi esita in una perdita della cheratinizzazione. Inoltre, la progressiva diminuzione della dimensione cistica nel tempo consente di salvaguardare le strutture anatomiche circostanti (seno mascellare, elementi dentari, fasci neurovascolari), minimizzare il rischio di frattura ed eseguire la successiva enucleazione in presenza di una lesione tecnicamente più facile da rimuovere. Trovano pertanto una maggiore indicazione in caso di tumori di grandi dimensioni23. Nessuna delle due tecniche consente la rimozione dell’epitelio di rivestimento della cisti e pertanto appaiono poco indicate, soprattutto alla luce della natura tumorale della lesione in oggetto e del fatto che in letteratura sono riferiti casi di degenerazione del tumore cheratosico in ameloblastoma o altre forme maligne.
Resezione
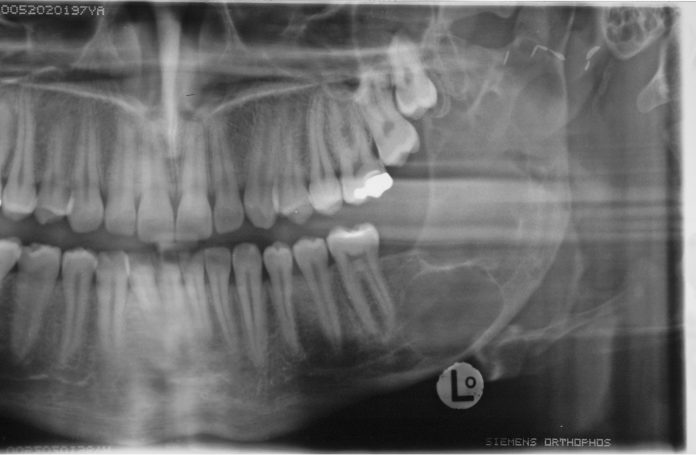
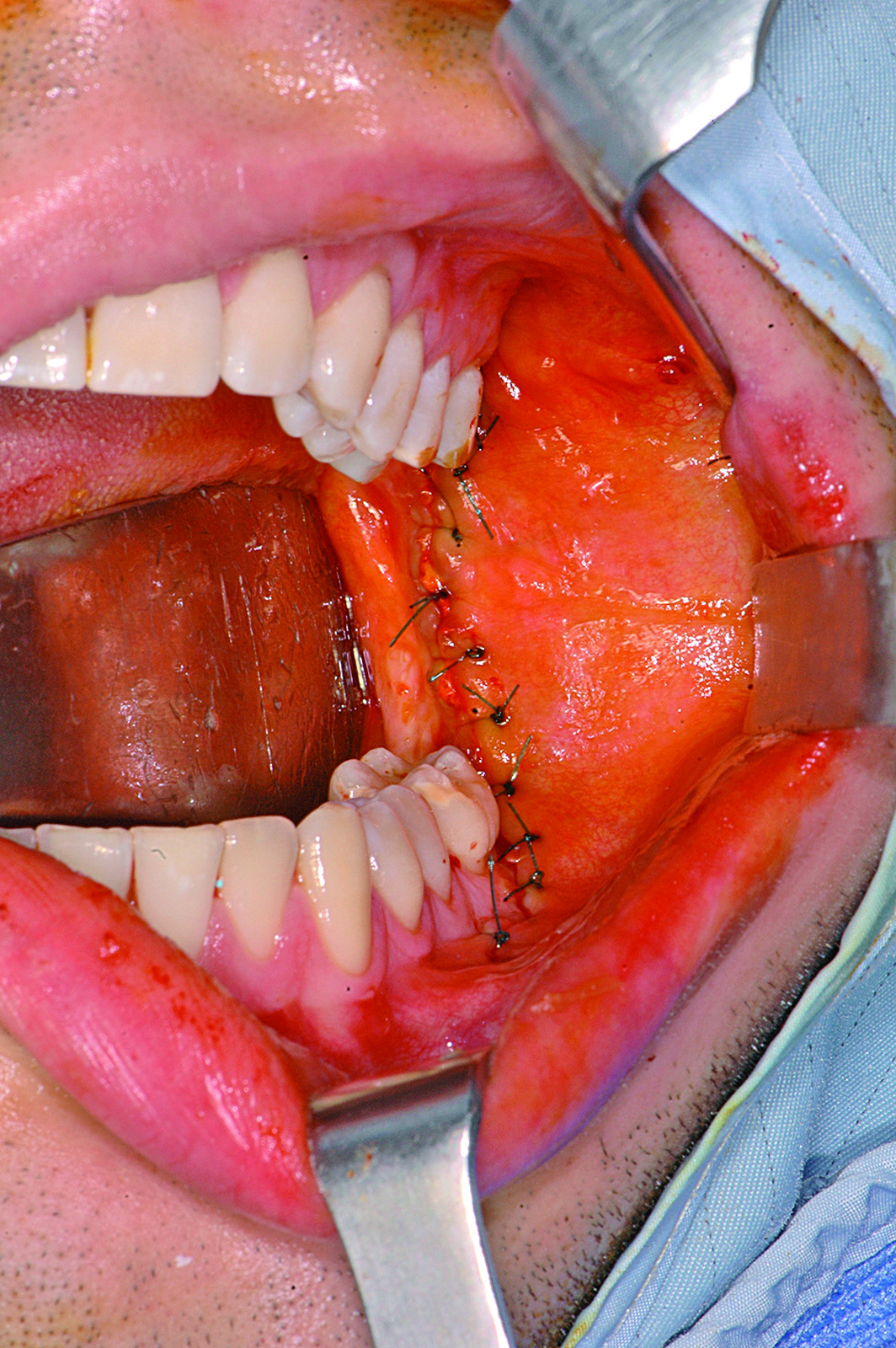
La resezione del tumore cheratosico “en-bloc” (insieme a circa 1 cm periferico di osso circostante) viene descritta come trattamento per le lesioni multiloculari, più aggressive, in degenerazione tumorale o ricorrenti oppure per quei casi in cui, a causa dello sconfinamento oltre il piano periostale, la possibilità di rimozione completa delle cellule tumorali sia ridotta. Appare in particolare indicata nei casi localizzati nella mandibola posteriore e nel mascellare superiore, dove un trattamento conservativo potrebbe portare in caso di recidiva a scarso controllo e possibilità di diffusione verso il basicranio. Sebbene venga talvolta citata tra i trattamenti di scelta per il tumore cheratosico, considerata la sua invasità sembrerebbe essere più indicata solo in casi selezionati per lesioni più aggressive o recidivanti, in quanto garantisce la rimozione dell’epitelio periferico quasi azzerando le recidive. Nel caso di resezione “en bloc” in particolare a livello mandibolare è indicato, qualora possibile, procedere alla ricostruzione immediata della mandibola con innesti ossei autologhi o lembi liberi di fibula o ala iliaca. Alla luce delle tecniche citate, gli attuali orientamenti nel trattamento del tumore cheratosico sembrerebbero orientarsi su terapie conservative, come l’enucleazione seguita o meno da trattamenti aggiuntivi nel caso di tumori cheratosici di dimensioni contenute, uniloculari, confinati entro le corticali, senza sconfinamento nel piano periostale o mucoso. In caso di lesioni estese, pluriloculari, in sedi a rischio o recidivanti, in fase di degenerazione maligna o sconfinanti nei piani profondi, l’utilizzo di una terapia più radicale, come la resezione “en-bloc”, sembrerebbe più idonea allo scopo di evitare una recidiva della lesione e una sua ulteriore espansione. L’attuale classificazione tumorale della precedente “cheratocisti odontogena” aiuta a comprendere il suo potenziale aggressivo e a inquadrare il trattamento più idoneo per ogni caso. La sola variante ortocheratosica può essere trattata con un approccio meno invasivo, in quanto presenta una minore incidenza di recidive ed è considerata una cisti odontogena. Un caso significativo di trattamento di tumore cheratosico viene presentato nelle figure 1-12.
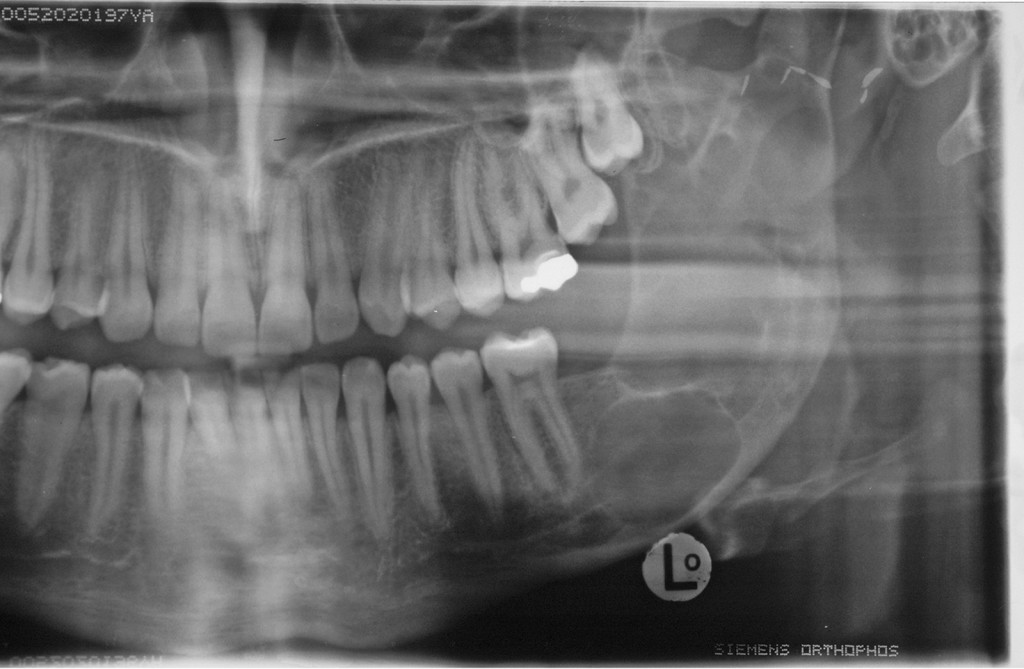
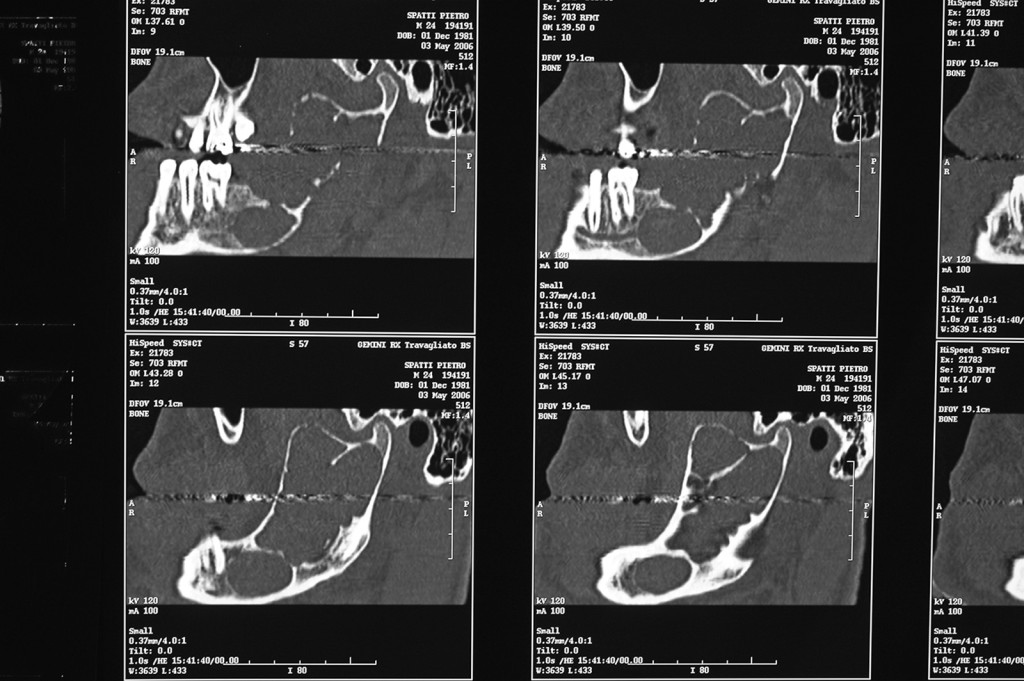
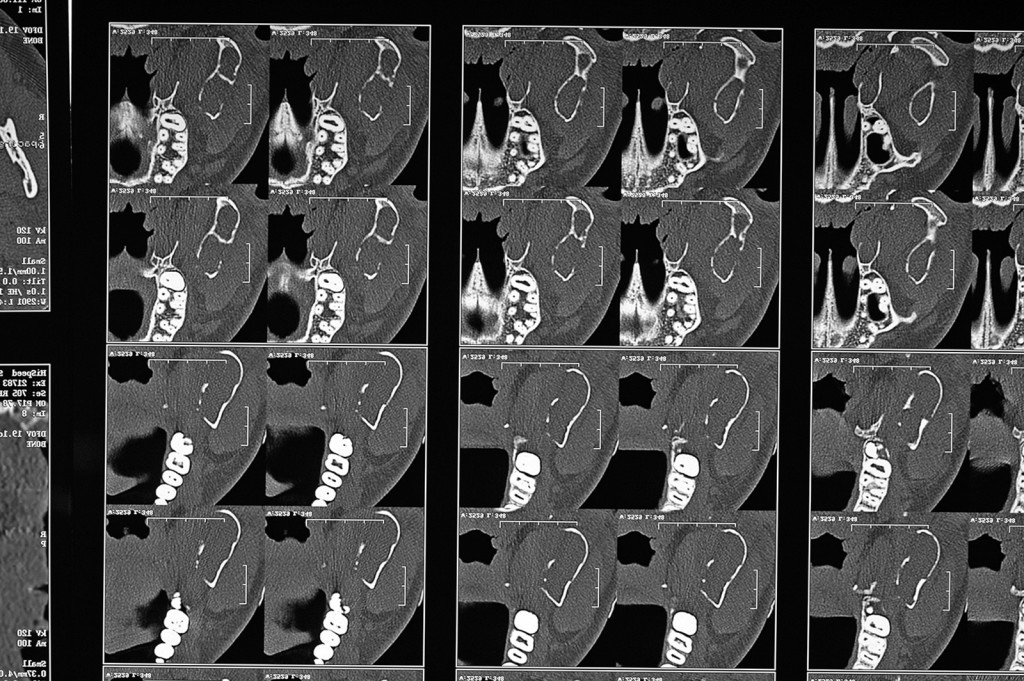
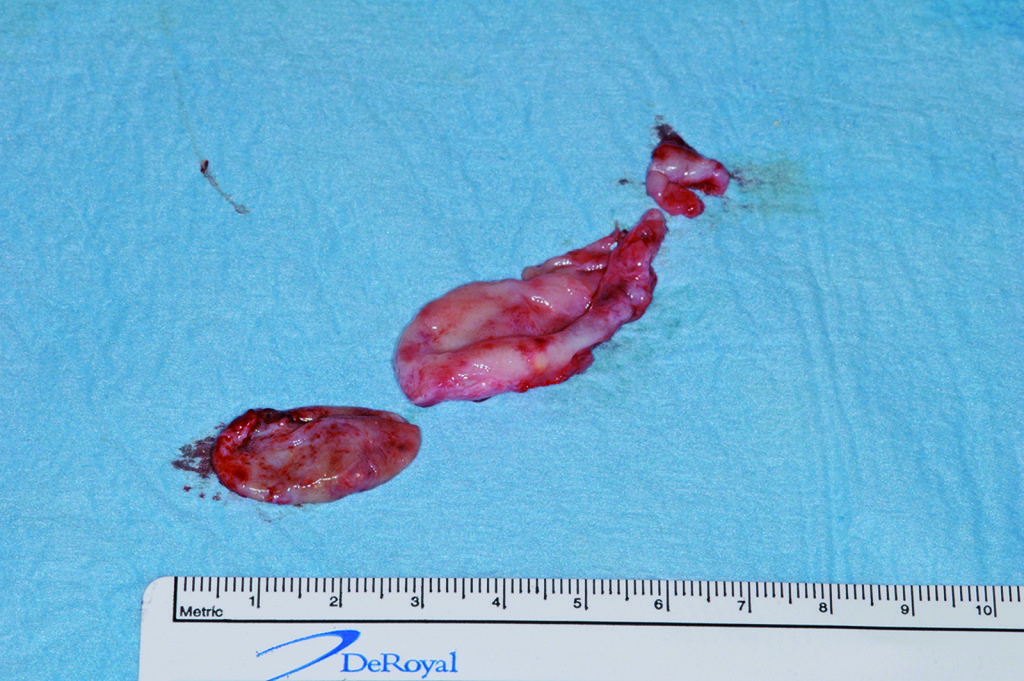
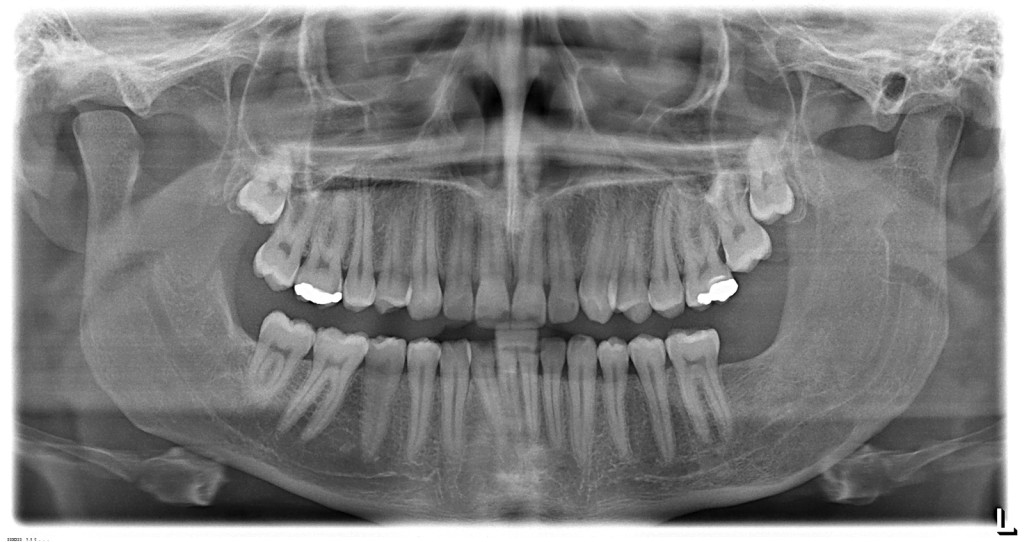
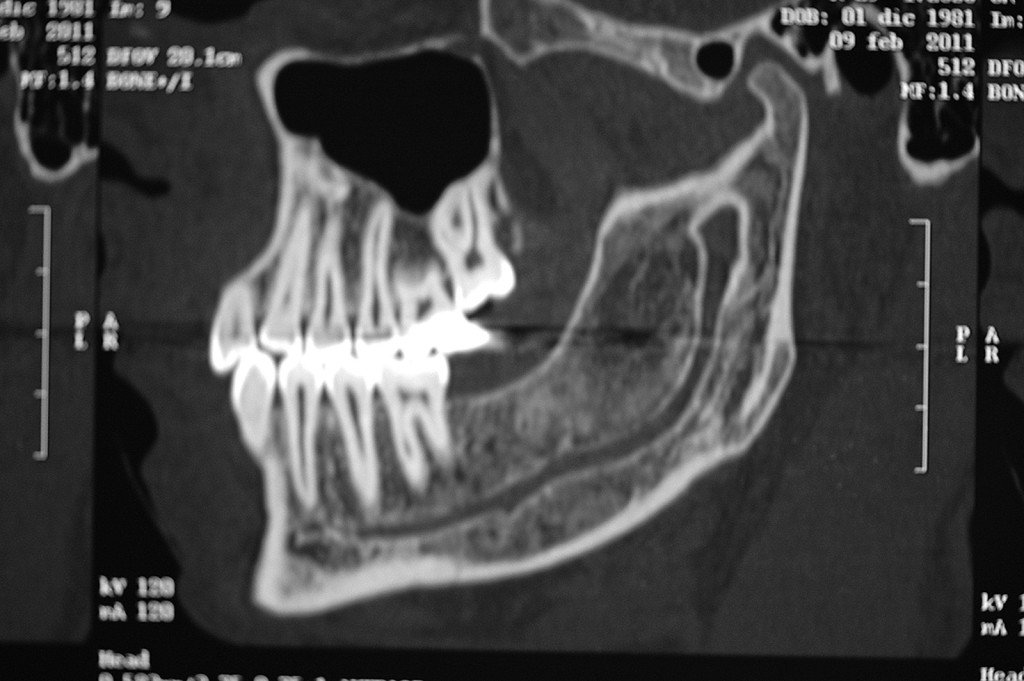
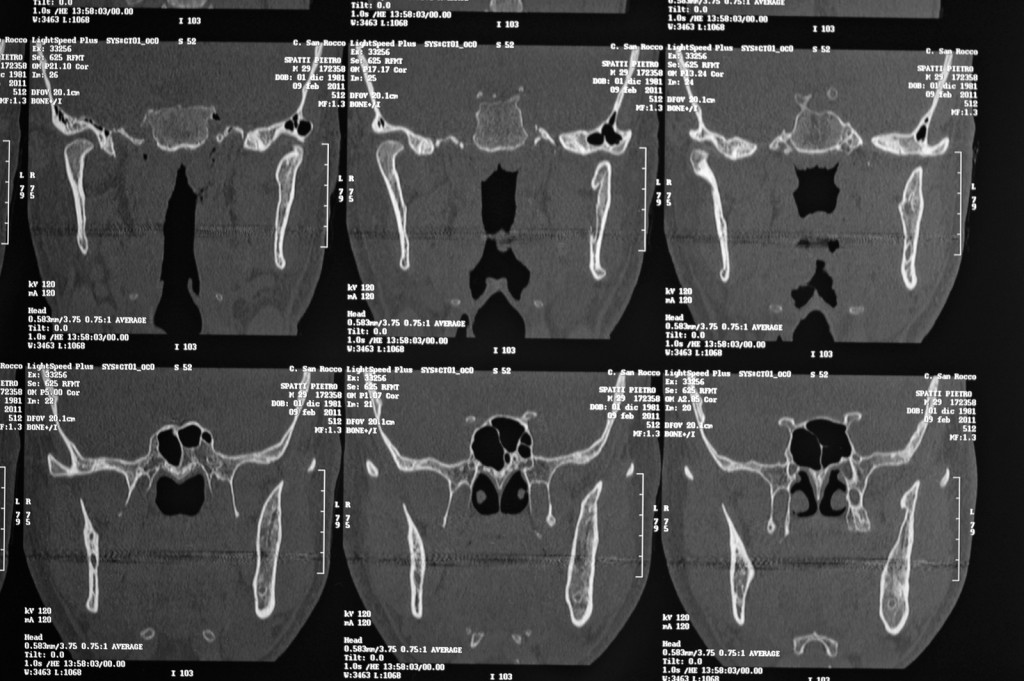
Conclusioni
Questa revisione della letteratura dimostra che, ad oggi, non vi è evidenza scientifica sufficiente per stabilire l’efficacia di trattamenti validi o di protocolli accettati per il tumore odontogeno cheratosico. La marsupializzazione e la decompressione, sebbene citate da alcuni Autori, appaiono poco indicate alla luce della natura tumorale della lesione in oggetto e della possibilità di una sua degenerazione maligna. L’enucleazione come unico trattamento mostra un’incidenza di recidive superiore rispetto alla scelta di trattamenti aggiuntivi, come l’utilizzo della soluzione di Carnoy, l’ostectomia periferica, la crioterapia con azoto liquido e l’elettrocauterizzazione. Questi trattamenti più conservativi vengono utilizzati nel caso di tumori cheratosici di dimensioni contenute, uniloculari, confinati entro le corticali, senza sconfinamento nel piano periostale o mucoso. La minore incidenza di recidive si ottiene con la resezione “en-bloc”, che tuttavia espone a rischi chirurgici più alti ed è poco accettata da alcuni clinici per la sua invasività, pertanto viene utilizzata in caso di lesioni estese, pluriloculari, in sedi a rischio o recidivanti, in fase di degenerazione maligna o confinanti nei piani profondi. In ogni caso, nuovi studi prospettici condotti in modo randomizzato con precisi criteri di inclusione e con un follow-up adeguato saranno importanti per determinare un protocollo di trattamento condiviso e predicibile.
Corrispondenza
Matteo Chiapasco
Clinica Odontoiatrica
Via Beldiletto, 1/3 – 20142 Milano
Tel. 02.50319000 – matteo.chiapasco@unimi.it
Sara Giglio1
Matteo Chiapasco1
1Unità di Chirurgia orale (Direttore Prof. Matteo Chiapasco), Clinica Odontoiatrica – Dipartimento di Medicina, Chirurgia e Odontoiatria, Università degli Studi di Milano
2. Mendes RA, Carvalho JF, van der Waal I. Biological pathways involved in the aggressive behavior of the keratocystic odontogenic tumor and possible implications for molecular oriented treatment – an overview. Oral Oncol 2010 Jan;46(1):19-24. 3. Zhang L, Sun ZJ, Zhao YF, Bian Z, Fan MW, Chen Z. Inhibition of SHH signaling pathway: molecular treatment strategy of odontogenic keratocyst. Med Hypotheses 2006;67(5):1242-4. 4. Sharif FNj, Oliver R, Sweet C, Sharif MO. Interventions for the treatment of keratocystic odontogenic tumours (KCOT, odontogenic keratocysts – OKC). Cochrane Database Syst Rev 2010 Sep 8;(9):CD008464. 5. Mendes RA, Carvalho JF, van der Waal I. Characterization and management of the keratocystic odontogenic tumor in relation to its histopathological and biological features. Oral Oncol 2010 Apr;46(4):219-25. 6. Blanas N, Freund B, Schwartz M, Furst IM. Systematic review of the treatment and prognosis of the odontogenic keratocyst. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2000 Nov;90(5):553-8. 7.Williams TP, Connor FA Jr. Surgical management of the odontogenic keratocyst: aggressive approach. J Oral Maxillofac Surg 1994 Sep;52(9):964-6. 8.Meiselman F. Surgical management of the odontogenic keratocyst: conservative approach. J Oral Maxillofac Surg 1994 Sep;52(9):960-3. 9.Bramley P. The odontogenic keratocyst – An approach to treatment. Int J Oral Surg 1974;3(5):337-41. 10. Stoelinga PJ. Long-term follow-up on keratocysts treated according to a defined protocol. Int J Oral Maxillofac Surg 2001 Feb;30(1):14-25. 11. Zecha JA, Mendes RA, Lindeboom VB, van der Waal I. Recurrence rate of keratocystic odontogenic tumor after conservative surgical treatment without adjunctive therapies – A 35-year single institution experience. Oral Oncol 2010 Oct;46(10):740-2. 12. Gosau M, Draenert FG, Müller S, Frerich B, Bürgers R, Reichert TE, Driemel O. Two modifications in the treatment of keratocystic odontogenic tumors (KCOT) and the use of Carnoy’s solution (CS) – A retrospective study lasting between 2 and 10 years. Clin Oral Investig 2010 Feb;14(1):27-34. 13. Boffano P, Ruga E, Gallesio C. Keratocystic odontogenic tumor (odontogenic keratocyst): preliminary retrospective review of epidemiologic, clinical, and radiologic features of 261 lesions from University of Turin. J Oral Maxillofac Surg 2010 Dec;68(12):2994-9. 14. Pitak-Arnnop P, Chaine A, Oprean N, Dhanuthai K, Bertrand JC, Bertolus C. Management of odontogenic keratocysts of the jaws: a ten-year experience with 120 consecutive lesions. J Craniomaxillofac Surg 2010 Jul;38(5):358-64. 15. Kuroyanagi N, Sakuma H, Miyabe S, Machida J, Kaetsu A, Yokoi M, Maeda H, Warnakulasuriya S, Nagao T, Shimozato K. Prognostic factors for keratocystic odontogenic tumor (odontogenic keratocyst): analysis of clinico-pathologic and immunohistochemical findings in cysts treated by enucleation. J Oral Pathol Med 2009 Apr;38(4):386-92. 16. González-Alva P, Tanaka A, Oku Y, Yoshizawa D, Itoh S, Sakashita H, Ide F, Tajima Y, Kusama K. Keratocystic odontogenic tumor: a retrospective study of 183 cases. J Oral Sci 2008 Jun;50(2):205-12. 17. Madras J, Lapointe H. Keratocystic odontogenic tumour: reclassification of the odontogenic keratocyst from cyst to tumour. J Can Dent Assoc 2008 Mar;74(2):165-165h. 18. Habibi A, Saghravanian N, Habibi M, Mellati E, Habibi M. Keratocystic odontogenic tumor: a 10-year retrospective study of 83 cases in an Iranian population. J Oral Sci 2007 Sep;49(3):229-35. 19.Kolokythas A, Fernandes RP, Pazoki A, Ord RA. Odontogenic keratocyst: to decompress or not to decompress? A comparative study of decompression and enucleation versus resection/peripheral ostectomy. J Oral Maxillofac Surg 2007 Apr;65(4):640-4. 20. Maurette PE, Jorge J, de Moraes M. Conservative treatment protocol of odontogenic keratocyst: a preliminary study. J Oral Maxillofac Surg 2006 Mar;64(3):379-83. 21. Chirapathomsakul D, Sastravaha P, Jansisyanont P. A review of odontogenic keratocysts and the behavior of recurrences. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2006 Jan;101(1):5-9. 22. Morgan TA, Burton CC, Qian F. A retrospective review of treatment of the odontogenic keratocyst. J Oral Maxillofac Surg 2005 May;63(5):635-9. 23. Nakamura N, Mitsuyasu T, Mitsuyasu Y, Taketomi T, Higuchi Y, Ohishi M. Marsupialization for odontogenic keratocysts: long-term follow-up analysis of the effects and changes in growth characteristics. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2002 Nov;94(5):543-53. 24. Zhao YF, Wei JX, Wang SP. Treatment of odontogenic keratocysts: a follow-up of 255 Chinese patients. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2002 Aug;94(2):151-6. 25. Schmidt BL, Pogrel MA. The use of enucleation and liquid nitrogen cryotherapy in the management of odontogenic keratocysts. J Oral Maxillofac Surg 2001 Jul;59(7):720-5; discussion 726-7. 26. Myoung H, Hong SP, Hong SD, Lee JI, Lim CY, Choung PH, Lee JH, Choi JY, Seo BM, Kim MJ. Odontogenic keratocyst: Review of 256 cases for recurrence and clinicopathologic parameters. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 2001 Mar;91(3):328-33. 27. Chow HT. Odontogenic keratocyst: a clinical experience in Singapore. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1998 Nov;86(5):573-7. 28. Bataineh AB, al Qudah M. Treatment of mandibular odontogenic keratocysts. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1998 Jul;86(1):42-7. 29. Meara JG, Shah S, Li KK, Cunningham MJ. The odontogenic keratocyst: a 20-year clinicopathologic review. Laryngoscope 1998 Feb;108(2):280-3. 30. Dammer R, Niederdellmann H, Dammer P, Nuebler-Moritz M. Conservative or radical treatment of keratocysts: a retrospective review. Br J Oral Maxillofac Surg 1997 Feb;35(1):46-8. 31. Marker P, Brøndum N, Clausen PP, Bastian HL. Treatment of large odontogenic keratocysts by decompression and later cystectomy: a long-term follow-up and a histologic study of 23 cases. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1996 Aug;82(2):122-31. 32. el-Hajj G, Anneroth G. Odontogenic keratocysts – A retrospective clinical and histologic study. Int J Oral Maxillofac Surg 1996 Apr;25(2):124-9. 33. Anand VK, Arrowood JP Jr, Krolls SO. Odontogenic keratocysts: a study of 50 patients. Laryngoscope 1995 Jan;105(1):14-6. 34. Pogrel MA. The use of liquid nitrogen cryotherapy in the management of locally aggressive bone lesions. J Oral Maxillofac Surg 1993 Mar;51(3):269-73. 35. Brøndum N, Jensen VJ. Recurrence of keratocysts and decompression treatment. A long-term follow-up of forty-four cases. Oral Surg Oral Med Oral Pathol 1991 Sep;72(3):265-9. 36. Köndell PA, Wiberg J. Odontogenic keratocysts. A follow-up study of 29 cases. Swed Dent J 1988;12(1-2):57-62. 37. Jensen J, Sindet-Pedersen S, Simonsen EK. A comparative study of treatment of keratocysts by enucleation or enucleation combined with cryotherapy. A preliminary report. J Craniomaxillofac Surg 1988 Nov;16(8):362-5. 38. Stoelinga PJ, Bronkhorst FB. The incidence, multiple presentation and recurrence of aggressive cysts of the jaws. J Craniomaxillofac Surg 1988 May;16(4):184-95. 39. Forssell K, Forssell H, Kahnberg KE. Recurrence of keratocysts. A long-term follow-up study. Int J Oral Maxillofac Surg 1988 Feb;17(1):25-8. 40. Partridge M, Towers JF. The primordial cyst (odontogenic keratocyst): its tumour-like characteristics and behaviour. Br J Oral Maxillofac Surg 1987 Aug;25(4):271-9. 41. Irvine GH, Bowerman JE. Mandibular keratocysts: surgical management. Br J Oral Maxillofac Surg 1985 Jun;23(3):204-9. 42. Zachariades N, Papanicolaou S, Triantafyllou D. Odontogenic keratocysts: review of the literature and report of sixteen cases. J Oral Maxillofac Surg 1985 Mar;43(3):177-82. 43. Chuong R, Donoff RB, Guralnick W. The odontogenic keratocyst. J Oral Maxillofac Surg 1982 Dec;40(12):797-802. 44. Voorsmit RA, Stoelinga PJ, van Haelst UJ. The management of keratocysts. J Maxillofac Surg 1981 Nov;9(4):228-36. 45. Vedtofte P, Praetorius F. Recurrence of the odontogenic keratocyst in relation to clinical and histological features. A 20-year follow-up study of 72 patients. Int J Oral Surg 1979 Dec;8(6):412-20. 46. Hodgkinson DJ, Woods JE, Dahlin DC, Tolman DE. Keratocysts of the jaw. Clinicopathologic study of 79 patients. Cancer 1978 Mar;41(3):803-13. 47. Donoff RB, Guralnick WC, Clayman L. Keratocysts of the jaws. J Oral Surg 1972 Nov;30(11):880-4. 48. Rud J, Pindborg JJ. Odontogenic keratocysts: a follow-up study of 21 cases. J Oral Surg 1969 May;27(5):323-30. 49. Tonietto L, Borges HO, Martins CA, Silva DN, Sant’ana Filho M. Enucleation and liquid nitrogen cryotherapy in the treatment of keratocystic odontogenic tumors: a case series. J Oral Maxillofac Surg 2011 Jun;69(6):e112-7. 50. Pogrel MA, Jordan RC. Marsupialization as a definitive treatment for the odontogenic keratocyst. J Oral Maxillofac Surg 2004 Jun;62(6):651-5. 51. August M, Faquin WC, Troulis MJ, Kaban LB. Dedifferentiation of odontogenic keratocyst epithelium after cyst decompression. J Oral Maxillofac Surg 2003 Jun;61(6):678-83. 52. Stoelinga PJ. The treatment of odontogenic keratocysts by excision of the overlying, attached mucosa, enucleation, and treatment of the bony defect with carnoy solution. J Oral Maxillofac Surg 2005 Nov;63(11):1662-6. 53. Chapelle KA, Stoelinga PJ, de Wilde PC, Brouns JJ, Voorsmit RA. Rational approach to diagnosis and treatment of ameloblastomas and odontogenic keratocysts. Br J Oral Maxillofac Surg 2004 Oct;42(5):381-90. 54. Ephros H, Lee HY. Treatment of a large odontogenic keratocyst using the Brosch procedure. J Oral Maxillofac Surg 1991 Aug;49(8):871-4. 55. Giovannetti F, Cassoni A, Battisti A, Gennaro P, Della Monaca M, Valentini V. Endoscopic approach to benign lesion involving the mandibular condyle. J Craniofac Surg 2010 Jul;21(4):1234-7. 56. Chiapasco M, Rossi A, Motta JJ, Crescentini M. Spontaneous bone regeneration after enucleation of large mandibular cysts: a radiographic computed analysis of 27 consecutive cases. J Oral Maxillofac Surg 2000 Sep;58(9):942-8.


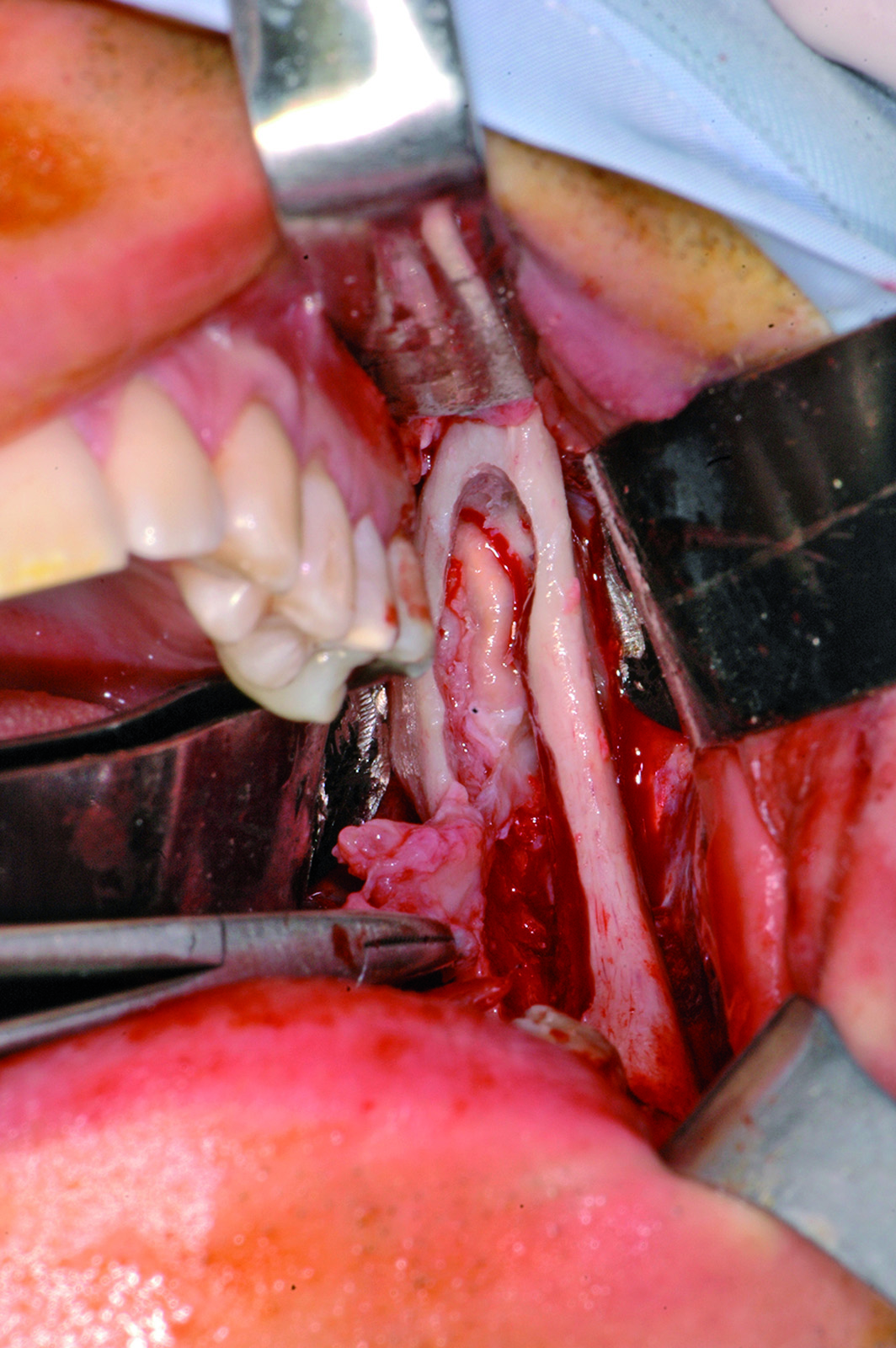
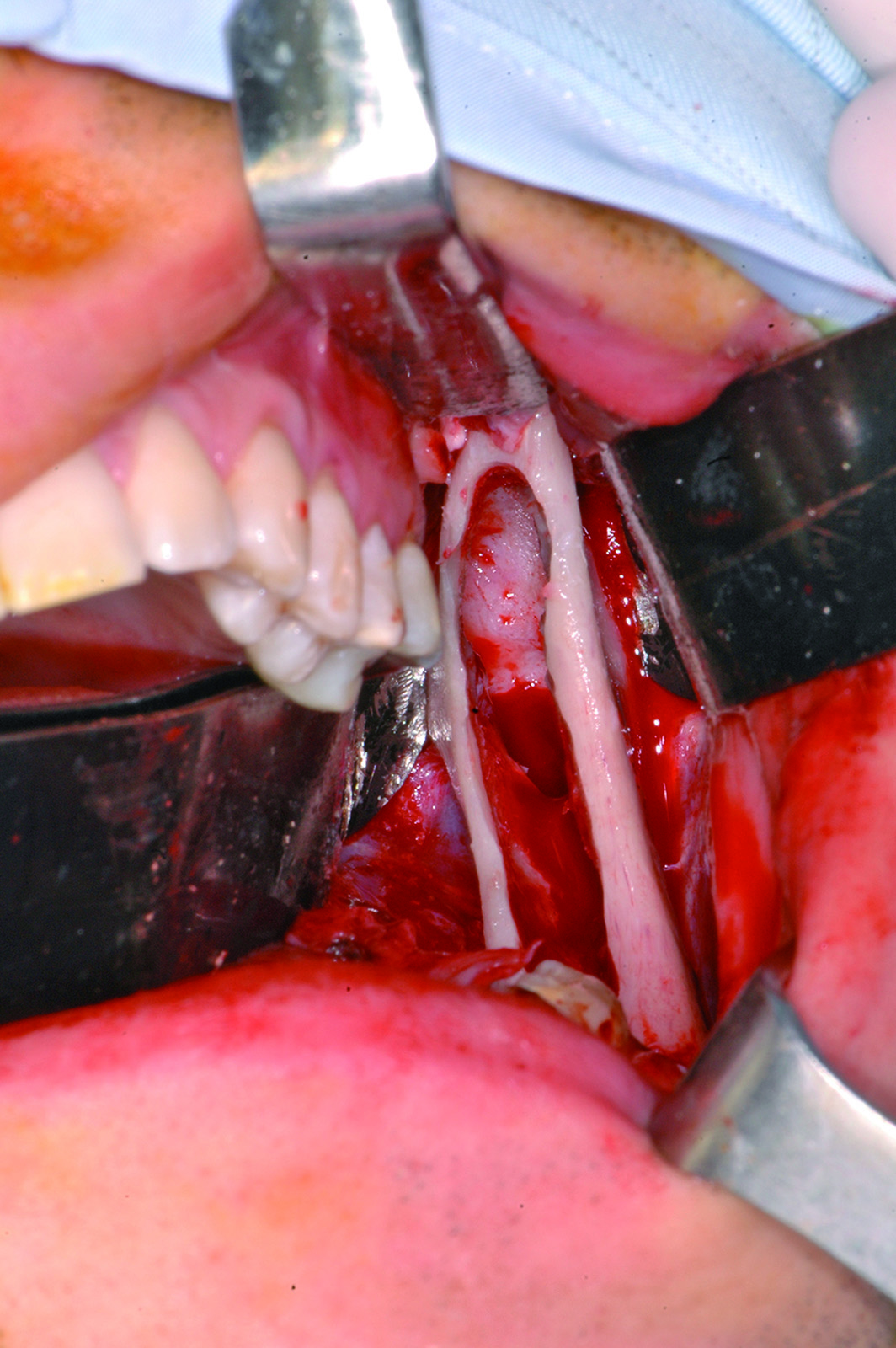
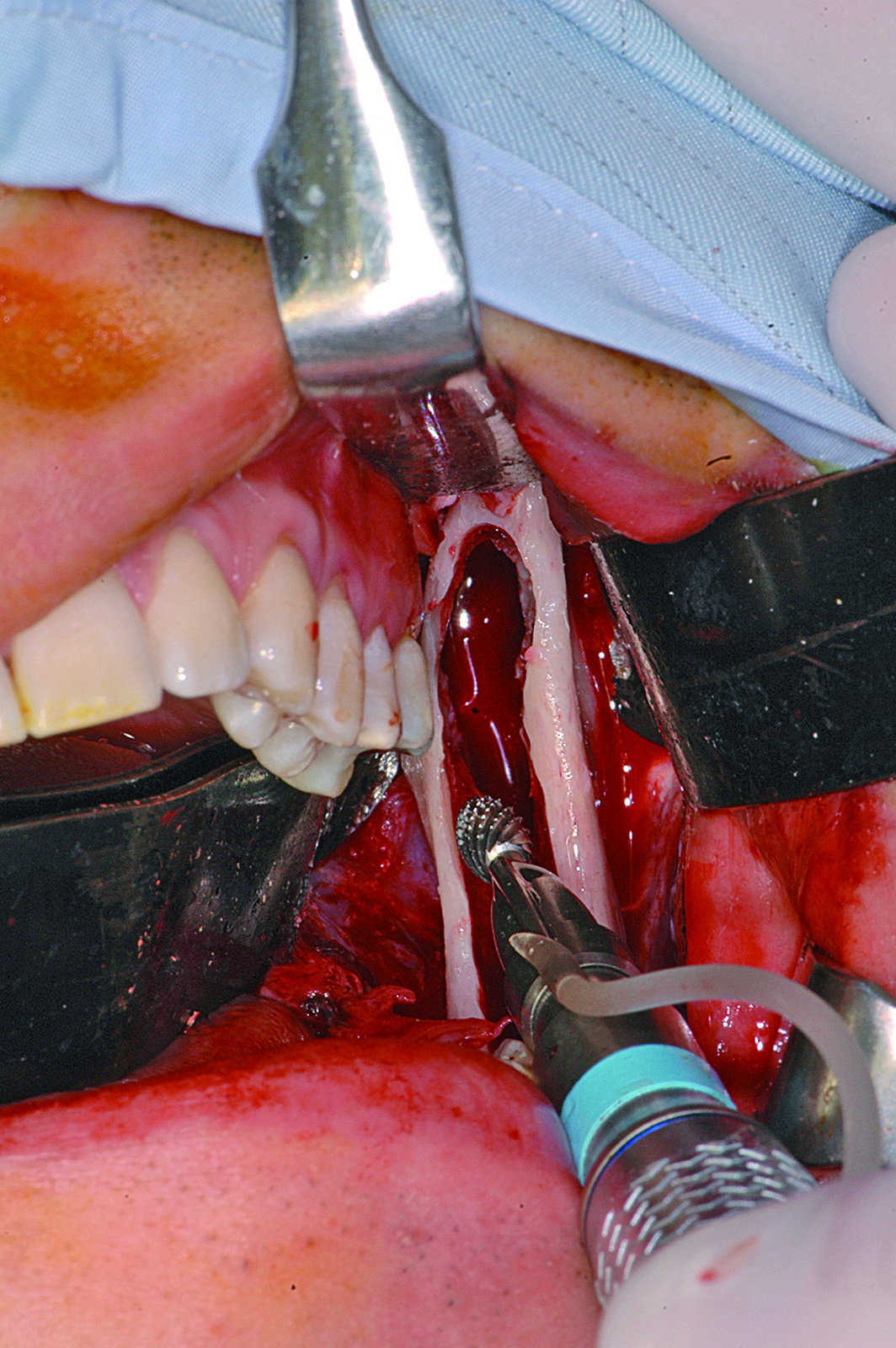
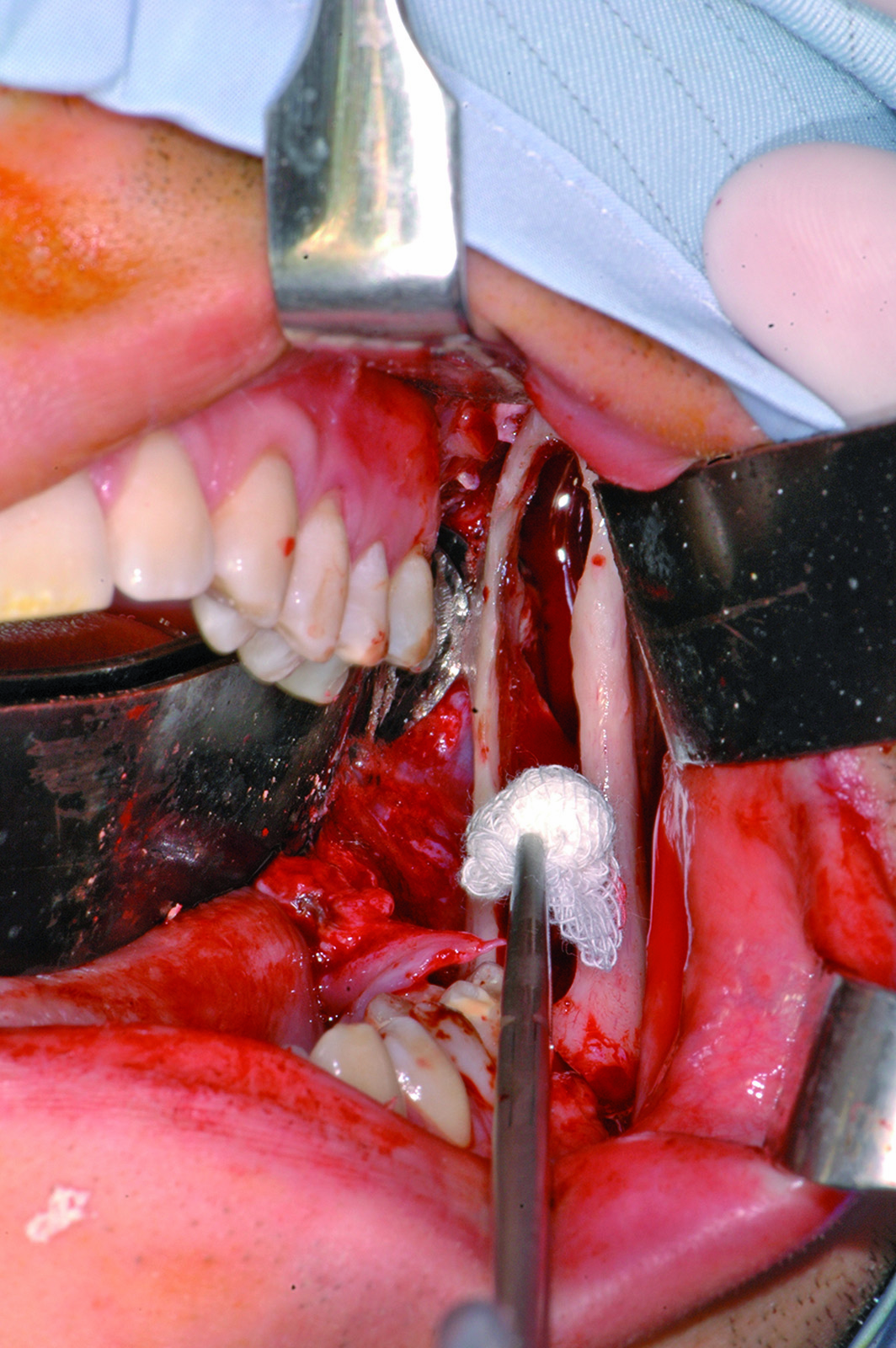



[…] chirurgica micro-invasiva, con approccio intra-orale, che consente l’enucleazione di grandi cisti mucose del seno mascellare contestualmente all’elevazione del pavimento sinusale, al fine di […]