La presenza di difetti ossei, localizzati nei processi alveolari, può impedire l’uso di impianti, a causa dell’insufficiente volume osseo atto all’ottenimento dell’osteointegrazione. Il riassorbimento localizzato osseo può impedire anche un buon risultato estetico, a causa dello scarso supporto dei tessuti molli. L’innesto di osso autologo è considerato il gold standard, ma presenta svantaggi per il paziente quali un sito donatore e il rischio di morbilità. L’uso di innesti alloplastici, allogenici o xenogenici è diventato, quindi, un’alternativa attrattiva. Un recente studio, condotto nella mascella di conigli, ha dimostrato che l’innesto di osso suino ha una forte proprietà osteoconduttiva ed è, con il tempo, rimodellato e rimpiazzato con nuovo osso.
Scopo del presente studio è descrivere una tecnica studiata per ricostruire un volume osseo adeguato all’installazione di un impianto e atto a sostenere i tessuti molli al fine di ottenere un adeguato risultato estetico. L’aumento osseo è stato valutato anche da un punto di vista istologico.
Summary
Localized bone regeneration with porcine bone graft: clinical and histological evidences
The presence of localized bone defects in the alveolar process can impede the use of implants because of insufficient bone volume for osseointegration. Localized resorption of bone can also prevent a good aesthetic result due to the scarce bone support of the gums. Autologous bone grafting is considered the gold standard, but it has disadvantages for the patient, such as the need of a donor site and the risk of morbility.
The use of alloplastic, allogeneic or xenogeneic grafts has become an attractive alternative. A recent study in the rabbit maxilla has demonstrated that porcine bone graft has strong osteoconductive properties and is remodelled and replaced with new bone over time.
The aim of the study is to describe a technique for reconstruction of localized defects to enable installation of implants and to support the gums in order to obtain a satisfactory aesthetic result. The augmentation of the bone is evaluated also from a histological point of view.
Un adeguato volume osseo alveolare è un requisito essenziale al fine di ottenere una riabilitazione protesica, funzionale ed estetica, utilizzando la terapia implantare. Studi clinici e istologici, condotti su animali ed esseri umani, hanno dimostrato che durante la guarigione spontanea dell’alveolo post-estrattivo si instaura un processo fisiologico che esita in un rimodellamento e riassorbimento osseo, che è significativamente maggiore sul lato vestibolare rispetto a quello linguale o palatino1-3, e che la riduzione di ampiezza della cresta alveolare mascellare è maggiore del riassorbimento in altezza4. Una parodontopatia, una patologia periapicale, un trauma o, ancora, un’estrazione complessa o l’assenza, parziale o completa, della corticale vestibolare sono tutti fattori che portano a un inadeguato volume osseo a guarigione avvenuta.
L’agenesia parziale o completa della dentizione esita in un’atrofia delle creste alveolari, che sappiamo essere dipendenti dalla presenza del legamento parodontale.
Nel 1996, Buser D. et al.5, al fine di ricostruire l’osso perduto, introdussero il concetto di rigenerazione ossea guidata (guided bone regeneration, GBR). L’obiettivo della GBR è promuovere la formazione di osso nelle deformità crestali, prima o contemporaneamente all’inserimento di impianti. La GBR crea un ambiente adatto, in cui il potenziale biologico può aumentare al massimo la naturale rigenerazione del tessuto osseo6-8.
I fattori coinvolti nella formazione di un ambiente adatto per la procedura GBR sono: la stabilità del coagulo, la prevenzione dell’infiammazione acuta derivante da infezione batterica e la creazione e il mantenimento di uno spazio riempito con il coagulo sanguigno9,10.
Le membrane barriera – riassorbibili e non riassorbibili – sono, da tempo, usate con successo per la rigenerazione di nuovo osso. La loro funzione è quella di escludere le cellule dei tessuti molli della mucosa, favorendo le cellule generanti osso provenienti dal tessuto circostante, al fine di ripopolare e rigenerare i difetti. Tuttavia, la maggior parte delle membrane, da sole, non sono in grado di creare uno spazio adeguato per la rigenerazione ossea. Sebbene, per l’incremento della cresta alveolare, l’uso di un innesto di osso autologo, utilizzato in blocco o in particelle11,12, rappresenti il gold standard, sono stati suggeriti e studiati materiali alternativi come xenoinnesti13,14, innesti di osso alloplastico15,16 e alloinnesti17. La ricerca di materiali alternativi nasce dalla necessità di evitare al paziente i disagi del secondo sito chirurgico, il sito donatore, riducendo così l’invasività della procedura e la morbilità del periodo post-operatorio.
Un recente studio, condotto in mascella di conigli, ha dimostrato che l’innesto di osso suino presenta una forte proprietà osteoconduttiva e, nel tempo, viene riassorbito e rimpiazzato con nuovo osso18.
Scopo del presente studio è stato quello di descrivere i risultati clinici, radiologici e istologici ottenuti tramite l’utilizzo di granuli di osso suino (OsteoBiol Gen-Os, Tecnoss, Italia) miscelati a gel di collagene e ricoperti con una lamina corticale.
Materiali e metodi
Al fine di valutare l’efficacia del protocollo proposto, sono stati reclutati due pazienti che presentavano un difetto osseo a livello del primo premolare superiore di tipo orizzontale e, in parte, di tipo verticale. Dato che entrambi i difetti ossei si presentavano piuttosto estesi, si è preferito effettuare il procedimento di rigenerazione in due fasi: rigenerazione ossea e attesa di sei mesi, inserzione di impianti con un periodo di guarigione di almeno quattro mesi prima della riapertura e del posizionamento degli abutment. La zona da rigenerare è stata riempita con una miscela di gel collagene (OsteoBiol Gel 0, Tecnoss, Italia) amalgamato a osso collagenato di origine porcina (OsteoBiol Gen-Os, Tecnoss, Italia). Questa particolare miscela ha permesso un miglior controllo dell’innesto, grazie alle caratteristiche di maggior malleabilità del prodotto ottenuto e alla sua particolare adesività. Scopo principale del protocollo proposto è stato quello di mantenere uno spazio adeguato per la rigenerazione di nuovo osso; ciò è stato ottenuto utilizzando una vite di supporto al di sotto di una lamina corticale ossea (OsteoBiol Soft Cortical Lamina, Tecnoss, Italia). Quest’ultima è stata stabilizzata, sul lato vestibolare con due mini viti da osteosintesi (lunghezza 5 mm, diametro 1,2 mm; Graftek fixation screws, Roen); mentre, sul lato palatino, è stata riposizionata al di sotto del lembo mucoperiosteo.
Dopo sei mesi, alla fine del periodo di guarigione, si è proceduto a installare un impianto con superficie bimodale, geometria a tolleranza positiva e conicità di circa 1° (Neoss Italia)19. Dopo l’installazione dell’impianto, al momento della riapertura e prima del posizionamento dell’abutment definitivo è stato misurato il valore ISQ (implant stability quotient, Osstell Mentor), ossia il valore della frequenza di risonanza, che è correlato alla rigidezza del comparto osso-titanio20. La preparazione del sito implantare è stata effettuata con una fresa Trephine (Maillefer), con diametro interno di 2 mm ed esterno di 3 mm. La fresa, con all’interno l’osso prelevato, è stata immersa in una soluzione tamponata al 4% di formaldeide e inviata al Dipartimento di Biomateriali presso l’Institute of Surgical Sciences, (Sahlgrenska Academy, Göteborg University, Sweden) per le valutazioni istologiche. I prelievi sono stati disidratati con passaggi successivi in differenti gradienti d’alcool e, successivamente, inclusi in resina fotopolimerizzabile. Con un seghetto e una smerigliatrice sono state tagliate delle sezioni di circa 10-15 µm, colorate con blu di toluidina e osservate al microscopio.
Primo caso
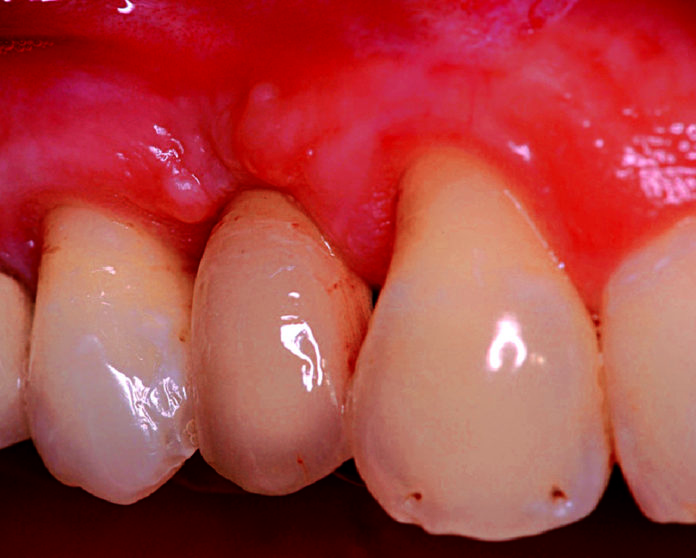
Una paziente di sesso femminile di 56 anni, con edentulia in zona 1.4, presentava un inadeguato volume osseo, in senso sia verticale sia orizzontale, ai fini dell’inserimento di un impianto. Di conseguenza, si decideva di effettuare, prima dell’inserimento dell’impianto, una ricostruzione del difetto osseo tramite GBR (figure 1 e 2).
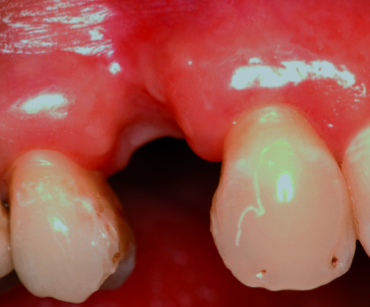
In anestesia locale (lidocaina al 2% con 1:80.000 di epinefrina) si disegna un lembo vestibolare a spessore totale al fine di denudare completamente il difetto osseo. Ripulita attentamente la superficie ossea da qualsiasi residuo di periostio, si perfora la corticale vestibolare del sito ricevente con una fresa a pallina, al fine di indurre sanguinamento e promuovere l’incorporazione e la vascolarizzazione del materiale d’innesto. Si inserisce una vite di supporto sul lato occlusale del sito ricevente allo scopo di effettuare un effetto tenda ed evitare il collasso della lamina barriera. Successivamente, il sito viene riempito con OsteoBiol Gen-Os miscelato con gel di collagene (OsteoBiol Gel 0) allo scopo di rendere il prodotto più denso e appiccicoso, facilitandone così il suo posizionamento; al di sopra del materiale d’innesto, si modella una lamina corticale fine (OsteoBiol Lamina Soft), che viene stabilizzata all’osso tramite due viti di fissazione in corrispondenza del versante vestibolare apicalmente al difetto; mentre, sul lato palatino, la lamina viene adattata alla superficie ossea al di sotto del lembo mucoperiosteo. Prima di chiudere la ferita, viene eseguita una fenestrazione del periostio, alla base del lembo vestibolare, al fine di ottenere un adattamento privo di tensione dei margini della ferita. Quest’ultima viene chiusa con suture orizzontali a materassaio e punti staccati. La paziente è stata richiamata per i controlli una volta la settimana. Alla fine della terza settimana, si nota una parziale esposizione della testa della vite di osteosintesi, che viene mantenuta consigliando alla paziente applicazioni giornaliere di clorexidina in gel.
Al rientro chirurgico, dopo sei mesi, non si rilevarono residui della lamina né presenza di granuli di biomateriale, ma una neoformazione ossea compatta e ben vascolarizzata. La parziale esposizione della testa superiore della vite di fissaggio indicava che si era verificato un minimo riassorbimento verticale del materiale di innesto (figura 3).
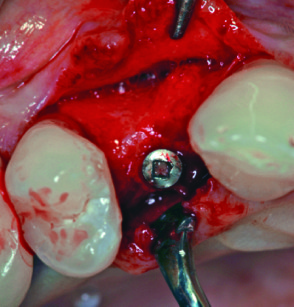
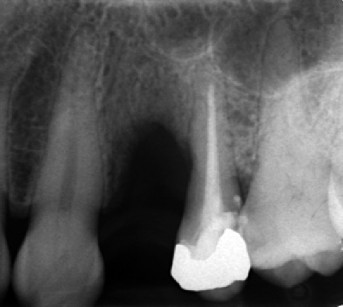
L’aumento della cresta era quantificabile in 5 mm in senso orizzontale e 4 mm in senso verticale. Rimossa la vite, con una fresa trafilatrice avente diametro esterno di 3 mm si preleva una piccola porzione dell’osso rigenerato per l’esame istologico (figura 4).
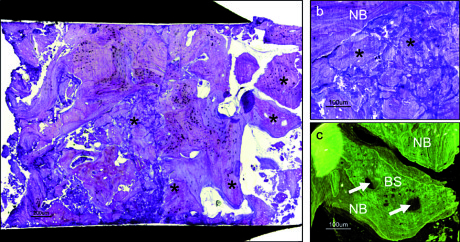
nella zona d’inserzione dell’impianto:
(a) la biopsia a cinque mesi mostra osso maturo. Le particelle di sostituto osseo (*) sono difficilmente distinguibili dall’osso (bar = 200 µm).
(b) Primo piano del centro del campione dove sono visibili particelle di sostituto osseo (*) ben integrate nel nuovo osso (NB = new bone) (bar = 100 µm).
(c) si notino il rimodellamento e la formazione di osteoni (frecce) all’interno di una particella di sostituto osseo (BS). Colori invertiti (bar = 100 µm).
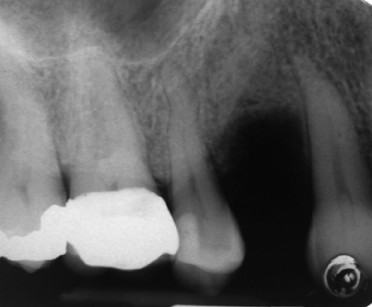
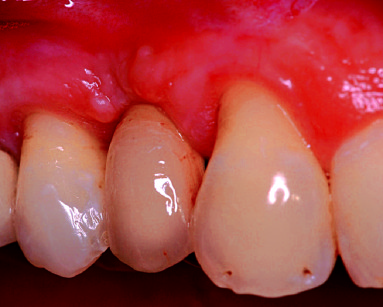
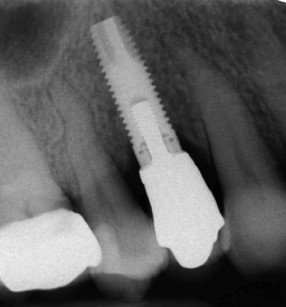
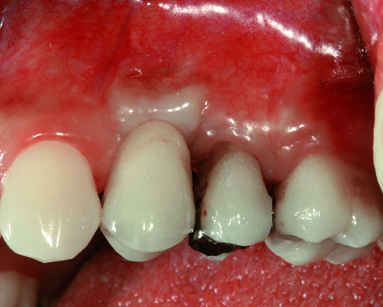
Successivamente, si completa la preparazione dell’alveolo implantare e inserendo un impianto di 13 mm di lunghezza e 4 mm di diametro (Neoss Ltd, Harrogate, UK) ottenendo una buona stabilità primaria (ISQ 71). Una cappetta di guarigione transgengivale di 3 mm di altezza in PEEK (polyetheretherketone) viene immediatamente inserita per gestire i tessuti molli ed evitare un’ulteriore intervento21. Dopo un periodo di guarigione di cinque mesi è stata nuovamente valutata la stabilità implantare (ISQ 78) e il controllo radiografico eseguito mostra l’impianto ben integrato nell’osso basale. Successivamente, l’impianto è stato restaurato con una corona in oro-ceramica (figure 5 e 6).
Secondo caso
Una paziente di anni 38 si è presentata alla nostra osservazione con un esito di avulsione traumatica dell’elemento 2.4 (figura 7).
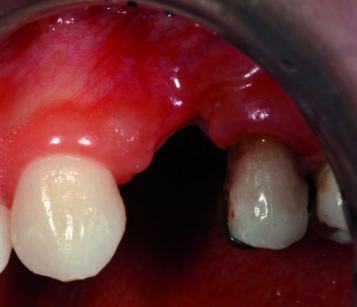
La zona residua presenta un grave difetto orizzontale e verticale e, in particolare, una perdita di attacco di circa 7 mm, mesialmente all’elemento 2.5 (figura 8).
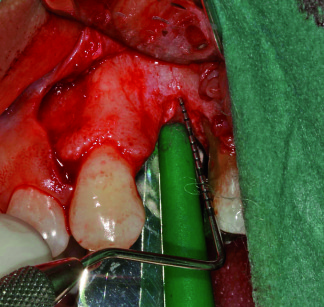
Come da protocollo, la zona è stata anestetizzata e scheletrizzata e, dopo aver praticato molti fori nell’osso da innestare, è stata posizionata una vite da rigenerazione (Memphix, Straumann) che presentava una parte liscia di 5 mm al di fuori dell’osso (figura 9).
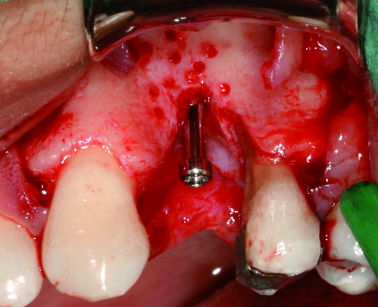
Una lamina corticale soft (OsteoBiol Lamina, Tecnoss) è stata modellata e fissata con due mini viti (5 mm di lunghezza e 1,2 mm di diametro, Graftek fixation screws, Roen) vestibolarmente al difetto e, successivamente, al pin Memphix occlusalmente. Dopo aver ben adattato la lamina corticale, il difetto è stato riempito con una miscela di collagene e osso (OsteoBio Gen-Os e Ge 10, Tecnoss) e, successivamente, ricoperto con la lamina corticale (figura 10).
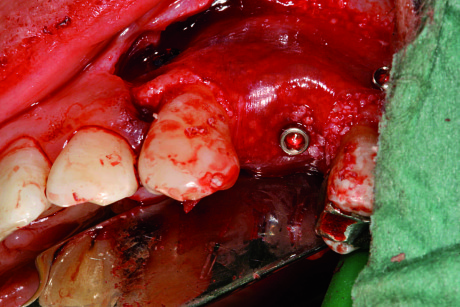
Il rilascio del lembo con un’incisione periostale e l’uso di suture a materassaio hanno permesso la chiusura del lembo e la copertura dell’innesto per tutto il periodo di guarigione. Dopo un’attesa di sette mesi, senza sintomi né segni di infiammazione o infezione, si è proceduto alla riapertura di un lembo, all’eliminazione delle viti e alla preparazione del sito implantare con una fresa Trephine per le valutazioni istologiche utilizzando una guida chirurgica.
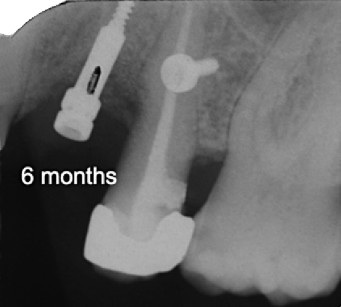
Il sito è stato perfezionato utilizzando una fresa di diametro 3,2 mm e counterbore. È stato, quindi, inserito un impianto Neoss (lunghezza 13 mm e diametro 4 mm) ottenendo un’ottima stabilità primaria (ISQ 77). Le misurazioni ossee hanno rilevato un incremento di 5 mm in senso verticale e di 4 mm in senso orizzontale; inoltre, mesialmente al secondo premolare, si è notato un guadagno di attacco localizzato (figura 11).
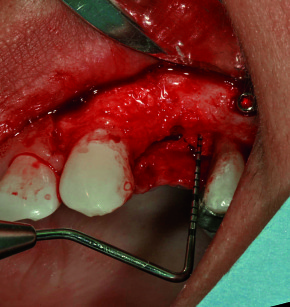
Dopo cinque mesi, si è proceduto con la riapertura del sito, il posizionamento immediato di un abutment in zirconio e di una corona provvisoria ed è stato misurato un incremento nei valori della frequenza di risonanza (ISQ 81). Un lembo disepitelizzato, ribaltato vestibolarmente, ha contribuito a ristabilire un’adeguata quantità di gengiva aderente e riposizionare i livelli della linea muco gengivale. Dopo quattro mesi è stata cementata una corona definitiva in zirconio e ceramica (figura 12).
Una radiografia endorale finale ha confermato l’aumento e la stabilità dell’incremento osseo (figure 13-15).
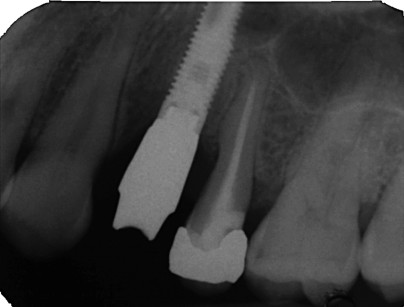
L’esame istologico della biopsia ossea del sito mostra particelle del sostituto osseo ben incorporate e osso denso (figura 16).
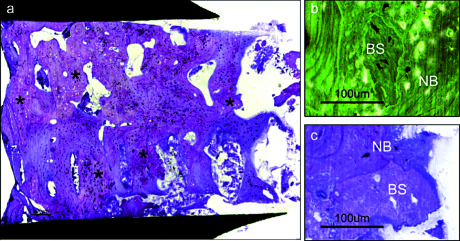
sul sito implantare:
(a) si notino le particelle di sostituto osseo (*) e la presenza di osso maturo denso (bar = 200 µm).
(b) A maggiore ingrandimento, si nota una particella di sostituto osseo (BS) incorporata in nuovo osso (NB). Colori invertiti (bar = 100 µm).
(c) Si notino una particella di sostituto osseo (BS) e osso neoformato (NB) (bar = 100 µm).
Conclusioni
I risultati di questo studio, clinico e istologico, suggeriscono che l’utilizzo di una miscela di gel collagene (OsteoBiol Gel 0, Tecnoss) amalgamato a osso collagenato di origine suina (OsteoBiol Gen-Os, Tecnoss) come materiale riempitivo in combinazione con una lamina corticale ossea (OsteoBiol Lamina Corticale Soft, Tecnoss) possono aumentare l’osso di creste alveolari in difetti localizzati, in preparazione all’inserimento di impianti dentali. Questa particolare associazione di materiali permette una manipolazione resa agevole grazie alle proprietà adesive e contenitive che ne derivano. Nei casi trattati, si è assistito a un incremento delle creste, sia verticale sia orizzontale, di circa 4-5 mm e a un aumento del volume del tessuto molle locale che ha permesso l’inserimento degli impianti in una posizione appropriata, tale da soddisfare criteri funzionali ed estetici. Non vi sono state complicanze, se non in uno dei due casi, quando, dopo circa tre settimane, si è assistito a una parziale esposizione della testa della vite di osteosintesi che non ha, peraltro, dato origine ad alcuna reazione infiammatoria o infettiva e senza, comunque, influire sulla guarigione ossea. Tali dati testimoniano l’ottimale biocompatibilità dei materiali utilizzati. La comparazione dei valori di ISQ, al momento dell’installazione degli impianti e al momento del posizionamento degli abutment, dopo dieci mesi, ha evidenziato, in entrambi i casi presentati, un aumento significativo (primo caso: da 71 a 78; secondo caso: da 77 a 81) e ciò indica che è in atto un evidente processo di rimodellamento osseo, tendente verso un maggior addensamento e maturazione del nuovo tessuto osseo. I risultati degli esami istologici, compiuti a sei mesi dalla GBR, hanno evidenziato la presenza di osso maturo nelle due biopsie (figure 4 e 15); le particelle di osso suino risultavano ben incorporate e difficilmente distinguibili con l’osso nativo e, in alcune zone, si poteva annotare rimodellamento con parziale riassorbimento delle particelle e la formazione di nuovo osso. Particelle senza contatto osseo potevano essere viste occasionalmente nelle zone più profonde della biopsia. Dati simili sono stati riportati anche da Nannmark e Sennerby18 su un modello animale: gli autori hanno valutato le risposte del tessuto osseo al PCPB, con o senza gel di collagene, ricoperto con una membrana in collagene (OsteoBiol Evolution, Tecnoss). Gli esami istologici, compiuti a otto settimane, hanno mostrato un riassorbimento attivo dei materiali, presenza di osso maturo e rivascolarizzazione della parte mineralizzata e del tessuto molle e, infine, che la membrana in collagene stava subendo una degradazione attiva. È possibile concludere, quindi, che questo studio ha fornito evidenza clinica e istologica, negli esseri umani, del potenziale rigenerativo della combinazione dei tre materiali utilizzati (OsteoBiol Gel 0, Osteo Biol Gen-Os, OsteoBiol Soft Cortical Lamina, Tecnoss), ma per poter trarre maggiori conclusioni sono necessari ulteriori studi clinici e, soprattutto, monitorare i risultati a lungo termine degli impianti inseriti dopo essere stati sottoposti a carico funzionale.
Corrispondenza
dottor Luca Pagliani
Via G. Mercalli, 11 – 20122 Milano
luca.pagliani@tin.it
2. Lekovic V, Kenney EB, Weinlaender M, et al. A bone regenerative approach to alveolar ridge maintenance following tooth extraction. Report of ten cases. J Periodontol 1997;68:563-570. 3. Araujo MG, Lindhe J. Dimensional ridge alteration following tooth extraction. An experimental study in dog. J Clin Periodontol 2005;32:212-218. 4. Johnson K. A study of the dimensional changes occurring in the maxilla following tooth extraction. Aust Dent J 1969;14:241-244. 5. Buser D, Dula K, Hirt HP, Schenk RK. Lateral ridge augmentation using autografts and barrier membrane: a clinical study with 40 partially edentulous patients. J Oral Maxillofac Surg 1996;54:420-432. 6. Dula K, Hirt HP, Berthold H. Localized ridge augmentation using guided bone regeneration. In: Buser D, Dahlin C, Schenk RK (eds). Guided bone regeneration in implant dentistry. Chicago: Quintessence, 1994:189. 7. Dahlin C, Andersson L, Linde A. Bone augmentation at fenestrated implants by an osteopromotive membrane technique. A controlled clinical study. Clin Oral Impl Res 1991;2:159-165. 8. Schenk RK, Buser D, Hardwick WR, Dahlin C. Healing patter of bone regeneration in membrane-protected defects. Int J Oral Maxillofac Impl 1994;9:13-29. 9. Scantlebury VT. 1982-1992: a decade of technology development for guided tissue regeneration. J Periodontol 1993;64:1129-1137. 10. Hardwick R, Scantlebury VT, Shanchez R, Whitely N, Ambruster J. Membrane design criteria for guided bone regeneration of the alveolar ridge. Guide bone regeneration in implant dentistry. Chicago: Quintessence, 1994:101-136. 11. Misch CM, Misch CE, Resnik RR, Ismail YK. Reconstruction of maxillary alveolar defects with mandibular symphysis grafts for dental implants: a preliminary procedural report. Int Oral Maxillofac Impl 1992;7:360-366. 12. Simion M, Jovanovic SA, Trisi P, Scarano A, Piattelli A. A vertical ridge augmentation around dental implants using a membrane technique and autogenous bone or allografts in humans. Int J Period Rest Dent 1998;18:9-23. 13. Proussaefs P, Lozada JL, Kleinman A, Rohrer M. The use of ramus autogenous block grafts for vertical alveolar ridge augmentation and implant placement: a pilot study. Int J Oral Maxillofac Impl 2002;17:238-248. 14. Skoglund A, Hising P, Young C. A clinical and histologic examination in humans of the osseous response to implanted natural bone mineral. Int J Oral Maxillofac Impl 1997;12:194-199. 15. Kent JN, Quinn JH, Zide MF, Guerra LR, Boyne PJ. Alveolar ridge augmentation using nonresorbable hydroxyapatite with or without autogenous cancellous bone. J Oral Maxillofac Surg 1983;41:629-642. 16. Holmes R, Mooney V, Bucholz R, et al. A coralline hydroxyapatite bone graft substitute. Clin Orthop 1984;188:252-262. 17. Nevis M, Mellonig JT, Clem III DS, Reiser GM, Buser DA. Implants in regenerated bone: long-term survival. Int J Period Rest Dent 1998;18:35-45. 18. Nannmark U, Sennerby L. The bone tissue responses to prehydrated and collagenated cortico-cancellous porcine bone grafts: a study in rabbit maxillary defects. Clin Impl Dent Related Res 2008;10(4),264-70. 19. Pagliani L, Sennerby L, Anderson P, Verrocchi D, Meredith N. Insertion torque measurements during placement of Neoss implants. Applied Osseointegration Res 2008;6:36-38. 20. Sennerby L, Meredith N. Implant stability measurements using resonance frequency analysis: biological and clinical implication. Periodontology 2000 2008;47:51-66. 21. Volpe S, Verrocchi D, Andersson P, Gottlow J, Sennerby L. Comparison of early bacterial colonization of PEEK and titanium healing abutments using real-time PCR. Applied Osseointegration Res 2008;6:54-56.