Riassunto
I sistemi di ingrandimento e la microscopia ottica operatoria hanno permesso, nel recente passato, di ottenere una visibilità durante le manovre di chirurgia endodontica molto superiore al normale; queste innovazioni e le evoluzioni in termini tecnologici con strumentario di tipo ultrasonico hanno completato un quadro di rinnovamento dei materiali che ha consentito l’accesso a zone dell’endodonto apicale altrimenti non raggiungibili. Queste e altre peculiarità hanno permesso di raggiungere un livello di riproducibilità clinica delle procedure operative che ha migliorato la prognosi a lungo termine di elementi dentali altrimenti persi.
Queste e altre innovazioni in campo di microchirurgia endodontica saranno prese in esame e sviluppate in tutto l’articolo.
Negli ultimi cinque-sette anni la microchirurgia endodontica è stata protagonista di diversi progressi in ambito tecnologico, superando quanto fatto nei trent’anni precedenti. Tra questi, probabilmente la chirurgia endodontica è stata quella che ne ha giovato di più, in parte grazie all’introduzione del microscopio operativo, agli ultrasuoni e ai materiali per otturazione apicale. La chirurgia endodontica tradizionale utilizza un manipolo ad alta velocità, ampie osteotomie, frese rotonde per la preparazione dell’apice radicolare e per l’otturazione con amalgama1-4. Le tecniche moderne si avvalgono di ingrandimenti e illuminazione a elevata potenza, forniti dal microscopio operativo chirurgico o da un endoscopio, di una preparazione radicolare a ultrasuoni che consente osteotomie di dimensioni molto più piccole,di materiali biocompatibili per l’otturazione apicale - come IRM, Super EBA o MTA - che consentono e/o inducono la formazione di nuovo intorno all’apice della radice5-8. La metanalisi della letteratura ha riportato percentuali di successo cumulative ponderate per la moderna chirurgia endodontica, inclusa la preparazione con ultrasuoni dell’estremità radicolare e l’uso di materiali di otturazione biocompatibili del 91,6%9, se gli studi erano limitati all’illuminazione e all’ingrandimento, del 93,5%10 se a elevata potenza, mentre la percentuale di successo cumulativa per la chirurgia tradizionale era soltanto del 59,0%10.
La chirurgia apicale non è una sostituzione del ritrattamento endodontico non chirurgico, ma nei casi in cui la lesione periapicale è rappresentata da una ciste (circa il 15% quando si confrontano molti articoli11) o quando il canale anatomico non è rispettato; cioè quando il ritrattamento non può bypassare un ostacolo anatomico o causa una perforazione e vi è un’ostruzione nel canale, allora è indicata la chirurgia endodontica. La percentuale di fallimento del ritrattamento endodontico, quando non viene rispettata l’anatomia, si limita a circa il 40%12, suggerendo quindi la necessità di un’apicectomia predicibile e ben eseguita. Per quanto riguarda il trattamento endodontico non chirurgico, vi sono continui miglioramenti in fase di sviluppo delle tecniche di strumentazione e irrigazione ma, data la complessità nell’anatomia del sistema canalare, è facile comprendere perché è così difficile una pulizia completa13,14. La mancata conoscenza della microchirurgia endodontica, combinata con l’approccio aggressivo dei produttori di impianti dentali, ha portato all’estrazione di molti denti e alla loro sostituzione con impianti, quando invece un approccio chirurgico li avrebbe facilmente salvati. In una valutazione di più di 200 pazienti trattati in studi privati e in Università, l’85% ha riportato che l’esperienza chirurgica era stata uguale se non migliore di quella del trattamento radicolare convenzionale15.
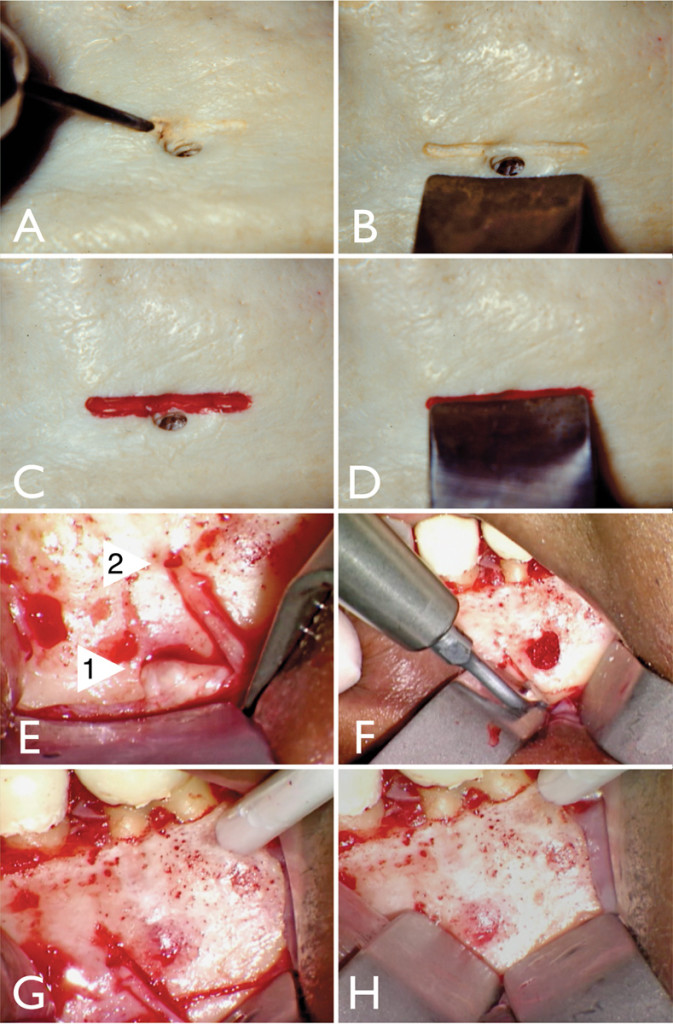
Da un punto di vista clinico, in passato la chirurgia endodontica comportava un rischio di potenziale danno al nervo mentoniero o al seno mascellare e, con osteotomie eccessive e profondi biselli delle superfici radicolari, spesso veniva rimossa un’eccessiva quantità di osso corticale e/o struttura dentale, ostacolando il processo di guarigione o distruggendo il rapporto corona/radice, rendendo così il dente non restaurabile. Ora si consiglia di eseguire una scanalatura mediante una fresa (Figura1 A-D) o mediante piezochirurgia (Figura 1 E-H) nella mandibola adiacente all’uscita del nervo mentoniero e appoggiare saldamente il retrattore in tale scanalatura, proteggendo così il fascio di nervi. Questo diminuisce fortemente il rischio di tagliare il fascio di nervi e, con uguale importanza, rimanendo fermi in una posizione sopra al nervo non si deve costantemente ri-regolare il retrattore, che esercita una pressione diretta sul fascio di nervi e facilita l’edema che è l’accumulo di liquidi nel sito chirurgico; entrambe queste situazioni comportano il rischio di una parestesia provvisoria.
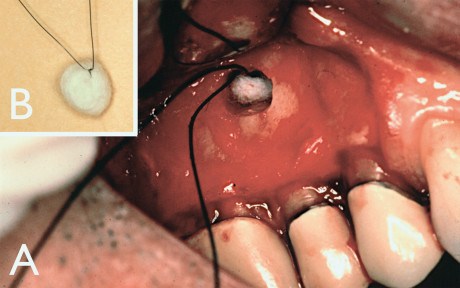
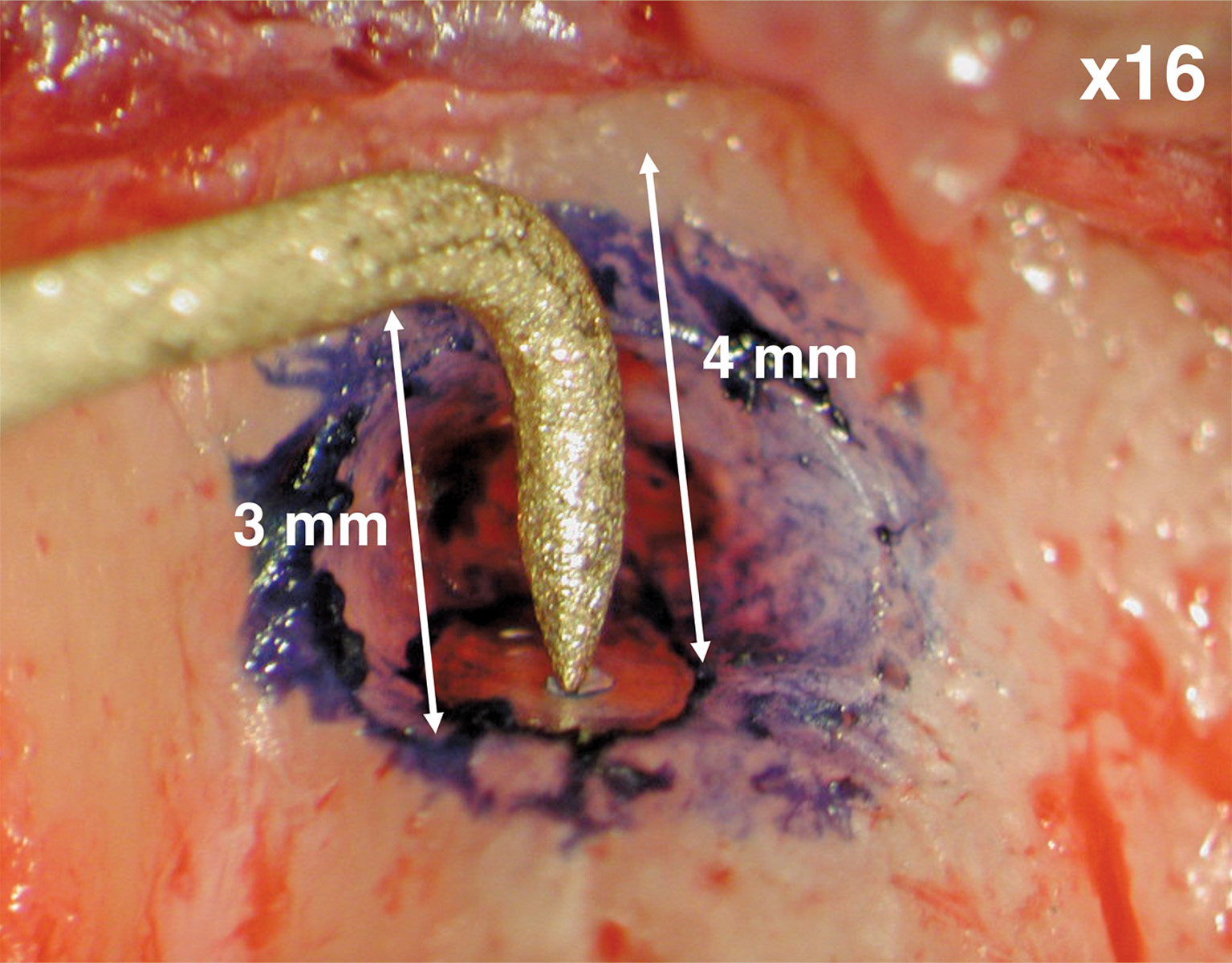
Per quanto riguarda il seno, sappiamo che una piccola perforazione attraverso la sua membrana non influisce sulla prognosi16 e per proteggere la cavità del seno da eccessivi residui che vi cadono dentro si applica una sutura attraverso una pallina di cotone spingendola direttamente nel seno e, usando la sutura, ritraendola come se si stesse pescando, occludendo così la perforazione nel seno e impedendo che possa inavvertitamente cadervi dentro qualcosa (Figura 2). Dopo la chirurgia, se la perforazione dell’antro è grande, allora si può prescrivere un antibiotico come Augmentin (amoxicillina con potassio clavulanato) e un decongestionante antistaminico Sudafed (fenilefrina) o Neo-synephrine (fenilefrina cloridrato). Al paziente viene anche detto di dormire con un ulteriore cuscino per sollevare la testa e, se possibile, di cercare di non starnutire per alcuni giorni. Le osteotomie eccessive vengono evitate lavorando con un microscopio e, a meno che il tessuto granuloso ne richieda una di dimensioni maggiori, consigliamo un’osteotomia di 4 mm di diametro (Figura 3). Questo consente un corretto inserimento di una punta a ultrasuoni da 3 mm per la preparazione dell’estremità radicolare, assicurandosi che la punta ultrasonica non tocchi l’osso, perché questo ostacolerebbe il suo corretto funzionamento. Una nuova generazione di punte a ultrasuoni, della B&L Biotec (Bala Cynwyd, Pennsylvania, USA) contiene una punta che può essere piegata (Figura 4 A-B) e che permette di applicare una curvatura personalizzata, fino a 2 mm se necessario, che consente di lavorare in un sito di osteotomia ancora più piccolo, cominciando con una punta ultrasonica da 2 mm e aumentando fino a una da 3 mm.
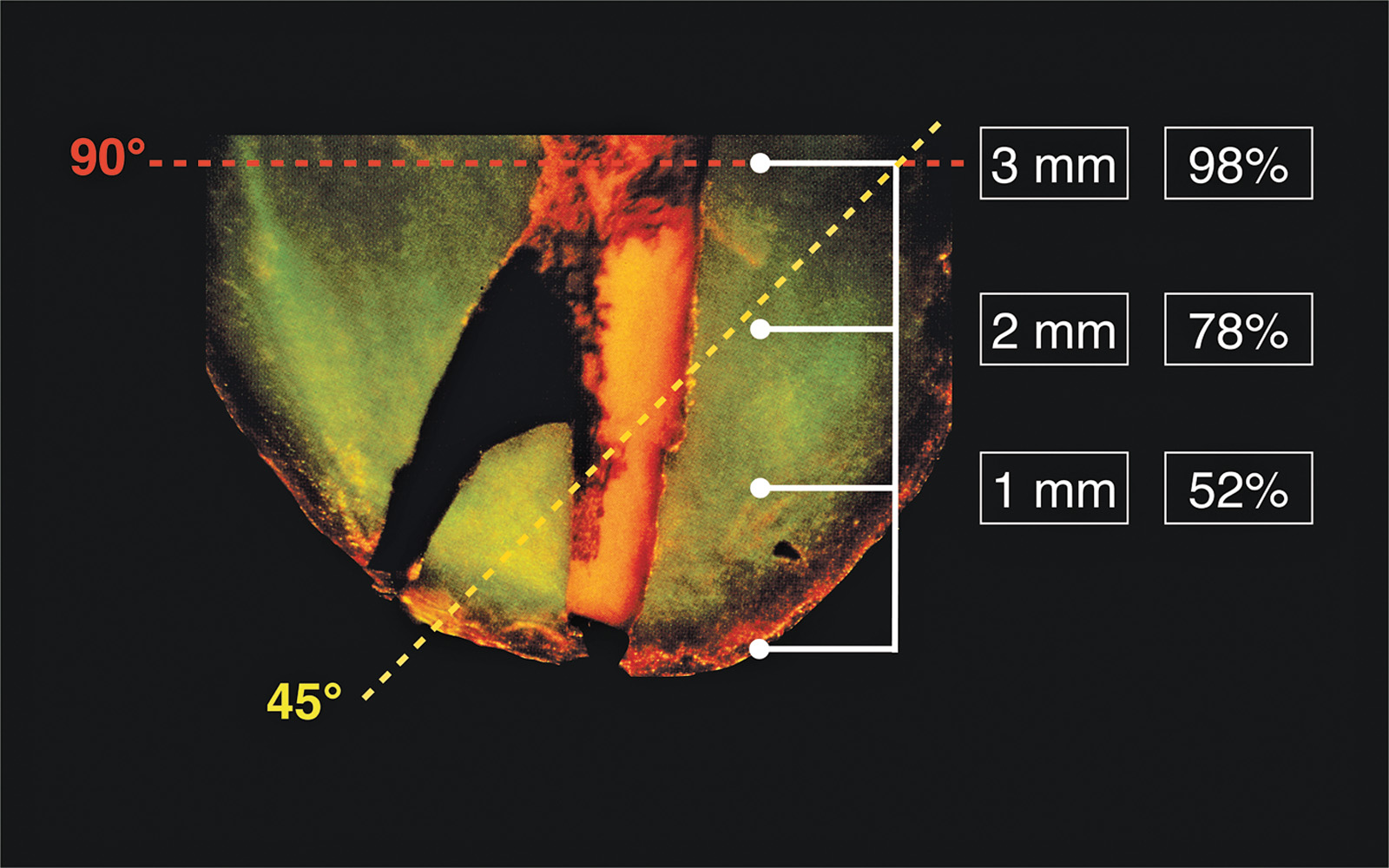
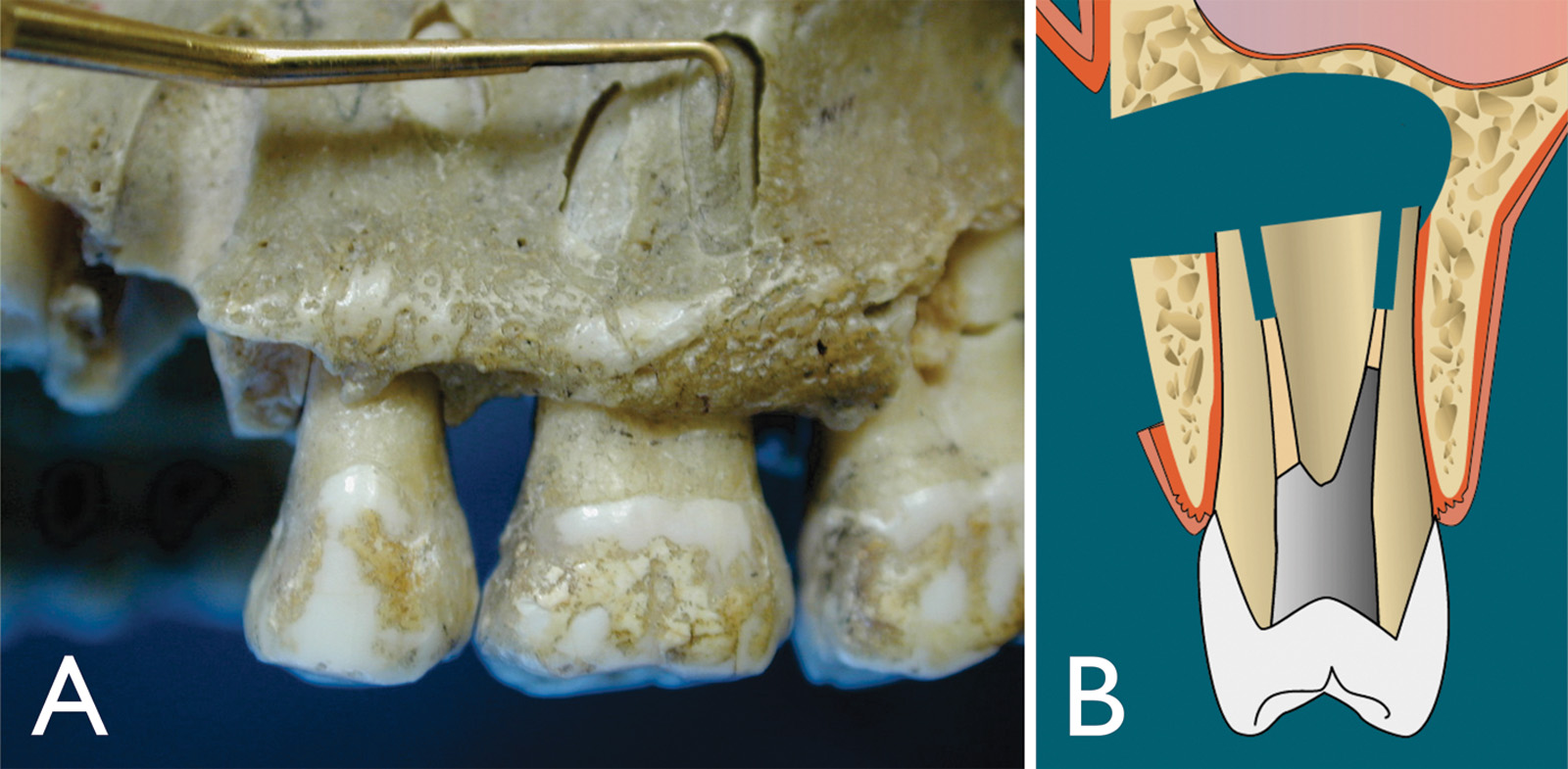
Sulla resezione della superficie radicolare si esegue un bisello poco profondo per essere sicuri di identificare tutti i principali canali (Figura 5). A 3 mm dall’apice, il 90% delle radici mesiobuccali dei molari superiori hanno un istmo, più dell’80% per le radici mesiali dei molari inferiori, nonché il 30% dei premolari superiori e inferiori. Una resezione apicale di 3 mm è cruciale, perché a questo livello il 98% delle ramificazioni apicali sarà eliminato così come il 93% dei canali laterali17. Questo assicura una percentuale di successo maggiore dovuta alla potenzialità di questi canali laterali/accessori di contenere batteri. Dopo la resezione dell’estremità radicolare, è imperativo colorare sempre l’estremità radicolare con blu di metilene. Il colore identificherà il legamento parodontale per assicurare una resezione completa, colorerà ogni canale mancato, nonché le linee di incrinatura o una frattura verticale (Figura 6 A-D). Il blu di metilene marcherà anche un istmo, che è una comunicazione tra i canali radicolari contenente tessuto pulpare (Figura 6 E-F)18.
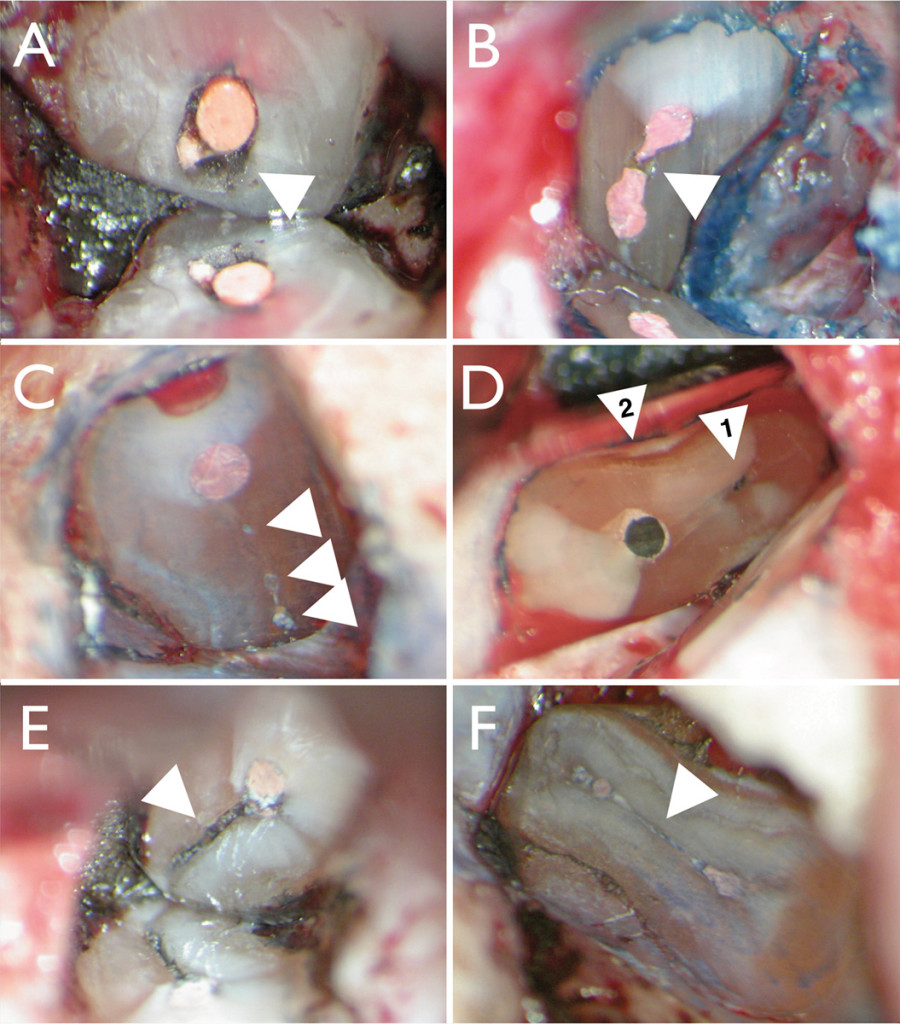
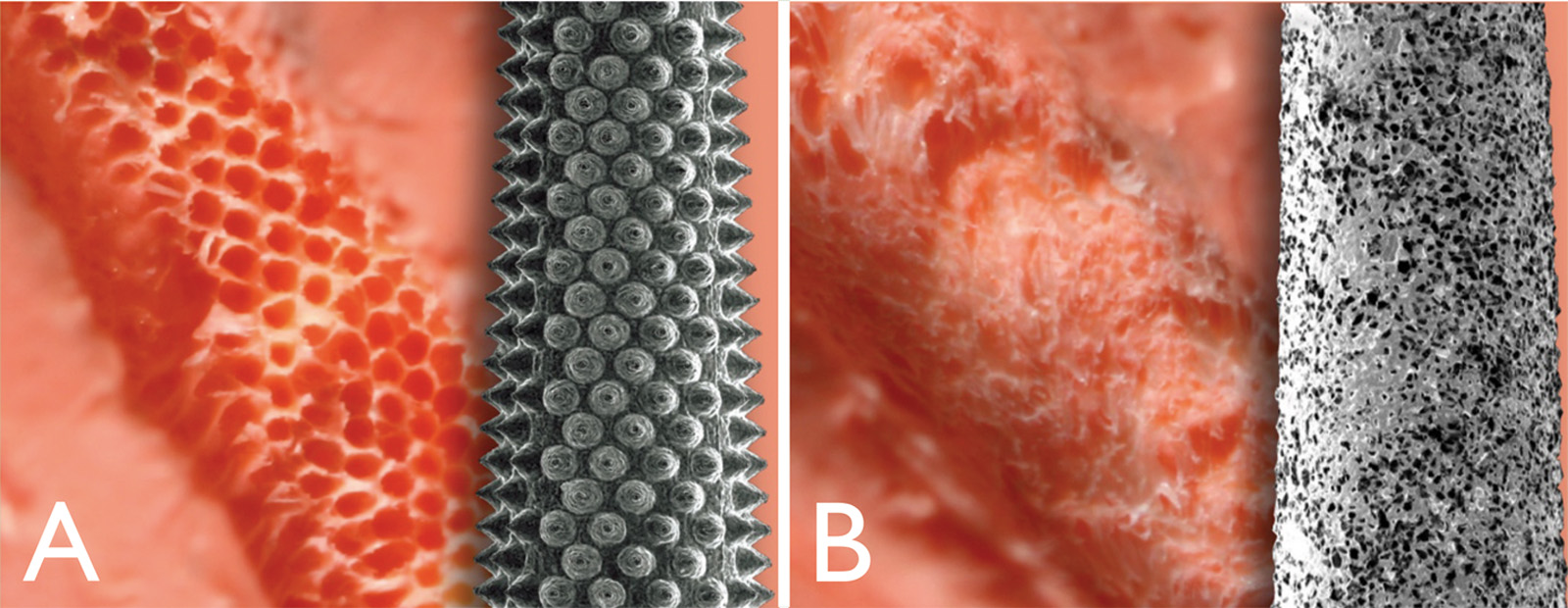
A 3 mm dall’apice, circa il 90% delle radici mesiobuccali dei molari superiori più dell’80% delle radici mesiali dei molari inferiori hanno un istmo19-20. Dopo la resezione apicale e l’ispezione con blu di metilene, il passo successivo è la preparazione dell’estremità radicolare mediante punte a ultrasuoni B&L Biotech. Queste punte contengono microproiezioni (Figura 4 C) che sono fuse sulla punta stessa, consentendo un’efficace preparazione dell’estremità radicolare, senza la preoccupazione di un materiale di rivestimento (ovvero il diamante) che si usura con l’uso, finendo nei tessuti. Le microproiezioni consentono una presa “salda” sulla superficie che si sta preparando, senza la necessità di frequenti sostituzioni della punta (Figura 7). Quando si inizia la preparazione a ultrasuoni, usare prima un ingrandimento basso e allineare la punta a ultrasuoni con l’asse lungo della radice. È preferibile rimanere il più parallelo possibile all’asse lungo per evitare di tagliare inutilmente la dentina, nonché per assicurare che il canale venga adeguatamente sigillato da 3 mm di d’otturazione (Figura 8). Un materiale ideale di riempimento deve creare un sigillo a prova di batteri, deve essere idrofilo a causa dell’ambiente in cui viene applicato ed essere osteo/cemento induttivo.
Forse, uno dei materiali più testati in odontoiatria negli ultimi anni è l’MTA (Mineral Trioxide Aggregate, Dentsply, York, PA, USA). Molti studi hanno dimostrato che l’MTA non solo è biocompatibile e permette la penetrazione di cemento e osso nella distanza di un normale legamento in cani21-23, ma ha anche qualità induttive24, proprietà antibatteriche e sigillanti e una guarigione radiografica più rapida rispetto ai materiali d’otturazione apicale21. Un prodotto più nuovo sul mercato è il materiale bio-ceramico EndoSequence Root Repair Material (Brasseler Corp. Savannah, GA, USA) che ha proprietà simili a quelle dell’MTA, ma è più facile da manipolare e da applicare. Però gli studi non sono ancora così completi e approfonditi come quelli sull’MTA. Dopo aver eseguito l’otturazione apicale, una domanda che spesso ci si pone è se sia necessario un innesto osseo o una membrana per rigenerazione guidata dei tessuti. Quando sull’apice del dente è presente tessuto di granulazione e vi è osso crestale intatto, per lo più si concorda che non vi è necessità di un innesto. L’osso del paziente è la miglior membrana naturale e la percentuale di successo sarà maggiore del 90%. Prima della sutura, il sito dell’osteotomia viene curettato al fine di stimolare il sanguinamento. Un coagulo ematico fresco non solo riempirà lo spazio, ma agirà anche come scaffold per permettere la formazione di nuovo osso. Il vero problema sorge quando nella lesione vi è una componente parodontale, cioè una fenestrazione dell’osso che espone la superficie radicolare o un sondaggio parodontale che dal solco comunica con la lesione apicale.
Vi sono così tanti sostituti ossei differenti e membrane disponibili che non è possibile trattarli tutti con un solo articolo. I materiali d’innesto osseo possono essere di origine umana (alloinnesto), porcina e bovina (xenoinnesti) o perfino artificiali. L’osso può essere mineralizzato o demineralizzato, derivare da osso corticale o spongioso, avere particelle di diverse dimensioni ecc. Le membrane attualmente disponibili si basano soprattutto su collagene porcino o bovino, ma possono anche essere artificiali (Vicryl o solfato di calcio), o derivare da organi come il rivestimento del cuore o l’intestino di animali. La membrana dovrebbe essere riassorbibile in modo che non sia necessaria una seconda chirurgia, come avveniva in passato con le Gore-Tex . Lo scopo di un innesto osseo è quello di mantenere lo spazio nel sito dell’osteotomia, mentre la membrana è indicata per mantenere l’innesto fermo e impedire all’epitelio di migrare nel sito. Vi è evidenza che suggerisce che l’osso riempie meglio il sito chirurgico con l’uso di una membrana e senza materiali di innesto, o addirittura senza niente26. In futuro, si spera che vengano raccolti dati sufficienti per stabilire protocolli esatti che indichino quando l’innesto è necessario e quale tipo sia il migliore per la chirurgia endodontica. Per chiudere il lembo si consiglia di usare suture che siano almeno 5,0 o anche più sottili. Se si usano suture più sottili, sarà necessario avvalersi del microscopio per la loro applicazione.
Le suture possono essere rimosse entro 48 ore e non più tardi di 72 ore. Questo permetterà una guarigione ottimale. Ogni paziente viene sottoposto a terapia con clorexidina allo 0,12%, iniziando due giorni prima della chirurgia e continuando per una settimana dopo. Questo, oltre a una terapia anti-infiammatoria come 600 mg di Ibuprofen 3-4 volte al giorno per 3 giorni, sarà sufficiente per il comfort del paziente. Una ricerca eseguita in precedenza su pazienti sottoposti a chirurgia ha evidenziato che il livello di dolore nei primi 3 giorni, secondo una scala da 1 a10 con 10 come massimo dolore, era soltanto di 4. In passato, la chirurgia endodontica aveva una scarsa considerazione, con risultati bassi fino al 37%, dipingendo un quadro irrealistico delle possibilità delle tecniche e dei materiali moderni27. Non è una sorpresa se, con questo tipo di informazioni errate, l’odontoiatra preferiva estrarre il dente e inserire un impianto, con una presunta percentuale di successo maggiore del 90%. Con le tecniche e gli strumenti innovativi utilizzati nella microchirurgia endodontica, si prevede una percentuale di successo di circa il 94%10, ed è quindi imperativo considerare la microchirurgia endodontica come un’opzione per salvare i denti naturali. La possibilità di eseguire la microchirurgia è una procedura efficace e di notevole successo che comporta un disagio minimo, allevia patologie periradicolari, mantiene i restauri e assicura funzione ed estetica.
Corrispondenza
Prof. Samuel Kratchman sikratch@comcast.net
Bibliografia
1. Tsesis I, Rosen E, Schwartz-Arad D, Fuss Z. Retrospective evaluation of surgical endodontic treatment: traditional versus modern technique. J Endod 2006;32:412-6.
2. Wesson CM, Gale TM. Molar apicectomy with amalgam root-end filling: results of a prospective study in two district general hospitals. Br Dent J 2003;20:707-14.
3. Halse A, Molven O, Grung B. Follow-up after periapical surgery: the value of the one year control. Endod Dent Traumatol 1991;7:246-50.
4. Rahbaran S, Gilthrope MS, Harrison SD, Gulabivala K. Comparison of clinical outcome of periapical surgery in endodontics and oral surgery units of a teaching dental hospital: A retrospective study. Oral Surg Oral Med Oral Pathol 2001;91:700-9.
5. Rubinstein RA, Kim S. Short-term observation of the results of endodontic surgery with the use of surgical operation microscope and Super-EBA as root end filling material. J Endod 1999;25:43-8.
6. Rubinstein RA, Kim S. Long-term follow-up of cases considered healed one year after apical microsurgery. J Endod 2002;28:378-83.
7. Taschieri S, Del Fabbro M, Testori T, Weinstein R. Endoscopic periradicular surgery: A prospective clinical study. Br J Oral Maxillofac Surg 2007;45:242-4.
8. Christiansen R, Kirkevang LL, Horsted-Bindslev P, Wenzel A. Randomized clinical trial of root-end resection followed by root-end filling with mineral trioxide aggregate or smoothing f the orthograde gutta-percha root filling-1-year follow-up. Int Endod J 2009;42:105-14.
9. Tsesis I, Faivishevsky V, Kfir A, Rosen E. Outcome of surgical endodontic treatment performed by a modern technique: a meta-analysis of literature. J Endod 2009 Nov;35(11):1505-11.
10. Setzer FC, Shah S, Kohli M, Karabucak B, Kim S. Outcome Of Endodontic Surgery: A Meta-Analysis Of The Literature - Part 1: Comparison Of Traditional Root- End Surgery And Endodontic Microsurgery. J Endod 2010;36:1757-1765.
11. Nair PN. Pathogenesis of apical periodontitis and the causes of endodontic failures. Crit Rev Oral Biol Med 2004;15:348-81.
12. Gorni FG, Gagliani MM. The outcome of endodontic retreatment: a 2-yr follow-up. J Endod 2004;30:1-4.
13. Hess W, Zurcher E. The anatomy of the root canals of the permanent dentition. New York: William Wood & Co, 1925.
14. Peters OA, Laib A, Rüegsegger P, Barbakow F. Three-dimensional analysis of root canal geometry by high-resolution computed tomography. J Dent Res 2000;79:1405-9.
15. Iqbal MK, Kratchman SI, Guess GM, Karabucak B, Kim S. Microscopic periradicular surgery: perioperative predictors for postoperative clinical outcomes and quality of life assessment. J Endod 2007;33:239-44.
16. Watzek G, Bernhart T, Ulm C. Complications of sinus perforations and their management in endodontics. Dent Clin North Am 1997;41:563-83.
17. Kim S. Osteotomy and apical root resection. In: Kim S, Pecora G, Rubinstein R. Color atlas of endodontic microsurgery. 1ed. Philadelphia: Saunders, 2000:85-94.
18. Weller RN, Niemczyk SP, Kim S. Incidence and position of canal isthmus. J Endod 1995;21:380-83.
19. Hsu YY, Kim S. The resected root surface. The issue of canal isthmuses. Dent Clin North Am 1997;41:529-40.
20. von Arx T. Frequency and type of canal isthmuses in first molars detected by endoscopic inspection during periradicular surgery. Int Endod J 2005;38:160-8.
21. Torabinejad M, Chivian N. Clinical applications of mineral trioxide aggregate. J Endod 1999;25:197-205.
22. Shin S. In-vitro studies addressing cellular mechanisms underlying the bone and dentin inductive property of mineral trioxide aggregate. Masters thesis in Oral Biology, University of Pennsylvania, Philadelphia, PA, 2004.
23. Baek SH, Lee WC, Setzer FC, Kim S. Periapical bone regeneration after endodontic microsurgery with three different root-end filling materials: amalgam, SuperEBA, and mineral trioxide aggregate. J Endod 2010;36:1323-5.
24. Baek SH, Plenk H Jr, Kim S. Periapical tissue responses and cementum regeneration with amalgam, SuperEBA, and MTA as root-end filling materials. J Endod 2005 Jun;31(6):444-9.
25. Fernández-Yáñez Sánchez A, Leco-Berrocal MI, Martínez-González JM. Metaanalysis of filler materials in periapical surgery. Med Oral Patol Oral Cir Bucal 2008;1;13:180-5.
26. von Arx T, Britain S, Cochran DL, Schenk RK, Nummikoski P, Buser D. Healing of periapical lesions with complete loss of the buccal bone plate: a histologic study in the canine mandible. Int J Periodontics Restorative Dent 2003;23:157-67.
27. Friedman S. The prognosis and expected outcome of apical surgery. Endod Topics 2005;11:219-262.