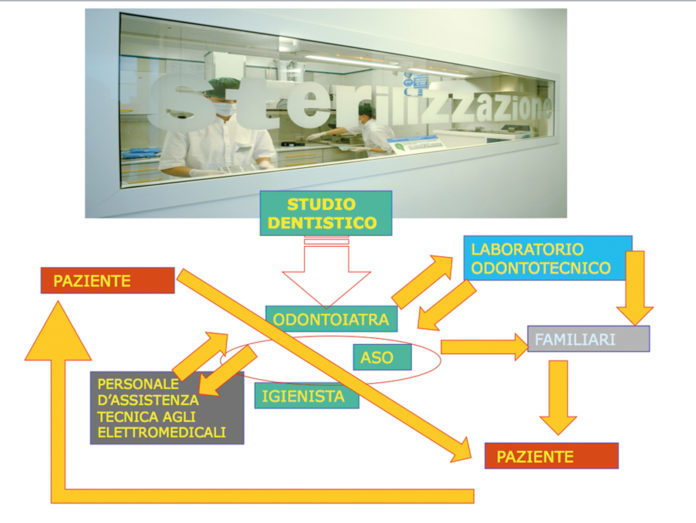
• Lorenzo Balsano
Riassunto
L’ambiente in cui operiamo, il cavo orale, e i complessi dispostivi medici che utilizziamo rendono particolarmente complicato il controllo del rischio biologico nello studio dentistico. I progressi dell’odontoiatria ci hanno portato a eseguire interventi ad alto profilo operativo-organizzativo che rendono i nostri studi sempre più simili a una sala operatoria. Conseguentemente, oltre alla prevenzione delle infezioni crociate, che deve essere garantita a ogni paziente e a tutto il personale addetto, è di fondamentale importanza assicurare la sterilità per molti degli interventi che eseguiamo. È necessaria quindi una gestione integrata delle procedure e dei protocolli per la sicurezza biologica: dalla definizione-organizzazione dello strumentario e degli ambienti di lavoro, alla relativa gestione nelle varie fasi di preparazione, riordino e sterilizzazione. Il responsabile dello studio odontoiatrico è chiamato ad adottare un modello gestionale per il controllo del rischio biologico. Gli stessi pazienti, sempre più attenti ed esigenti, hanno necessità di essere rassicurati sullo standard igienico; diventa fondamentale saper gestire questi elementi con efficacia e, al fine medico-legale, essere in grado di dimostrare in modo documentato, e rintracciabile, lo standard prodotto.
Summary
Cross infection and biological risk in dentistry
The environment we work on, the oral cavity, and the complex medical devices we use make particularly complicated verifying appropriate biological monitoring. Improvements in dentistry, new treatment techniques, methods and equipment enable dentists to use their operatories as if they were actual operating rooms of hospitals. Therefore, besides prevention of cross-contamination that must be guaranteed to each patient of our practice and to our staff members; the assurance concerning effective disinfection for many of the operations we perform is essential. It is necessary to co-ordinate procedures and written protocols to ensure biological control. Starting with the definition of the instruments and devices and of the work environment to the respective administration of processing, sterilization, packaging and storage. The individual responsible for the dental office must use a pattern to ensure biological monitoring. Dental patients are demanding more information and assurances concerning infection control. Patients want to know that precautions are being taken to prevent the spreading of harmful infectious agents. Records proving and providing you with documentation to use in case of medical legal action must be in compliance with professional standards.
L’infezione crociata trasmessa in corso di terapia odontoiatrica è un rischio conosciuto, ma sono ancora presenti aree che meritano un approfondimento di studio e ricerca. I soggetti esposti al rischio biologico sono gli operatori, i pazienti e le altre figure che, a vario titolo, possono essere potenzialmente infettate (Figura 1). Si stima che, in Italia, gli individui affetti da epatite C siano il 2-3% della popolazione con punte, in alcune regioni, del 15-20% nelle persone sopra i 60 anni (fonte: Amici per l’Epatologia, www.assofade.org).
Secondo l’OMS le terapie mediche e odontoiatriche sono, nell’Europa centro-meridionale, la prima causa di epatite B e la seconda per l’epatite C.
L’attività odontoiatrica si pone, tra le pratiche sanitarie, ai primi posti come co-fattore di rischio per le epatiti (dati dell’Istituto Superiore di Sanità – Servizio Epidemiologico Integrato dell’Epatite Virale Acuta–S.E.I.E.V.A., anno 2000). La cavità orale è una fonte di contaminazione per l’alta carica microbica presente e per la presenza di saliva e sangue.
Nel 2008 l’American Journal of Infection Control (36(4):304-7) ha pubblicato l’articolo: Evaluation of the risk of infection through exposure to aerosols and spatters in dentistry. Gli Autori hanno ricercato la presenza di emoglobina nell’aria e sulle superfici della sala operatoria odontoiatrica. Dopo il trattamento di pazienti, ove era previsto l’uso di manipoli rotanti e/o spray, l’emoglobina era presente nella quasi totalità dei campionamenti.
Il dato non sorprende: fin dal 1982 sullo J.A.D.A. (Allen AL, et al. Occult blood accumulation under the fingers. J.A.D.A. 1982;195:455-459) era evidenziato l’alto rischio di veicolare sangue occulto dalla bocca di un paziente all’altro. Ancor prima, nel 1980, Autio K.L. (Autio KL, et al. Studios on cross-contamination in the dental clinic. J.A.D.A. 1980;100:358-361) evidenziava l’alto livello di contaminazione crociata nello studio odontoiatrico: le specie batteriche presenti nella bocca di 20 pazienti erano isolate, al termine della terapia, nel 50-60% dei prelievi effettuati su pulsanti e maniglie del riunito e nel 76% dei casi tra le dita dell’operatore. Alcuni Autori (Montagna MT, Castiglia P, et al. Sanificazione nella pratica quotidiana, in Pasquarella C, Igiene in Odontoiatria. Bologna: Monduzzi Editore, 2004) hanno riportato che i campioni ambientali prelevati dopo attività odontoiatrica, su pazienti HCV positivi, risultano positivi nel 6% dei casi.
Gli stessi Autori in un lavoro ancora più recente (Italian multicenter study on infection hazards during dental practice: control of environmental microbial contamination in public dental surgeries BMC Public Health. 2008;8:187) hanno concluso che l’alta contaminazione ambientale (acqua-aria-superfici) in ambito odontoiatrico deve essere oggetto di attenzione e misure preventive per ridurre l’indubbio rischio infettivo connesso.
Nella contaminazione della sala operatoria odontoiatrica i materiali e gli strumenti, erroneamente posti a ingombro, aumentano il fattore di rischio di contaminazione delle superfici. Lo stesso ambiente di lavoro per sua natura “aperto”, privo degli isolamenti propri delle sale operatorie, e la promiscuità delle persone presenti nello studio costituisce un ulteriore fattore di rischio.
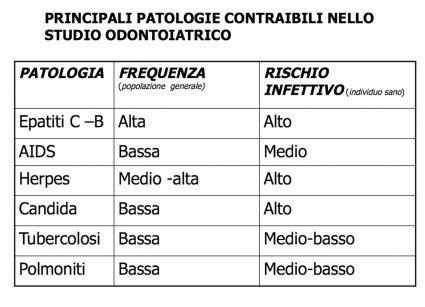
Le malattie trasmissibili in uno studio dentistico sono numerose, i microrganismi presenti nella saliva, nel liquido crevicolare e nella placca batterica appartengono a più di 40 specie diverse. A questi devono essere aggiunti i microrganismi provenienti dall’inquinamento dei circuiti idrici del riunito e dispersi dagli spray odontoiatrici. Nella Tabella 1 sono elencate le principali malattie per frequenza nella popolazione generale e il livello di rischio nell’individuo sano.
Rischio HBV e HCV
Il maggior rischio infettivo, in ambito odontoiatrico, fin da prima dell’AIDS, è rappresentato dai virus epatici. Nonostante l’incidenza dell’epatite B sia in diminuzione, si continuano a registrare nuovi casi. Nel 2010 sul Journal of Viral Hepatatis (17:307-316) N. Mahboobi ha pubblicato un articolo dove stimava, a livello globale, in 2 miliardi le persone che hanno contratto l’HBV e in 350 milioni i malati cronici HBV positivi. L’articolo concludeva che a fronte dell’incidenza che le cure odontoiatriche hanno nella trasmissione del virus HBV è necessario responsabilizzare “la società odontoiatrica” nel ribadire l’importanza di adottare tutte le precauzioni necessarie per prevenire diffusione.

Da considerare che il contagio da paziente a paziente del virus B non è documentato solo da dati epidemiologici e da modelli sperimentali, ma nel 2001 è stato descritto il primo caso di trasmissione di HBV paziente-paziente utilizzando tecniche di biologia molecolare (Redd JT, et al. Patient-to-Patient Transmission of Hepatitis B Virus Associated with Oral Surger. Journal of Infectious Diseases 2007;195:1311-14). I virus dell’epatite B e C rappresentano un rilevante problema a causa delle caratteristiche di contagiosità e resistenza. L’altro aspetto rilevante è la trasmissione dell’infezione con quantità infinitesimali di sangue. Dopo l’esposizione a una puntura accidentale, determinata su un modello sperimentale pari 0,038 microlitri, il rischio di contrarre l’infezione è del 15-30% per HBV e 3-15% per HCV (Tabella 2).
Rischio HIV
L’istituto Superire di Sanità (centro operativo AIDS) stima in 160.000 gli individui HIV positivi in Italia; di questi, 40.000 non sanno di esserlo. Si pone un problema non tanto per il controllo del rischio in ambito sanitario, le precauzioni universali sono ampiamente utili a controllare il rischio HIV. Il problema, per quanto estremamente basso nella frequenza, è clinico in relazione all’immunodeficienza non conosciuta dal paziente stesso e all’intempestività, di conseguenza, delle cure necessarie.
A ciò si aggiunge la problematica del controllo epidemiologico. In molti paesi, tra cui l’Italia, gli individui affetti non sono tenuti a informare il sanitario (legge 135/90) che è tenuto, pena sanzioni, a ottenere il consenso informato scritto prima di porre in essere domande anamnestiche in relazione alla positività per l’HIV.
La problematica clinica e di controllo epidemiologico che si è creata, in relazione alla necessità del consenso informato e alla non conoscenza della positività all’HIV, è ben conosciuta dagli organi di controllo internazionali. Il CDC “spinge” per l’abolizione di richiesta formale e consenso scritto per il test HIV e ne incoraggia l’accettazione volontaria. In un articolo comparso sul Journal of Dental Education nel 2007 (Vernillo AT, et al. Routine HIV Testing in Dental Practice: Can We Cross the Rubicon? Journal of Dent Educ 2007;71(12): 1534-1539) veniva validato un test rapido non invasivo (OraQuick Advance) per diagnosticare l’HIV dai fluidi orali. Si evidenziavano 2 vantaggi: il risultato del test è ottenibile in 20 minuti ed è altamente attendibile comparato al test ematico. L’articolo concludeva invitando all’integrazione, nella pratica odontoiatrica, dell’OraQuick Advance Test.
Per ciò che riguarda il rischio professionale, la probabilità di contrarre l’infezione da HIV, dopo esposizione percutanea, è dello 0,3% (Tabella 3) e può essere ridotto dell’81% con zidovudine (McCarthy GM, et al. Transmission of HIV in the dental clinic and elsewhere. Oral Dis 2002;8(2):126-135.

Un lavoro inglese del 2006 ha evidenziato che il rischio occupazionale per l’HIV rimane complessivamente basso, ma che è comunque necessario applicare i protocolli post-esposizione dopo puntura accidentale (Scully C. Human Immunodeficiency Virus. Transmission in Dentistry. J of Dent Res 2006;85(9):794-800). Raghunat Puttaiah (direttore del Centro di Controllo Infezioni del Baylor College of Dentistry, Thamus HCS, Dallas, Texas) ha ultimamente lanciato un appello relativamente al calo di attenzione verso il problema HIV facendo presente che il numero dei pazienti HIV positivi è in continuo aumento.
Rischio da agenti biologici non classici associati con le encefalopatie spongiformi trasmissibili
Sono caratterizzati da un’elevata resistenza a disinfezione e sterilizzazione tutti gli agenti biologici non classici associati con le encefalopatie spongiformi trasmissibili (TSE), quali la malattia di Creutzfeld-Jacob, la variante del morbo di Creutzfeld-Jacob, l’encefalopatia spongiforme bovina (BSE) e altre TSE degli animali a questa associate, la sindrome di Gertsmann- Straussler-Scheinker, il Kuru.
Un articolo del 2008 (Walker JT. Implications for Creutzfeldt-Jakob Disease (CJD) in Dentistry: a Review of Current Knowledge. Jour Dent Res 2008;87(6): 511-519) riproponeva, nell’impossibilità di escludere con certezza assoluta la trasmissione in ambito odontoiatrico, l’adozione di misure preventive (senza peraltro specificare quali).
Le linee guida dell’ISPELS (Istituto Superiore per la Prevenzione e la Sicurezza del Lavoro) non sembrano richiedere al dentista la gestione di questo specifico rischio, infatti recitano: “nel momento in cui in ambiente ospedaliero tale problematica dovesse assumere un’evidenza operativa, sarà necessario procedere allo studio e alla messa a punto di un metodo di sterilizzazione appropriato; a tale riguardo si potrebbe considerare la necessità di identificare un centro di riferimento almeno a livello regionale che affronti l’argomento nella sua criticità”.
Appare chiaro che se l’argomento è critico per gli ospedali diventa arduo pensare a una gestione in ambito odontoiatrico.
Rischio occupazionale nell’attività sanitaria
Da un punto di vista più generale il rischio occupazionale è legato al tipo di agente infettivo e al tipo d’intervento, invasivo o non invasivo, ed è quindi insito e ineliminabile nella pratica odontoiatrica come in molte delle attività sanitarie (Figura 2).

Le precauzioni universali dettate dal Center of Disease Control (CDC) di Atlanta, dall’Organization for Safety and Asepsis Procedures (OSAP) e da altri importanti organismi di controllo, sono state adottate e riportate in molte delle linee guida emanate per l’odontoiatria. Molte associazioni odontoiatriche, in primis l’American Dental Association (ADA) hanno ripetutamente pubblicato aggiornamenti.
Vie di trasmissione dell’infezione
Le malattie possono essere trasmesse sia per via diretta, dall’operatore al paziente o viceversa, che per via indiretta, da paziente a paziente o da paziente a operatore tramite contagio ambientale o dispositivo medico. Le modalità di trasmissione più comuni (Tabella 4), in ordine di gravità, sono:
- percutanea, presenta un alto rischio di trasmissione (tramite strumenti pungenti taglienti, punture accidentali o trattamento inadeguato dello strumentario tra un paziente e l’altro);
- contatto diretto, il rischio è anche in questo caso elevato: si verifica nell’esposizione di cute e mucose o lesioni infette (mancato uso/rottura guanti, specie se sono presenti microabrasioni sulle mani; oppure schizzi di materiale infetto sulla congiuntiva o sulle mucose);
- inalazione di aerosol contenenti patogeni provenienti da spray/strumenti rotanti; in questo caso il rischio è moderato;
- contatto indiretto, presenta rischio basso (toccare superfici contaminate) o moderato (toccare superfici contaminate e poi le mucose: catena di contaminazione mano/superficie/mano/bocca).

Per la prevenzione del contagio diretto è di fondamentale importanza l’uso sistematico dei mezzi di protezione individuale e della vaccinazione anti HBV. In questa sede si vuole porre l’attenzione sulla modalità di trasmissione indiretta, evidenziando le peculiarità del rischio connesso al veicolo; successivamente, saranno analizzate in dettaglio le strategie preventive per il controllo dell’infezione.
Veicoli di contaminazione e criticità in ambito odontoiatrico
Protesi e apparecchi ortodontici
I manufatti protesici e ortodontici, fin dall’impronta iniziale, sono veicoli di contaminazione poiché potenzialmente infettati tramite saliva e/o sangue del paziente. La prevenzione consiste nel lavaggio e nella disinfezione da effettuarsi prima dell’invio e al ritorno dal laboratorio odontotecnico (Figura 3).
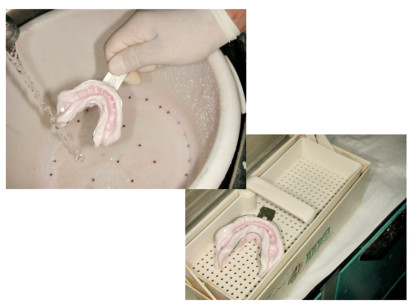
Altro aspetto da non trascurare sono i cosiddetti “ritocchi” in studio: se si vuole evitare la disinfezione del dispositivo a ogni “ritocco” (10 minuti in disinfettante a medio/alto livello ogni volta), è necessario approntare set sterili di frese da laboratorio.
Strumenti, ferri e frese
Con il termine dispositivo medico si indicano diversi presidi, qui di seguito elencati.
Strumenti semplici, come ferri, pinze, spatole, frese, puntali, pungenti e taglienti. Qualsiasi strumento entri in contatto con le mucose orali è un potenziale veicolo d’infezione (infezione percutanea: alto rischio). Fatto salvo il materiale monouso, che deve essere smaltito con le modalità di legge, questa tipologia di strumenti necessita della sterilizzazione preceduta da decontaminazione e detersione.
Pinze e strumentario ortodontico. Nel 1992 l’American Journal of Orthodontics (Compliance with infection control procedures among California orthodontists. Am Jour of Orthodont & Dentofac Orthoped;102 (1):68-75) pubblicava un articolo, frutto di un’indagine, sulla conoscenza del rischio infettivo tra gli ortodontisti californiani: l’articolo concludeva che gli ortodontisti dovevano migliorare le loro conoscenze e l’applicazione delle linee guida per la prevenzione del rischio. Ancora oggi la giovane età del paziente ortodontico rende meno percettibile il potenziale rischio (peraltro in parte fondato in quanto un giovane ha una probabilità minore, rispetto all’adulto, di essere HIV-HBV-HCV positivo, ma il fatto non costituisce una certezza e rimangono poi altre patologie trasversali per età) portando gli ortodontisti, più facilmente rispetto al generalista, a comportamenti “non idonei”: aprire cassetti e toccare materiale come catenelle elastiche, attacchi, fili ortodontici, legature, con i guanti contaminati. A ciò si deve aggiungere la difficoltà di approntare set sterili di strumenti dopo ogni paziente sia per motivi organizzativi che per i costi.
Strumentario rotante o assimilabile, manipoli dritti o contrangoli, turbine, manipoli a ultrasuoni. Come per la precedente categoria, il DM 28.09.1990 decreta l’obbligo di sterilizzazione per questi dispositivi. Sono strumenti che per conformazione (presenza di corpi cavi) ospitano con facilità sporco e micro-organismi, costituendo una fonte ad alto rischio per la trasmissione d’infezione. Il problema è conosciuto da tempo: nel 1992 sul Journal of Clinical Microbiology (Lewis D, et al. Cross-infection risks associated with current procedures for using high-speed dental handpieces. J Clin Microbiol;30(2): 401) è stato pubblicato un lavoro scientifico.
I ricercatori, sulla base delle evidenze di contrarre infezioni attraverso endoscopi usati in medicina a scopo diagnostico-terapeutico, ipotizzavano che anche gli strumenti odontoiatrici soggetti a lubrificazione, analogamente agli endoscopi, potessero essere un veicolo infettivo difficilmente controllabile. Lo studio concludeva che gli strumenti trattati con gluteraldeide al 2% mantengono la probabilità di trasmettere infezioni in una percentuale pari allo 0,3% e che è quindi necessario sterilizzarli in autoclave. In un lavoro del 1996 Franco Marci e Mauro Giannoni, dell’Università dell’Aquila (Marci F, Giannoni M. Prevenzione del rischio infettivo in ambiente odontoiatrico. Il Dent Mod;7:929-931), indicavano tra le principali cause che impediscono il controllo infettivo, nello studio dentistico, la carenza di sterilizzazione riguardante strumenti costosi quali le turbine. Le caratteristiche tecnologiche di questi strumenti rendono particolarmente difficoltosa la sterilizzazione: l’esito può essere “microbiologicamente” inefficace e deleterio per l’efficienza di manipoli e turbine. Se si associano gli elevati costi per il loro acquisto è facilmente intuibile, ma non giustificabile, il motivo per cui in alcune realtà sia praticata la disinfezione superficiale quale unica precauzione. Al contrario, il controllo del rischio per questa categoria di strumenti deve prevedere: disinfezione, pulizia e sterilizzazione.
Il riunito odontoiatrico
Il riunito (gruppo idrico-aspirazione-lampada-poltrona-tavolette-pulsanti) è uno strumentario complesso. Molte linee guida danno indicazioni sui metodi di disinfezione, ma non ci sono norme cogenti in merito al suo trattamento. Vi sono evidenze scientifiche sulla potenzialità di contaminazione del riunito: sul Brithish Medical Journal nel 1987 compariva un lavoro (Piazza M, Guadagnino V, et al. Contamination by hepatits B surface antigen in dental surgerics. British Med J;295:473-474) volto a riscontrare l’antigene virale dell’epatite B sulle superfici del riunito. Su 190 campioni prelevati (senza preavviso) in 15 diversi studi odontoiatrici, il 6,3% è risultato positivo. Conferma di presenza di sangue sulle superfici del riunito si è avuta recentemente (2008), come già citato nel paragrafo introduttivo a questo lavoro, sull’American Journal of Infection Control (Evaluation of the risk of infection through exposure to aerosols and spatters in dentistry. Am Jour of Infec;36(4): 304-307).
L’aerosol
L’aerosol, che si genera attraverso l’uso dello strumentario odontoiatrico trasporta sangue, saliva e microparticelle di tessuto proiettandoli nell’ambiente. La faccia degli operatori è colpita con forza da questo materiale, gli occhi e le vie respiratorie andranno quindi adeguatamente protetti: le mascherine devono essere sostituite dopo ogni paziente e gli occhiali di protezione lavati e disinfettati. È buona norma usare cuffie, sopracamici o bavagli da gettare dopo ogni intervento. Le superfici del riunito andranno sanificate al termine della seduta e ancor più ampiamente trattate a fine giornata.
Le cannule d’aspirazione e la bacinella
Questi strumenti sono costantemente attraversati da materiale potenzialmente infetto e, quindi, andranno disinfettate dopo ogni paziente. Un fenomeno poco conosciuto è il “back flow” (Figura 4): si tratta della possibilità di reflusso di un film normalmente presente nel primo tratto del tubo d’aspirazione, per la precisione nella cannula aspirasaliva posizionata in bocca al paziente.
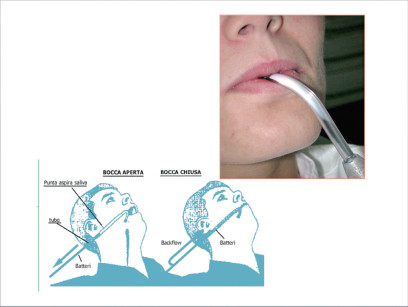
L’esistenza del fenomeno è stata confermata dall’Università Canadese di Alberta de Montreal. Nel 1997 l’American Dental Association (A.D.A.) e l’analoga associazione Canadese (C.D.A.) hanno segnalato ai loro associati la pericolosità del fenomeno e le precauzioni per prevenirlo. La necessità di disinfezione dei tubi di aspirazione e degli aspirasaliva dopo ogni paziente è stata indicata sulle linee guida emanate dalla Sanità della Regione Lombardia nel 2009.
Contaminazione anterograda: la Legionella pneumophila
La contaminazione per via “anterograda” (biofilm di batteri presenti nell’acqua di rete) dei circuiti idrici del riunito è un problema conosciuto da tempo: nel 1993 il ministero della Sanità tedesco ha emanato norme per il controllo della carica microbica nell’acqua dei riuniti. Nel 1995 l’A.D.A. invitava gli odontoiatri a predisporre controlli e strategie per mantenere i conteggi batterci inferiori a 200 CFU/ml mentre il Center Disease Control di Atlanta (CDC) indicava in 500 CFU/ml il limite quantitativo massimo. In particolare, la presenza di Legionella pneumophila e Pseudomonans aeruginosa (microrganismi non specifici delle tubazioni del riunito ma di tutti i circuiti idrici) può determinare, seppur in termini di bassa probabilità, il contagio. Secondo il CRA (Newsletter Clinical Research Associates 1999;4(12):1-3c) il contagio è da ritenersi possibile, ma improbabile. Sempre il CRA evidenziava che controlli effettuati su acqua distribuita sugli aerei o dalle fontanelle in uso negli uffici mostrava conteggi sovrapponibili a quelli dell’acqua dei riuniti di controllo. Sono molti i lavori in letteratura che sottolineano il basso rischio legionella in ambito odontoiatrico, ma recenti episodi hanno portato alla ribalta il problema: vediamone alcuni.
Nel 2008 è stato dimostrato il nesso causale tra morte per legionella/fonte circuito idrico del riunito (Reparto di Odontoiatria del Policlinico Umberto 1° di Roma).
Nel 2011 una donna di 82 anni, successivamente deceduta presso l’Ospedale G. B. Morgagni Pierantoni di Forlì, ha contratto la legionella dal dentista. Il caso è stato accertato dai ricercatori dell’ISS. È stato condotto uno studio che ha dimostrato la correlazione genomica tra i ceppi del battere, isolati dalle secrezioni respiratorie della paziente, e quelli isolati dal circuito idrico della poltrona odontoiatrica. Alla luce di quanto accaduto, l’Istituto Superiore di Sanità, in una nota pubblicata sul loro sito, ha invitato a controlli frequenti e attenzione nell’applicare le precauzioni necessarie. Le indicazioni date sono: l’utilizzo di sistemi di ricircolo e antistagnazione dell’acqua; servirsi di acqua sterile anziché di quella normalmente erogata; applicare trattamenti disinfettanti costantemente; flussare quotidianamente i rubinetti e gli strumenti che erogano acqua e sempre prima di ogni trattamento; applicare a monte degli strumenti, per esempio del trapano, dei filtri antilegionella; inoltre, monitorare almeno annualmente i livelli di contaminazione di legionella nell’acqua della poltrona odontoiatrica. Quanto indicato è ben oltre quanto previsto dagli organi internazionali di controllo, in primis il CDC; in particolare, non risulta che gli organi accreditati al controllo delle infezioni abbiano mai dato indicazioni rispetto a filtri antilegionella di cui tra l’altro non emerge, in letteratura, dimostrazione di efficacia nelle condizioni di applicabilità di un ambulatorio odontoiatrico. L’aggiornamento tecnologico scientifico è dovuto quando la letteratura e la ricerca danno evidenza di effettiva necessità del provvedimento preventivo e dell’efficacia dello stesso. La nota dell’ISS dà indicazioni estremamente utili, ma nel complesso sembra eccessivamente allarmistica considerando il rischio limitato confermato dai dati statistici pubblicati dallo stesso Istituto Superiore di Sanità. La letteratura recente conferma il basso rischio legionella in odontoiatria.
In un lavoro già precedentemente citato (Castiglia P, et al. Italian multicenter study on infection hazards during dental practice: control of environmental microbial contamination in public dental surgeries BMC Public Health. 2008;8:187), alcuni ricercatori italiani hanno condotto un’indagine su 104 riuniti in strutture pubbliche italiane: il 33% dei riuniti aveva presenza di legionella. In tutti gli strumentari non veniva mai superata la carica batterica complessiva di 500 CFU/ml indicata dal CDC come soglia di sicurezza per i riuniti odontoiatrici. Lo studio andava a integrare un lavoro condotto in più paesi europei: i dati italiani sono perfettamente sovrapponibili alle evidenze dell’indagine europea. Secondo le linee guida della CDC, la presenza di legionella, in mancanza di un caso accertato di malattia, non è sufficiente a far scattare provvedimenti preventivi mentre le linee guida di Pittsburgh indicano la necessità di monitoraggio preventivo, ma non è previsto nessun intervento se non dopo la soglia di attenzione che si pone a partire da 1000 CFU. A oggi, non è conosciuta la minima concentrazione infettante ma viene considerato altamente rischioso un livello pari o superiore a 10.000 CFU. In attesa di approfondimenti, rimane il fatto che in Italia la legionella è stata inserita tra gli agenti biologici di cui è obbligo fare valutazione del rischio nel DVR (Documento Valutazione dei Rischi), D.Lgs 81/08 (vedi scheda esemplificativa riportata in calce all’articolo). In una pubblicazione inglese del 1999 (Smith AJ, et al. Cross-infection control: water, water everywhere but not a drop to drink? Br Dent J 1999;186:12-4) si indicavano soluzioni in un’ottica costo/beneficio per il problema legionella. I costruttori di riuniti erano invitati a trovare soluzioni tecnologiche, cosa peraltro avvenuta (ormai tutti i nuovi riuniti sono dotati di disinfezione dei circuiti idrici), e si invitavano i dentisti a intercettare in anamnesi i pazienti maggiormente a rischio (defedati, con forme di immunodeficienza, con patologie sistemiche croniche specie respiratorie non compensate). In questi pazienti è opportuno utilizzare acqua sterile (anche semplicemente irrigata con siringa da 20 cc) anziché quella del riunito.
In ordine al tipo di disinfettante da utilizzare per il trattamento del circuito idrico, nel 2003 l’American Society for Microbiology ha pubblicato un interessante lavoro (JWalker JT, et al. Microbiological Evaluation of a Range of Disinfectant Products To Control Mixed-Species Biofilm Contamination in a Laboratory Model of a Dental Unit Water System. Appl Environ Microbiol 2003; 69(6):3327–32) nel quale sono stati presi in esame molti disinfettanti differenti per principio chimico e concentrazione: molti di questi si sono rivelati sufficientemente efficaci nel ridurre la carica batterica, mentre la rimozione del biofilm si è dimostrata difficile per la maggior parte dei prodotti. I migliori risultati si sono ottenuti erogando “in continuo” il disinfettante. La disinfezione saltuaria o periodica, anche con concentrazioni elevate di disinfettante, non ha prodotto risultati utili. L’atteggiamento corretto è quindi procedere alla disinfezione come indicato dal fabbricante.
Contaminazione retrograda
Ulteriori accertamenti e ricerca meriterebbe la verifica di una possibile contaminazione per via “retrograda” (dalla bocca del paziente all’interno dei circuiti idrici del riunito). Da tempo sono disponibili dispositivi antirisucchio, o valvole similari, posti in essere su un’ampia gamma di manipoli e riuniti per evitare la retrocontaminazione; sono presidi tecnologici utili, ma non costituiscono barriere assolute, in particolar modo se usurati dai cicli d’utilizzo. Inoltre, è lecito ipotizzare la retrocontaminazione per capillarità. Esiste uno studio che dimostrerebbe la possibilità di passaggio di batteri e di virus dal paziente all’interno delle tubature idriche del riunito.
Si tratta di una ricerca monotematica, coordinata dal professor Giovanni Dolci nel 2000, con oggetto l’infezione crociata in odontoiatria (Atti del VII-VIII-IX-X Congresso Nazionale del Collegio dei Docenti di Odontoiatria). Il lavoro concludeva evidenziando la possibilità di controllare il rischio infettivo da retrocontaminazione eseguendo un ciclo di disinfezione dei circuiti idrici, utilizzando TAED (Tetra Acetil Etilene Diammina) + generatore di perossido (sodio perborato). Nel 2003, il dipartimento d’Igiene e Sanità Pubblica dell’Università di Perugia pubblicava un lavoro sperimentale (Savino A, Minelli L, et al. Decontaminazione batterica dei riuniti odontoiatrici.
Il Dentista Moderno 2003;7:79-102) sulla possibilità di retrocontaminazione: lo studio escludeva tale possibilità in un riunito dotato di un sistema antiretrocontaminante denominato “Out Drop no– retraction” (ODR), e valutava efficace, al fine del controllo microbiologico del circuiti idrici, la disinfezione con acqua ossigenata al 3%. Alla luce di questi lavori, la quasi totalità dei costruttori ha implementato i sistemi di disinfezione per i circuiti idrici del riunito. È necessario attenersi a quanto indicato nei libretti d’istruzione d’uso.
La sala odontoiatrica: aria e superfici
L’aerosol prodotto dagli strumenti rotanti è in grado di contaminare l’aria e ogni superficie della sala operativa; tuttavia, da un punto di vista pratico solo le superfici del riunito, in quanto vengono “toccate” con guanti o con strumenti contaminati, devono essere trattate secondo standard clinico. Le altre superfici – quali pareti, pavimenti o arredi non direttamente contaminati per contatto diretto – sono classificate dal CDC come housekeeping surfaces. Sono aree che più difficilmente entrano nella catena di trasmissione dell’infezione e per le quali è consigliata la pulizia con acqua e detersivo non necessariamente seguita dalla disinfezione. Rimane di fondamentale importanza che mobili e servomobili rimangano liberi da ingombri durante la seduta: il materiale esposto può contaminarsi. Numerosi studi hanno evidenziato come l’intervento odontoiatrico produca una notevole contaminazione microbiologica dell’aria; meno documentata, ma altrettanto importante, è la contaminazione particellare. Per ottimizzare la catena igienica si deve assicurare un ricambio adeguato d’aria e, quando possibile, implementare sistemi per l’abbattimento della carica batterica e particellare (pulviscolo e particelle da 0,3 a 5 micron). La contaminazione particellare costituisce un degrado fisico della qualità dell’aria respirata e un veicolo per il trasporto dei microrganismi. Il trattamento dell’aria riduce le infezioni aerogene, migliora lo standard igienico delle superfici (evitando la ricaduta dei microrganismi) e riduce l’affaticamento degli operatori (inefficienza fisica da inquinamento dell’aria).
Prevenzione del rischio biologico
È indispensabile adottare dei rigidi protocolli per il controllo del rischio biologico. Procedure di decontaminazione non idonee aumentano enormemente il fattore di rischio: nel 2010 la John Cochrane Veteran Administration ha notificato a 1800 pazienti che avevano subito trattamenti odontoiatrici presso i loro centri che potevano essere stati esposti a infezioni virali a seguito di procedure di sterilizzazione “non idonee”. È importante adottare il principio di precauzione e applicare le misure preventive indicate dagli organismi di controllo per ridurre il rischio (in calce all’articolo è proposta una scheda esemplificativa sulla gestione del rischio biologico, DVR in ambito odontoiatrico, D.Lgs.81/08). La decontaminazione di ambienti-strumenti-dispositivi medici è la pratica fondamentale per la prevenzione delle infezioni. In relazione al “rischio d’uso”, cui sono destinati superfici-strumenti-dispositivi medico, il protocollo deve prevedere: pulizia, disinfezione e sterilizzazione. La sterilizzazione è il metodo più efficace e affidabile per la prevenzione delle infezioni crociate, ma anche una condizione indispensabile per ottenere il successo terapeutico. Le associazioni scientifiche endodontiche raccomandano, al fine del successo della terapia, l’uso di strumenti sterili e la corretta preparazione del campo operatorio. L’esistenza di infezioni “biomaterial-centered” è stata più volte documentata: lo Staphilococcus epidermidis e lo Staphilococcus aureus sono stati rinvenuti in maniera significativa attorno a impianti falliti fin dal 1987 (Gristina AG. Biomaterial centered infection: microbial adhesion vs tissue integration. Science 1987;237:1588). La ricca flora batterica orale non giustifica il mancato rispetto dei protocolli di sterilità; non si deve confondere la contaminazione derivante da “commensali“, facenti parte dell’abituale flora della bocca, con la contaminazione proveniente dall’esterno. Fridberg, della Branemark Clinic di Goteborg, pubblicava nel 1996 un lavoro (Fridberg B. Sterile operating conditions for a placement of intraoral implants. J. Oral Maxillofacial Surg 1996;54:1334-36) che evidenziava l’opportunità di utilizzo della tecnica sterile, in campo sterile, per l’inserimento di impianti. L’impiego di strumenti non mantenuti sterili fino all’utilizzo e la gestione “non idonea” del campo sterile non possono essere sopperiti dalla terapia antibiotica. L’uso routinario degli antibiotici nell’implantologia e in chirurgia orale, sul paziente sano, continua a essere controverso e il loro ampio utilizzo non è ancora avvalorato da evidenza scientifica (Acocella A, et al. Efficacia della terapia antibiotica per l’inserimento di impianti dentali: revisione della letteratura e considerazioni cliniche. Tagete – Archives Of Legal Medicine And Dentistry 2010;1). L’applicazione di adeguate precauzioni consente di controllare il rischio biologico con un elevato livello di sicurezza. È necessario costruire un modello d’intervento, un sistema integrato che prenda in esame ognuno dei potenziali veicoli di trasmissione dell’infezione. L’errore umano è la causa più frequente d’incidenti: per questo motivo, è utile predisporre delle istruzioni scritte e formare gli addetti a ogni fase operativa indicando i mezzi e i supporti necessari per la corretta esecuzione.
Il rischio aumenta quando ci troviamo a operare su un individuo certamente infetto: se un paziente dichiara di essere HCV positivo la probabilità che lo sia è prossima al 100%. In questa situazione, oltre che per gli operatori aumenta il rischio (da potenziale a certo) di contaminazione ambientale e dei dispositivi medici. Fermo restando che è necessario considerare tutti gli individui potenzialmente infetti e applicare in tutti i casi le linee guida riconosciute dagli enti preposti, è di fondamentale importanza individuare, in fase di anamnesi, le persone infette. L’individuazione consente di operare, in un’ottica di rapporto rischio/costo/beneficio, delle precauzioni aggiuntive difficilmente applicabili nella procedura standard, per esempio camici monouso per gli operatori (dalle linee guida ISPESL-Istituto Superiore per la Prevenzione e la Sicurezza del Lavoro): “nel caso di protezione da patologie infettive emergenti di rilievo è preferibile impiegare camici monouso. Possono essere di diversa tipologia in relazione alle modalità lavorative e alle mansioni da espletare”). Dove possibile è consigliabile fissare l’appuntamento alla fine della giornata di lavoro. Se necessario, approntare un bagno fresco di disinfettante per la decontaminazione preventiva degli strumenti, specie se contaminati da sangue.
Inoltre, l’anamnesi è necessaria per la valutazione dello stato di salute generale del paziente anche se il portatore di epatite cronica non presenta nella maggior parte dei casi una sintomatologia clinica evidente.
È comunque necessario valutare il rischio medico connesso alle manovre odontoiatriche: nella malattia in fase di compenso il rischio è trascurabile, mentre nell’insufficienza epatica è tale da porre problemi (Montagna F. Prevenzione delle infezioni in odontoiatria: epatiti e AIDS. Roma: Edizioni Promoass, 1997). Ritornando alle strategie preventive, è bene ricordare che la prima regola in assoluto è la vaccinazione.
Vaccinazione contro HBV
Il vaccino contro l’epatite B è raccomandato, dal ministero della Salute, come elemento essenziale nella prevenzione delle infezioni da HBV dopo esposizione al virus. Tutti gli operatori sanitari sono invitati a vaccinarsi.
Il vaccino è eccellente sotto il profilo della sicurezza (CDC 1996); i sospetti destati in Francia sull’associazione vaccino HBV-malattie demielinizzanti del sistema nervoso centrale si sono mostrati privi di ogni fondamento (Acherid A, et al. 2001, Confavreux C, et al. 2001). La stessa OMS ha preso posizione nel 2004 a proposito degli inutili sospetti attorno al vaccino. I prodotti in commercio sono quindi sicuri e ben tollerati con un’efficacia fra l’85 e il 95% nel prevenire l’infezione. Dopo la vaccinazione primaria non sono necessari richiami: anche a distanza di 15 anni dalla vaccinazione primaria, l’esecuzione a scopo di ricerca di una dose HBsAg determina una risposta molto evidente, anche nei soggetti privi di anticorpi, a dimostrazione che le cellule della memoria sono state sufficientemente stimolate dalla vaccinazione primaria (Lin YC, Chang MH, Ni YH, Hsu HY, Chen DS. Long-term immunogenicity and efficacy of universal hepatitis B virus vaccination in Taiwan. J Infect Dis 2003;187(1):134-8).
Lavaggio delle mani
Le mani sono il veicolo principale delle infezioni di origine esogena. Le mani degli operatori sanitari possono trasferire i microrganismi patogeni da un paziente all’altro e dai pazienti al personale stesso. Il lavaggio delle mani è riconosciuto essere la prima e più importante metodica di prevenzione della trasmissione delle malattie infettive. Le mani vanno lavate con prodotti idonei quali:
- detergente liquido (composto che svolge un’azione pulente, senza azione antisettica);
- sapone antimicrobico (sapone detergente contenente un agente antisettico);
- antisettico idroalcolico.
Distinguiamo le operazioni di igiene in lavaggio sociale, frizione antisettica, lavaggio pre-operatorio. Il lavaggio sociale, eseguito con acqua e detergente è utile a inizio lavoro, dopo l’uso dei servizi igienici, dopo manovre sui pazienti che non comportino esposizione a materiale biologico.
La frizione antisettica è indicata quando non è possibile procedere al lavaggio con acqua e detergente e le mani non sono visibilmente sporche. Consiste nell’applicazione di un antisettico idroalcolico sull’intera superficie delle mani per ridurre il numero di microrganismi presenti prima dell’assistenza al paziente (visita medica e piccoli interventi), dopo aver assistito il paziente, dopo il contatto accidentale con materiali biologici e con strumenti e materiali potenzialmente contaminati incluse le apparecchiature medicali nelle immediate vicinanze del paziente, dopo la rimozione dei guanti. Il lavaggio antisettico (pre-operatorio) è utile per l’antisepsi delle mani degli operatori prima che indossino camice e guanti sterili nella procedure chirurgiche. Raccomandiamo di apporre la data di apertura sul flacone dell’antisettico e non utilizzarlo per più di 14 giorni, munire il contenitore di apposito erogatore ed eliminarlo insieme al flacone (non riutilizzarlo), non rabboccare i flaconi.
Inoltre, all’inizio del turno di lavoro rimuovere orologi, braccialetti e anelli; mantenere le unghie corte, curate e prive di smalto; non applicare unghie finte.
Sterilizzazione, ciclo di riutilizzo degli strumenti e classificazione dello strumentario
Il DPR 14 gennaio 1997, n.37, nella sezione “Requisiti minimi organizzativi”, prevede che in sala di sterilizzazione debba essere assicurata la presenza di almeno un infermiere.
Le linee guida hanno però più volte ribadito che in organizzazioni più piccole e più semplici rispetto agli ospedali, per esempio negli ambulatori odontoiatrici o chirurgici dove l’infermiere non sempre è disponibile, si possono individuare altre figure professionali con formazione specifica.
È però indispensabile una formazione adeguata del personale addetto alla sterilizzazione. Inoltre, è preferibile che l’intero processo venga periodicamente sottoposto a visite ispettive da parte di personale diverso da quello che ha responsabilità operative dirette.
Selezione dello strumentario da sterilizzare secondo la classificazione di Spaulding
Secondo la classificazione di Spaulding (1976) lo strumentario si divide, in base alla destinazione d’uso, in:
- articoli critici, strumenti che penetrano i tessuti molli, entrano in contatto con l’osso o i tessuti sterili;
- articoli semicritici, strumenti che entrano in contatto con le mucose integre;
- articoli non critici, strumenti che entrano in contatto con la cute integra.
Tale classificazione è stata assunta, anni addietro, nelle linee guida per l’odontoiatria emanate da molti enti governativi. Il progresso tecnologico e le conoscenze scientifiche ci hanno portato a un riflessione inerente la destinazione d’uso dello strumentario e la conseguente scelta del procedimento di sanificazione da applicare. Alcuni Autori hanno proposto modifiche alla classificazione di Spaulding, altri, hanno mosso “osservazioni” in relazione alla sua applicazione in campo odontoiatrico: nella classificazione originale è classificato semicritico lo strumentario che entra a contatto con le mucose integre (per esempio, specchietti, strumenti di conservativa e similari). La presenza di mucose integre è una supposizione che non trova riscontro nella cavità orale di molti pazienti. Nella pratica quotidiana, a cominciare gli strumenti per la diagnosi e, a maggior ragione, lo strumentario e le frese per Conservativa, Endodonzia e Protesi, finiscono spesso a contatto con il sangue.
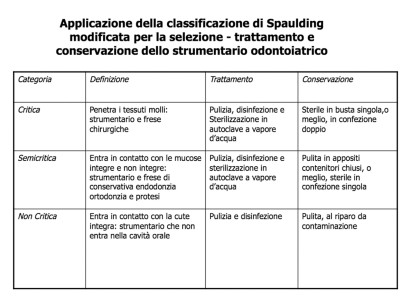
Inoltre, diventa complicato dare tracciabilità del processo. Volendo comunque attenerci alla classificazione di Spaulding è necessario un adattamento alla definizione classica dello strumentario semicritico (che entra cioè in contatto con mucose integre) in: strumentario che entra in contatto con mucose integre o non integre. Ciò è necessario per individuare il corretto trattamento di sanificazione in base alla destinazione d’uso dello strumentario. Quindi come suggerito da Raghunat Puttaiah (direttore del Centro di Controllo Infezioni Baylor College of Dentistry, Thamus HCS, Dallas, Texas) bisogna considerare la sterilizzazione il mezzo di trattamento idoneo sia per gli strumenti critici che per quelli semicritici. Alla luce delle attuali conoscenze scientifiche, e dei mezzi tecnologici disponibili, la sterilizzazione in autoclave a vapore d’acqua rappresenta il trattamento d’elezione per lo strumentario che entra nella cavità orale. Tutti gli strumenti che penetrano i tessuti (critici) e quelli che entrano in contatto con le mucose, integre o non integre (semicritici), devono essere sterilizzati. L’autoclave a vapore d’acqua consente un processo affidabile e applicabile a tutto lo strumentario, anche a dispositivi “delicati”. Di fatto, l’autoclave a vapore d’acqua (unitamente all’utilizzo dei dispositivi monouso) rende anacronistica la pratica della sterilizzazione a freddo e/o l’alta disinfezione dei dispositivi critici e semicritici. È invece possibile una differente conservazione dello strumentario: per quello chirurgico (critico) è necessaria la conservazione sterile (come minimo in busta singola, meglio in doppio involucro), per i dispositivi che non penetrano le mucose (semicritici) è possibile la conservazione pulita (l’imbustamento non è strettamente necessario, ma consigliato: attenzione perché certe ASL richiedono la tracciabilità, cosa difficile da dimostrare con lo strumentario non confezionato ed etichettato).
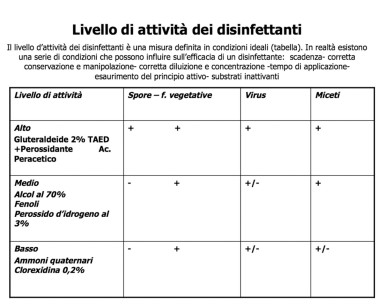
Possiamo quindi affermare che lo strumentario critico deve essere sterile e il semicritico sterilizzato, proponendo una selezione-trattamento-conservazione dello strumentario odontoiatrico come illustrato nella Tabella 5. Lo strumentario non critico può essere trattato, previa pulizia, con disinfettante di livello basso/intermedio (Tabella 6).
Il ciclo di sterilizzazione dello strumentario riutilizzabile inizia con la raccolta, non appena terminato l’intervento e si compone di 9 fasi:
- Raccolta;
- Decontaminazione preventiva;
- Detersione;
- Risciacquo;
- Asciugatura;
- Controllo e manutenzione;
- Confezionamento;
- Sterilizzazione;
- Stoccaggio.
In caso di esposizione accidentale (tagli, punture, schizzi di materiale potenzialmente infetto in bocca, negli occhi o a contatto con cute abrasa o lesa) occorre mettere in atto le seguenti misure preventive: Tutte le strutture sanitarie e di pubblico servizio devono mettere in atto un sistema di gestione delle esposizioni a rischio di infezione da HIV e da virus epatitici, compresa la possibilità di fornire la profilassi post-esposizione (PPE). Si ricorda (riguardo la PPE per l’HIV) che: Per tale motivo si raccomanda di mettere in atto tutte le misure organizzative possibili al fine di consentire l’inizio della PPE nei tempi previsti.
Non sono raccomandate le applicazioni di agenti caustici (per esempio, candeggina) o l’inoculazione di antisettici o disinfettanti all’interno della ferita;
La decisione di iniziare la PPE spetta unicamente all’esposto (che dovrà firmare sull’apposito modulo di consenso informato se accetta o non accetta la PPE), al quale devono essere spiegate in dettaglio le conoscenze attuali su efficacia, sicurezza e tossicità del trattamento da personale esperto e qualificato.
Dopo che all’infortunato è stato garantito il primo intervento, questi dovrà essere avviato al centro specializzato identificato per il proseguimento del counselling, del follow up e per la somministrazione successiva dei farmaci della PPE.
Raccolta
È doveroso sottolineare che il materiale costituito da taglienti monouso, quali bisturi e aghi, deve essere smaltito in appropriati contenitori che non consentano alcun tipo di esposizione ad agenti biologici (per esempio, quelli realizzati secondo la norma tecnica BS7320:1990). È raccomandabile che la raccolta di tali materiali inizi direttamente sul campo operatorio utilizzando piccoli contenitori adatti al recupero, al fine di ridurre il rischio da punture e/o tagli.
La rimozione di aghi dalle siringhe per anestesia e delle lame di bisturi costituiscono un concreto rischio (la letteratura evidenzia che la puntura accidentale con ago è il tipo di infortunio più frequente in ambito sanitario, seguito da punture con aghi da sutura). I manici di bisturi riutilizzabili con lama monouso montata, o gli aghi montati su siringhe riutilizzabili vengono lasciati, al termine dell’intervento, alla gestione delle assistenti. Le linee guida ISPESL del maggio 2010, ratificate nel 2011 dall’INAIL, prevedono che per questo tipo di rischio il lavoratore sia dotato di guanti speciali. Ecco cosa dicono le linee guida a riguardo: “… non esistono in commercio guanti efficaci in modo assoluto per la protezione contro tagli e abrasioni; sono disponibili, tuttavia, guanti realizzati con una formulazione di disinfezione, immessa nella matrice polimerica, in grado di abbattere considerevolmente il rischio di infezione (circa l’80%) in caso di lacerazione; questi si qualificano quindi come misura di sicurezza che garantisce una migliore tutela della salute e in relazione a un’appropriata esecuzione della valutazione del rischio, considerando i relativi disposti del D.Lgs 81/2008 e s.m.i; gli stessi dovrebbero essere resi disponibili per gli operatori che svolgono un’attività che comporta specifiche modalità espositive che richiedono un’ottimizzazione dei requisiti di protezione (per esempio, lavaggio manuale dello strumentario e materiali contaminati)”.
Le linee guida non specificano se togliere un ago o una lama di bisturi sia un’operazione di smontaggio preliminare alla detersione e quindi soggetta alla decontaminazione preventiva; indicano, in ogni caso, la necessità di dotare gli addetti di guanti speciali (di cui pochi dentisti, credo, conoscono l’esistenza). È chiaramente una situazione che merita chiarimenti da parte degli organi competenti che devono farsi carico della reale possibilità di applicazione di misure preventive razionalizzabili nella loro realizzazione pratica.
In attesa di chiarimenti si possono prendere in considerazione le seguenti alternative:
- gli aghi montati su siringa vengono passati alla fiamma o in appositi dispositivi per la “bruciatura” prima dello smontaggio;
- utilizzare solo bisturi monouso “completi” (manico e lama a gettare). Lo stesso si può fare per le siringhe per anestesia. In un’indagine condotta in Inghilterra nel 2001 si è evidenziata una drastica diminuzione delle punture accidentali con l’utilizzo di siringhe monouso (Zakrzews JM. Introducing safety syringes into a UK dental school – a controlled study. British Dental Journal 2001;190:88-92);
- un’ulteriore possibilità è quella che gli aghi vengano incappucciati, con tecnica a una mano, dal dentista. Le lame dei bisturi riutilizzabili vengono rimosse, con opportuni mezzi di sicurezza, dal dentista. L’odontoiatra è soggetto quanto l’assistente al rischio di ferita accidentale, si tratta solo di non incorrere in obiezioni, da parte delle istituzioni, in caso di puntura/ferita accidentale al lavoratore dipendente (D.Lgs 81/2008 e s.m.i). Rimane il problema della corretta applicazione di procedure difficili nella loro realizzazione pratica e quindi la necessità di un sereno confronto con le istituzioni.
Decontaminazione preventiva
La decontaminazione è uno degli adempimenti previsti dal Titolo VIII del D.Lgs 81/08 e successive modifiche e integrazioni in quanto è una misura di sicurezza di tipo collettivo e deve essere effettuata prima del lavaggio mediante immersione “in idoneo mezzo”, come di seguito esplicitato nella procedura. Tale misura di sicurezza contribuisce alla protezione degli operatori coinvolti nel processo di sterilizzazione e, in particolare, di quelli addetti al trasporto e al lavaggio del materiale utilizzato.
Nella decontaminazione manuale devono essere seguite le seguenti istruzioni:
- la scelta del principio attivo delle formulazioni o azione disinfettante deve tener conto dell’obiettivo primario, rappresentato dall’efficacia nei confronti degli agenti che si identificano come sorgente di rischio biologico e dalla compatibilità con i materiali da trattare;
- nella fase di allestimento della soluzione disinfettante l’operatore deve attenersi alle indicazioni del produttore (è consigliato allestire la soluzione al momento dell’utilizzo onde evitare una possibile contaminazione);
- nella soluzione disinfettante, allestita all’interno di idoneo recipiente, viene immerso il contenitore con i materiali da trattare;
- la durata della fase di immersione dipende dalle caratteristiche della soluzione impiegata ed è opportuno seguire le indicazioni fornite dal produttore;
- al termine del periodo di immersione il contenitore, con i materiali trattati, viene estratto e avviato alla successiva fase di lavaggio;
- la soluzione decontaminante deve essere smaltita secondo le indicazioni della vigente normativa.
In realtà i dispositivi medici riutilizzabili dovrebbero seguire un ciclo di riutilizzo che preveda in ordine: pulizia, disinfezione, sterilizzazione. A seguito dell’emanazione del DM 28 settembre 1990, il quale all’art. 2, comma 2, recita: “… i presidi riutilizzabili debbono, dopo l’uso, essere immediatamente immersi in un disinfettante chimico di riconosciuta efficacia nei confronti dell’HIV prima delle operazioni di smontaggio o pulizia da effettuare come preparazione alla sterilizzazione”. In molti studi dentistici si applica, come dovuto in ottemperanza al decreto e alle linee guida, la decontaminazione preventiva seguita dalla detersione e quindi dalla sterilizzazione. È un protocollo praticabile e “sancito”, ma rimane discutibile, come evidenziato dalla letteratura e da conoscenze scientifiche di lunga data, l’efficacia della decontaminazione in presenza di materiale organico.
Attualmente esistono mezzi per ottenere detersione e decontaminazione preventiva in modo automatizzato e sicuro per pazienti e operatori. L’esistenza di un decreto ministeriale, che indica espressamente la necessità di una disinfezione preliminare con liquidi chimici, non è un vincolo sul piano giuridico. I mezzi sono soggetti al progresso tecnico-scientifico: quando ne è dimostrata e documentata l’evidenza è lecito utilizzare i migliori. Le stesse linee guida dell’ISPESL hanno specificato che: “La decontaminazione può essere effettuata con modalità manuali oppure mediante apparecchiature termo-disinfettatrici di cui ci si assicuri dell’effettiva efficacia” (linee guida ISPESL, aggiornamento 2010). Nella decontaminazione automatica, il contenitore con il materiale da trattare viene collocato all’interno della lavastrumenti e viene avviato il programma di disinfezione secondo le istruzioni del produttore. Al termine del processo il contenitore, con i materiali trattati, viene inviato alla successiva fase di confezionamento. Attenzione agli strumenti che necessitano smontaggio per i quali è sempre richiesta, in base alle linea guida ISPESL, la decontaminazione preventiva. In generale non ci sono strumenti odontoiatrici che necessitano smontaggio prima della decontaminazione/detersione, quanto meno non ve ne sono che costituiscano un reale pericolo di abrasioni o ferite, fatta eccezione per le siringhe da anestesia, a cui è necessario smontare l’ago monouso, e per le lame dei bisturi montate su manico riutilizzabile di cui abbiamo già analizzato le problematiche connesse.
Detersione (lavaggio)
La detersione, cioè la pulizia mediante strofinamento con acqua e detergenti al fine di rimuovere il materiale organico e inorganico, è necessaria per assicurare il corretto esito della disinfezione e della sterilizzazione. La pulizia oltre a soddisfare l’esigenza “estetica” nella presentazione dello strumento, determina la rimozione di materiale contaminato e una riduzione della popolazione microbica. Rappresenta una fase preliminare insostituibile per la successiva disinfezione e sterilizzazione. Dopo la decontaminazione manuale i materiali utilizzati vanno sottoposti a una rigorosa procedura di lavaggio (che contempla un’attività di disinfezione), che ha lo scopo di rimuovere i residui di sostanze organiche e inorganiche e, di conseguenza, anche i microrganismi. Il risultato di una buona azione di detersione o lavaggio porta infatti a una riduzione qualitativa e quantitativa della contaminazione microbica (bioburden), che è la chiave del successo della sterilizzazione.
Per quanto attiene alla tutela della salute del personale, dalla valutazione del rischio deriva, di norma, l’esigenza di rendere disponibili per gli operatori DPI (Dispositivi Protezione Individuale) specifici per il rischio di esposizione ad agenti infettivi.
Questi lavoratori, di fatto, manipolano materiali spesso visibilmente contaminati con liquidi organici e conseguentemente sono tenuti a indossare obbligatoriamente i DPI all’uopo previsti.
Detersione (lavaggio) manuale
Attualmente viene considerato un metodo superato in quanto la tecnologia moderna ha messo a disposizione apparecchiature automatiche capaci di garantire il risultato con un basso rischio di infortuni per gli operatori addetti (linee guida ISPSEL).Oltre ad aumentare il rischio per gli operatori, il lavaggio manuale, produce nella fase di spazzolamento un’alta contaminazione ambientale (Figura 5).

Il lavaggio manuale si effettua quando non si dispone di apparecchiature automatiche e in alcune condizioni in cui, per le particolari caratteristiche del materiale, non è possibile eseguire il lavaggio automatico. L’orientamento attuale è, dunque, quello di privilegiare l’impiego di apparecchiature automatiche.
La procedura per la pulizia manuale prevede che il materiale venga immerso in una soluzione/formulazione detergente-disinfettante, che può essere a base di tensioattivi, enzimatica, plurienzimatica e con altri principi attivi.
Vanno rispettate rigorosamente le indicazioni del fabbricante relative a:
- concentrazione;
- temperatura;
- tempo di azione.
Il materiale trattato deve essere successivamente immerso, disassemblato, nella soluzione/formulazione affinché ogni suo componente ne venga a contatto.
È importante che la soluzione detergente venga sostituita di frequente e/o tutte le volte che si presenti visibilmente sporca; è altresì indispensabile che vengano utilizzati dagli operatori i guanti come DPI.
Dopo la fase di immersione gli strumenti vanno spazzolati, utilizzando spazzole dedicate, per rimuovere i residui organici che non sono stati eliminati dall’azione del detergente.
Vanno sottoposti a questo trattamento specialmente quegli strumenti che presentano incastri e zigrinature.
Dovrà essere definita una procedura di verifica dell’efficacia del trattamento per i dispositivi utilizzati per il lavaggio manuale.
Per tutti quei dispositivi che presentano cavità o lumi ristretti e di difficile accesso è indispensabile ricorrere all’utilizzo di dispositivi come:
- scovolini;
- spazzole con setole morbide;
- pistole ad acqua e/o aria compressa.
Tutti i dispositivi devono essere a loro volta sostituiti (monouso), oppure disinfettati e sterilizzati (poli-uso) in modo da evitare la successiva contaminazione dei materiali.
Detersione (lavaggio) a ultrasuoni
Il bagno a ultrasuoni è impiegato come trattamento di sostegno a quello manuale, specie quando le sostanze organiche sono solidificate sui materiali.
Il lavaggio si basa su un principio fisico chiamato cavitazione ultrasonica, che consiste nella formazione di cavità o bolle di gas create da onde ultrasoniche che implodono all’interno di un liquido con conseguente enorme rilascio di energia d’urto. Questa colpisce la superficie dell’oggetto da pulire interagendo sia fisicamente che chimicamente.

I risultati sono un fenomeno fisico di microspazzolatura e un effetto detergente prodotto dalle sostanze chimiche presenti nel bagno a ultrasuoni ad altissima frequenza. Questo tipo di pulizia è particolarmente indicato per tutti quei dispositivi medici delicati (microchirurgia) o che presentano articolazioni e zigrinature (strumenti dentali), dove facilmente si deposita materiale organico difficile da rimuovere con altri sistemi. L’impianto a ultrasuoni è dotato di un produttore di ultrasuoni e di una vasca che viene riempita da una soluzione detergente o proteolitica mantenuta a temperatura costante.
Nella soluzione viene posizionato un cestello forato con il materiale da sottoporre al trattamento. Un buon risultato si ottiene mediante il rigoroso rispetto delle seguenti indicazioni (Figura 6):
- la concentrazione della soluzione (deve corrispondere a quanto prescritto dal fabbricante);
- la temperatura dell’acqua (circa 40 °C, o comunque in funzione della soluzione utilizzata);
- la frequenza degli ultrasuoni (intorno ai 35 KHz);
- il tempo di contatto (minimo 5 minuti).
Gli strumenti vanno completamente immersi nella soluzione, aperti o smontati, posti in modo tale che non rimangano zone d’ombra. La soluzione detergente deve essere rinnovata a intervalli regolari, a seconda della frequenza e delle condizioni d’uso e, comunque, almeno giornalmente.
Detersione (lavaggio) automatica
La moderna tecnologia ha messo a disposizione sistemi che provvedono automaticamente alla detersione e alla disinfezione del materiale sanitario. È un metodo da preferire rispetto a quello manuale in quanto, oltre a garantire un’adeguata detersione e disinfezione programmata, riduce statisticamente la possibilità di infortuni degli operatori addetti.
Il lavaggio automatizzato può essere effettuato mediante l’utilizzo di macchine lavastrumenti, o meglio lavastrumenti termo-disinfettatrici, oppure pulitrici a ultrasuoni. In particolare, le “lavastrumenti” con processo di termodisinfezione sono indicate per il lavaggio e la disinfezione di una vasta gamma di materiali utilizzati, compresi quelli che presentano cavità grazie all’uso di particolari accessori. La metodica di lavaggio delle lavastrumenti assicura un’omogenea rimozione dello sporco grazie all’uso di una concentrazione di soluzione detergente costante, a condizione però che il caricamento venga effettuato senza zone d’ombra (non sovrapposto). All’azione meccanica di detersione è associato un processo di disinfezione termica (per esempio, 93 °C per 10 minuti) o chimica (Figura 7).

L’impiego di questi cicli di lavaggio e disinfezione assicura che i prodotti trattati abbiano un bioburden (carica batterica e sua natura) compatibile con il metodo di sterilizzazione. Le apparecchiature di lavaggio automatico utilizzano programmi standardizzati in funzione del materiale da trattare: ferri chirurgici, container, zoccoli, strumenti cavi ecc… Ogni programma di lavaggio si compone di diverse fasi:
- prelavaggio con acqua fredda;
- lavaggio con acqua calda (circa 50 °C) e detergente;
- neutralizzazione e risciacquo;
- disinfezione;
- asciugatura.
Se si vogliono ottenere buoni risultati di detersione, dovranno essere seguite le indicazioni di seguito riportate:
- buona qualità dell’acqua;
- buona qualità e adeguato dosaggio dei prodotti utilizzati;
- accurata manutenzione e controllo dell’azione meccanica;
- verifica della temperatura di lavaggio e disinfezione;
- caricamento corretto (è una condizione indispensabile);
- gli strumenti a snodo devono essere aperti per garantire la pulizia;
- i cestelli o i panieri non devono essere sovraccaricati;
- gli strumenti piccoli non devono essere coperti da quelli di grossa dimensione provocando zone d’ombra nel lavaggio;
- gli strumenti con cavità (tubi, sistemi respiratori) devono essere lavati al loro interno, per questo motivo devono essere trattati con accessori specifici.
Gli apparecchi di lavaggio e disinfezione devono essere sottoposti a verifica secondo le indicazioni della norma UNI EN ISO 15883.
Gli apparecchi di lavaggio e disinfezione possono, inoltre, essere dotati di sistemi di registrazione e stampa che consentono di verificare l’esito del ciclo, nonché stampare, per successiva archiviazione, la documentazione dell’intero procedimento al fine della tracciabilità.
Decontaminazione preventiva e detersione: conclusioni
In relazione alla dimensione e alla struttura organizzativa dello studio si sceglierà la modalità più consona: quando possibile si eviterà lo spazzolamento manuale dopo il passaggio di decontaminazione in vaschetta. Lo spazzolamento dovrebbe essere eseguito solo su eventuali tracce di sporco se visibili al controllo finale, quindi su strumenti già detersi e disinfettati. La spazzola a vapore, poco in uso nello studio dentistico, è uno strumento molto utile per efficacia e sicurezza. La vasca a ultrasuoni, usata all’interno di un corretto protocollo, è un mezzo di supporto importante per ridurre ferite accidentali e produrre un elevato standard igienico dello strumentario. Per studi dentistici di medie e grandi dimensioni i sistemi automatizzati come le lavastrumenti (meglio ancora i termodisinfettori) costituiscono la migliore alternativa. Per ciò che concerne i disinfettanti e i detergenti da utilizzare è importante considerare che i prodotti a base di acido peracetico (disinfettante di alto livello), così come i prodotti fenolici, sono ottimi nello loro caratteristiche tecniche, ma corrosivi sullo strumentario. Occorre quindi avere a disposizione ferri con acciaio di qualità e controllare attentamente il tempo di immersione. In ogni caso è necessario valutare attentamente le schede tecniche e le indicazioni del fabbricante, per la scelta e l’uso, della soluzione/formulazione detergente-disinfettante, che deve essere individuata tra prodotti che abbiano caratteristiche di comprovata disinfezione contro i virus epatitici e HIV per il passaggio di decontaminazione. Per il lavaggio nella vasca a ultrasuoni, è necessaria una base di tensioattivi, enzimatica o plurienzimatica. Il termodisinfettore produce in unico ciclo decontaminazione-detersione-risciacquo-asciugatura; deve essere utilizzato secondo le indicazioni del fabbricante. Per chi utilizza la vantaggiosa sistematica dei vassoi pre-assemblati, il lavaggio nel termodisinfettore consente di mantenere, per tutto il ciclo di riutilizzo, frese e strumenti, appartenenti allo stesso gruppo di trattamento, all’interno del loro contenitore. Inoltre, il risciacquo è eseguito con acqua addolcita direttamente in lavastrumenti e l’asciugatura avviene automaticamente a fine ciclo. Anche il trattamento in vasca a ultrasuoni molto capiente (almeno 6 litri) può consentire il mantenimento dei ferri all’interno del contenitore (vassoio pre-assemblato). È pero necessario procedere, di norma, al risciacquo e all’asciugatura manuali. Si segnala che attualmente esistono sul mercato macchine a ultrasuoni in grado di sciacquare e asciugare i ferri. In ogni caso i ferri trattati in ultrasuoni non hanno lo stesso livello di sicurezza, per gli operatori, di quelli trattati con termodisinfezione.
Risciacquo e asciugatura
Il termodisinfettore esegue automaticamente risciacquo e asciugatura. Si procederà manualmente dopo il trattamento in ultrasuoni o nel caso di detersione manuale. Il risciacquo ha lo scopo di allontanate i residui di detergente/disinfettante con il processo di sterilizzazione e di prevenire corrosioni. L’asciugatura evita la formazione di depositi che possono macchiare in modo permanente lo strumentario. In ogni caso, gli strumenti bagnati non possono essere imbustati, perché se si bagna la carta viene meno il mantenimento della sterilità. Per il risciacquo è preferibile utilizzare acqua distillata; è possibile usare acqua corrente “addolcita” possibilmente a livello di durezza inferiore a 6 gradi. Per l’asciugatura finale è utile della carta monouso “pulita”. In commercio ci sono apparecchi che, mediante getto d’aria calda, asciugano gli strumenti.
Controllo e manutenzione
Prima del confezionamento i materiali devono essere accuratamente controllati in tutte le loro parti; se si utilizzano sistemi di lavaggio automatizzati (ultrasuoni o lavastrumenti) è questo il momento per rimuovere eventuali tracce di sporco ancora presenti (ottima la spazzola a vapore). Per garantire il funzionamento e l’integrità dei ferri, la manutenzione quando necessaria va effettuata in questa fase, applicando prodotti lubrificanti-idrosolubili (latte o oli chirurgici idrosolubili e privi di silicone). Tutti i materiali che presentano parti deteriorate (rotture ecc.) o ruggine non devono essere avviati alla fase del confezionamento, ma opportunamente trattati con specifici prodotti, se necessario riparati o dismessi se non aggiustabili.
Confezionamento e identificazione del carico
Dopo l’asciugatura è bene che gli strumenti siano selezionati e assemblati per gruppi terapeutici. Se in precedenza gli strumenti sono stati gestiti all’interno dei loro contenitori, è sufficiente controllare la corretta collocazione. È consigliabile disporre di liste di controllo, possibilmente con relativa fotografia, per procedere rapidamente al controllo/assemblaggio.
Il tipo di confezionamento sarà in relazione alla necessità di conservazione sterile dello strumentario e alla durata della stesso. L’identificazione di ogni singola confezione, con numero di lotto, consente la rintracciabilità del processo (attualmente considerata necessaria dalla quasi totalità delle linee guida e richiesta da molti organi di controllo). Il confezionamento deve essere in grado di mantenere la sterilità del materiale fino alla scadenza stabilita, in conformità alle norme UNI EN ISO 11607-1 e UNI EN ISO 11607-2. Si tratta di materiali speciali; infatti, la carta da sterilizzazione è dotata di “pori” in grado di aprirsi e chiudersi in funzione della temperatura; in nessun caso può essere riutilizzata. Se un ciclo di sterilizzazione fallisce, il lotto deve essere ri-sterilizzato solo dopo aver rinnovato le confezioni. Le buste, in accoppiato carta medical grade-polietilene, sono termosaldabili e ne esistono di diverse misure per adattarsi a ogni esigenza clinica. Sul lato carta sono presenti gli indicatori di processo, mentre quello opposto è trasparente per il riconoscimento del contenuto. Lo strumentario chirurgico deve essere mantenuto sterile fino all’utilizzo.
La termosaldatura è determinante per la corretta conservazione: si lasceranno circa 3 cm di spazio dal contenuto e un “invito” di 5 cm (è la distanza che va lasciata dalla sigillatura al margine di taglio). L’ampiezza della termosaldatura deve essere compresa tra 6 e 12 mm.
Il rispetto di questi parametri ha lo scopo di:
- consentire una corretta circolazione del vapore all’interno della confezione;
- prevenire aperture accidentali;
- consentire il controllo dell’integrità della termosaldatura;
- facilitare l’apertura del pacco al momento dell’utilizzo.
Le macchine termosigillatrici più evolute rispondono ai requisiti delle nuove normative UNI EN 11607. Sono mezzi tecnologici che determinano un’alta qualità della sigillatura e proprio per questo rispondono agli specifici requisiti di convalida (Figura 8).

Oltre al sistema delle buste termosigillate e autosigillanti, è possibile utilizzare contenitori metallici dotati di filtri o valvole che consentono la conservazione sterile da 1 a 30 giorni. I cestelli con sportelli laterali, da aprire prima del ciclo e richiudere immediatamente al termine dello stesso, mantengono la sterilità solo per 24 ore. Per lo strumentario semicritico, che non penetra i tessuti pur venendo a contatto con le mucose, è consigliabile, ma non indispensabile, il confezionamento; andrà, comunque, conservato al riparo da fonti di contaminazione.
Indicatori di processo
Gli indicatori chimici di classe 1 (UNI EN ISO11140-1) sono “inchiostri” (reagenti chimici) che variano di colore con la temperatura: sulle buste in accoppiato carta medical grade-polietilene sono visibili stampati sul lato esterno della carta.
Sono in commercio anche sottoforma di nastro adesivo per la sigillature delle confezioni: il loro viraggio indica il semplice passaggio in autoclave, e non ha nessun significato in relazione all’esito della sterilizzazione. Lo scopo è di evitare che le confezioni non processate possano erroneamente essere identificate come autoclavate (Figura 9).
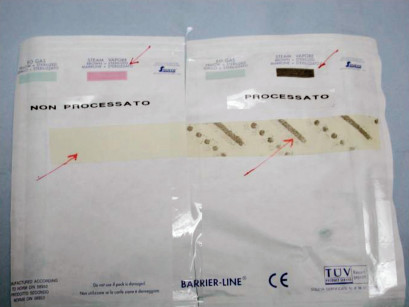
Identificazione delle confezioni
In un sistema qualità, per dimostrare e documentare è necessario identificare e rintracciare. Un’importante funzione di identificazione è svolta, come abbiamo visto, dagli indicatori di processo.
Se si vuole ottimizzare il sistema è necessario applicare su ogni confezione un numero di lotto che consentirà di rintracciare informazioni importanti quali:
- la data di sterilizzazione e di scadenza;
- l’operatore che ha eseguito e verificato il processo;
- l’indicatore di sterilità che ha consentito la convalida del ciclo;
- l’autoclave utilizzata.
Tutte le confezioni processate nello stesso carico saranno identificate con il medesimo numero di lotto.
Caricamento
Un corretto caricamento inizia da un’accurata distribuzione delle confezioni sui tray seguita da un’idonea sistemazione in camera di sterilizzazione. Un’adeguata collocazione dell’indicatore di sterilizzazione concluderà la fase. Le confezioni saranno sistemate una vicino all’altra con il lato carta rivolto verso l’alto e senza sovrapposizioni. I vassoi confezionati saranno caricati in autoclave inserendoli nei binari dell’apposito cestello. Non andranno sovrapposti o ammassati.
Rispettando queste regole si eviteranno sovraccarichi di peso, o ammassi, che impediscono la corretta diffusione/penetrazione del vapore. È consigliabile verificare la capacità di carico dell’autoclave utilizzata, mediamente 2,5-3,5 kg distribuiti su 3-4 tray. La verifica del peso è necessaria solo in fase di apprendimento; successivamente sarà facile effettuare il carico anche senza bilancia.
Indicatori di sterilizzazione
L’indicatore di sterilizzazione, comunemente detto “nastrino” o “striscia”, è un test molto diffuso per la verifica del processo di sterilizzazione. Non è una prova infallibile, ma un indice importante specie se non si provvede alla convalida annuale a norma EN554. Si tratta di rilevatori chimici che rispondono ai requisiti regolamentati dalla norma classe 5 per la UNI EN ISO 11140 oppure dalla classe D per la norma UNI 867-1 (Figura 10).
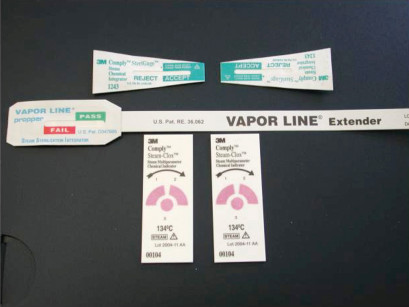
Il loro viraggio avviene solo al raggiungimento dei valori di sterilizzazione. Sono sensibili alle variabili tempo e temperatura e ne integrano una terza: la saturazione di vapore acqueo. Alcuni test indicano l’esito con il viraggio di colore, altri per “migrazione” all’interno di una scala di riferimento (lo stesso principio del termometro a mercurio). Questi ultimi danno indicazioni sul tempo di overkilling. È utile posizionare a ogni carico l’indicatore. Una volta sistemato il carico in autoclave è necessario preparare correttamente l’indicatore; annoteremo su di esso lo stesso numero di lotto posto su ogni confezione, realizzando così l’identificazione del carico. È importante che vi sia “somiglianza” tra il test e il tipo di confezioni presenti in autoclave, ossia: se nel carico vi sono confezioni in doppia busta, sigilleremo anche l’indicatore nel doppio involucro. Adegueremo, quindi, la selettività della prova al tipo di carico. Il test sarà collocato sul tray più basso e verso il fondo della camera di sterilizzazione, che è la zona più critica per la presenza del foro di scarico della condensa.
Saremo così in grado, con un unico indicatore di sterilizzazione, di controllare tutto il carico. Se si desidera una prova particolarmente significativa, si procederà, in fase di confezionamento, a introdurre un indicatore per ogni pacco. È questo il caso di vassoi o kit da implantologia/chirurgia o di materiale che deve essere inviato in riparazione.
Sterilizzazione dei ferri e convalida del processo
La sterilizzazione è il processo che conduce all’eliminazione di microrganismi e spore. La Farmacopea Europea e la norma comunitaria UNI EN 556 stabiliscono che il SAL (Sterility Assurance Level), ovvero il livello di assicurazione di sterilità, sia fissato in un limite definito: “<1 su 1 milione (SAL 10-6) la possibilità di trovare un microrganismo vivo all’interno del lotto sottoposto a sterilizzazione”. La stessa norma recita che si tratta di un processo speciale per il quale non è verificabile il prodotto finale (non è possibile eseguire un controllo microbiologico della sterilità di ogni strumento processato). Il raggiungimento della sterilità è dimostrabile solo attraverso l’efficacia e l’efficienza della macchina sterilizzatrice e la corretta esecuzione di tutte le fasi del processo. Per questa ragione già da molti anni è in vigore la norma UNI EN 285 per la fabbricazione delle grandi autoclavi e, recentemente, la EN 13060 per le piccole autoclavi di tipo odontoiatrico (Tabella 7).
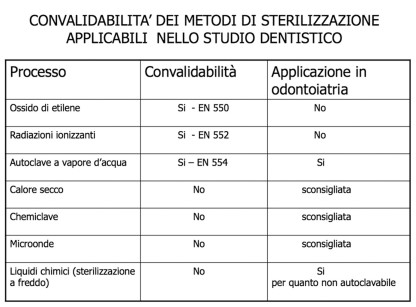
Per regolare il processo di sterilizzazione a vapore d’acqua è in vigore la norma UNI EN 554. Esistono poi norme che regolamentano altri mezzi e processi di sterilizzazione, ma nessuno di quelli convalidabili è applicabile, per ragioni pratiche e di costi, nello studio dentistico (Tabella 8). Il solo metodo applicabile e convalidabile, secondo l’attuale normativa di riferimento, è la sterilizzazione in autoclave a vapore d’acqua. Gli altri metodi di sterilizzazione hanno processi con esiti difficilmente controllabili: il raggiungimento del SAL non può essere dimostrato tramite documentazione del processo. Inoltre, con alcuni procedimenti non è possibile confezionare lo strumentario.

Le stufe a calore secco in commercio hanno oscillazioni di temperatura troppo elevate per essere considerate affidabili sui dispositivi medici (sono utili per le vetrerie, spatole e capsule dei laboratori di microbiologia e possono inoltre sterilizzare oli e polveri, materiali non trattabili con il vapore acqueo). I tempi di processo di queste stufe sono lunghi; inoltre, non consentono di trattare strumenti delicati e sono inefficaci, oltre che deleterie, su turbine e manipoli. Le stesse autoclavi “termodinamiche” (non dotate di pompa per il vuoto) presentano problemi di affidabilità nella sterilizzazione di strumenti imbustati e, soprattutto, di manipoli e turbine. In alcune nazioni europee l’autoclave termodinamica non può essere definita sterilizzatrice, ma semplicemente disinfettore a vapore. Da segnalare che la sterilizzazione con chemiclave oltre a mancare della possibilità di convalida (è un processo difficile da controllare in quanto in parte fisico e in parte chimico) ha il problema dell’emissione di vapori chimici. Con queste premesse è palese che la qualità del processo di sterilizzazione è strettamente dipendente dalla presenza in studio di almeno un’autoclave “performante”. È consigliabile averne a disposizione due in modo da consentire una più agevole gestione e, in caso di guasto, la continuità del servizio. Le autoclavi “muletto”, che sono locate in sostituzione, spesso non presentano i requisiti di efficacia ed efficienza necessari a rendere affidabile il processo.
- L’autoclave deve possedere i seguenti requisiti:
- conformità di destinazione d’uso (93/42 CEE – D.Lgs 46-1997);
- dichiarazione di conformità (89/336 CEE – 93/42 CEE – 73/23 CEE);
- convalida (UNI EN 554).
Conformità di destinazione d’uso
Non è un certificato specifico che deve possedere la macchina, ma un principio molto semplice sancito con il D.Lgs. 46/1997 che deve essere evidente nel libretto d’istruzioni d’uso: l’autoclave deve essere usata in conformità alla destinazione decisa dal costruttore. È, quindi, il costruttore che deve specificare sul libretto delle istruzioni (obbligatoriamente presente in studio) la tipologia di strumenti e di confezioni sterilizzabili con l’autoclave in oggetto. Gli utilizzatori devono diligentemente attenersi a quanto prescritto. Attualmente la totalità dei fabbricanti costruisce con riferimento alla Norma Europea EN 13060 che definisce quali requisiti deve possedere la macchina e quali test si devono superare per sterilizzare:
- strumenti solidi non imbustati;
- strumenti solidi imbustati;
- strumenti cavi/porosi imbustati e non.
La necessità di sterilizzare strumenti imbustati e/o porosi/cavi è una realtà quotidiana nello studio dentistico. Quindi, è bene assicurarsi che l’autoclave utilizzata sia idonea alla sterilizzazione dei tipi di carico processati. Non è una mera questione di norme, ma di verità tecniche e scientifiche alle quali è doveroso attenersi.
Dichiarazione di conformità
A tutti gli effetti è un certificato che attesta la conformità di determinati requisiti della macchina, in particolare di sicurezza. Il documento deve necessariamente essere presente in studio (spesso è inserito nel libretto d’istruzioni d’uso) poiché disciplinato da leggi cogenti. La norma EN 13060 esplicita i work test che devono essere eseguiti, in fabbrica, su ogni macchina. Il fabbricante dovrà redigere un certificato da cui risulti il tipo di prova effettuata e la catena metrologica degli strumenti di taratura utilizzati. La corretta taratura dei parametri fisici è, in assoluto, il controllo più importante e affidabile di tutto il sistema. I work test non sostituiscono la convalida a norma EN 554.
Convalida
La norma europea UNI EN 554 disciplina i requisiti di un corretto processo di sterilizzazione a vapore d’acqua. Non si tratta di una norma cogente ma di un importante riferimento che prevede una serie di controlli che devono essere eseguiti, annualmente, da un tecnico specializzato che verificherà diversi parametri d’esercizio, in particolare tempo, temperatura, pressione, vuoto e saturazione di vapore (Figura 11).

La norma prevede che in presenza di parametri fisici alterati, l’autoclave risulti inefficace anche quando altri test chimici-biologici siano positivi.
Al termine sarà certificato il documento di convalida che andrà archiviato in studio. La convalida a norma EN 554 non è una prassi normalmente seguita nello studio odontoiatrico.
Controlli di pertinenza dell’utente
La norma prevede dei controlli, eseguiti dall’utente, mirati a identificare il corretto funzionamento dell’autoclave. Si dovranno eseguire:
- vacuum test;
- test di Bowie e Dick ed Helix test;
- test biologico.
Questi test non sostituiscono la convalida annuale ma sono significativi del corretto funzionamento della macchina e quindi molto importanti e spesso richiesti dagli organi di controllo (vi sono differenze da regione a regione e da ASL ad ASL).
Prova del vuoto (vacuum test)
È una prova di “tenuta del vuoto”; evidenzia che non vi siano perdite nella camera di sterilizzazione e circuiti connessi, garantendo un requisito fondamentale per il buon funzionamento della macchina. È un autocontrollo di cui sono dotate solo le autoclavi più moderne e in presenza di una pompa per il vuoto. Si esegue ogni mattina a inizio attività e richiede solo pochi minuti.
In caso d’esito negativo, è necessario ripetere il test: al secondo fallimento, la macchina è da considerarsi inaffidabile. È consigliabile riportare l’esito positivo sul registro di sterilizzazione.
Test di Bowie e Dick ed Helix test
La norma EN 867 identifica in classe B il test di Bowie e Dick e l’Helix test; quest’ultimo è riconosciuto e classificato anche secondo la norma ISO 11140-1 in classe 6. La prova di Bowie e Dick e l’Helix test sono fondamentali per accertare l’efficienza dell’autoclave ed evidenziano la capacità di penetrazione del vapore (Figura 12). L’autoclave consente la sterilizzazione in tempi rapidi a temperatura di 121°-134° per la presenza di vapore saturo.
Il vapore deve saturare la camera di sterilizzazione e penetrare all’interno delle buste o degli altri tipi di confezione, tessuti e parti cave come quelle presenti nei manipoli contrangoli/turbine o, ancora più importante, nelle frese cave da implantologia.

Per il successo del processo, durante la fase di sterilizzazione la temperatura del vapore saturo e quella dello strumento si devono sovrapporre. Il test di Bowie e Dick è la prova indicata dalla norma EN 554 quale esame valido per la valutazione della penetrazione del vapore nei pacchi e nei tessuti. Attualmente tutti i costruttori producono autoclavi con cicli in classe B (dotate di vuoto frazionato sul ciclo in classe B), in riferimento alla norma EN 13060, in grado di superare il test di Helix. Quest’ultimo è ancora più selettivo di quello di Bowie e Dick nell’evidenziare la performance della macchina. Il test di Helix nasce per determinare la capacità del vapore di penetrare corpi cavi lunghi e stretti. Per chi possiede un’autoclave di classe B il test di riferimento è l’Helix. Purtroppo gli organi di controllo chiedono, senza che ci sia un razionale giustificabile, oltre che l’Helix anche il BeD (effettivamente su alcuni riferimenti normativi il BeD è citato per i corpi porosi /tessuti mentre l’Helix per i corpi cavi ma razionalmente non c’è motivo di eseguire i due test sulle piccole autoclavi odontoiatriche in classe B; il superamento dell’Helix include il superamento del test di BeD tarato per l’autoclave con camera inferiore a un modulo come quella in uso in odontoiatria). Nello studio odontoiatrico si sterilizzano manipoli e turbine (e non chili di tessuto come nelle grandi autoclavi ospedaliere); il test di Helix convalida la capacità della macchina nel far raggiungere il vapore saturo all’interno delle cavità di questi delicati strumenti. L’Helix è da eseguirsi ogni mattina a inizio attività. Come già detto il superamento del test di Helix rende superfluo eseguire il test di Bowie e Dik.
Le autoclavi di classe N (non dotate di pompa di vuoto) sono da considerarsi dei disinfettori a vapore non in grado di produrre sterilizzazione convalidabili secondo norme specifiche. È auspicabile che tutti gli odontoiatri si dotino di macchine performanti in grado di assicurare un’alta sicurezza al sistema. Il corretto esito della prova deve essere registrato e il riscontro archiviato.
Prova biologica
Si tratta di test normati dalla UNI EN 886-3 richiesti nelle linee guida per l’odontoiatria emanate nel 2009 dalla sanità della Regione Lombardia. Sono “fialette” contenenti una carica di spore (Bacillus stearothermophilus), che sono processate in autoclave e incubate per 24/48 ore (Figura 13).

Attualmente sono disponibili test biologici “rapidi”, pronti in poche ore. È una prova conosciuta e utilizzata frequentemente nello studio dentistico eseguibile su ogni tipo di autoclave. Non deve essere considerata erroneamente una test assoluto; la stessa commissione tecnica che ha emanato la relativa norma (EN 886-3) ha precisato: quando una variabile fisico-chimica è fuori limite il ciclo è da ritenersi insoddisfacente indipendentemente dal risultato biologico.
È un test molto pratico da eseguire e da leggere e va effettuato periodicamente (la Regione Lombardia lo richiede ogni 30 giorni); anche quando auto-gestito, è un supporto tecnico importante. La prova andrà registrata e il riscontro archiviato.
Il registro di convalida autoclave
È consigliabile implementare un registro di convalida autoclave (riportante tipo e matricola) dividendolo in 2 sezioni:
A – fabbricante, dove archiviare
- libretto d’istruzioni d’uso, dichiarazione di conformità-collaudo,
- certificato di convalida periodica alla norma EN 554 (se eseguita),
- scheda delle manutenzioni e riparazioni eseguite;
B – utente, per l’archiviazione delle
- registrazioni dell’esecuzione del test di Bowie e Dick/test di Helix allegando i riscontri degli esiti,
- registrazione dell’esecuzione del test biologico. Il riscontro degli esiti (fialette) saranno archiviati a parte in apposito contenitore.
-
Fig. 14 – Registrazione delle prove di efficacia ed efficienza.
È consigliabile tenere le registrazioni (Figura 14) per 5/10 anni, meglio 10, così come per le cartelle cliniche e i documenti fiscali, mentre per quanto riguarda i riscontri degli esiti (fialette e cartoncini inchiostrati) è ragionevole gettarli dopo 12 mesi (con il tempo virano di colore).
Esecuzione del ciclo di sterilizzazione in autoclave a vapore acqueo
L’autoclave sarà programmata in relazione al tipo di carico. Le macchine di recente fabbricazione hanno cicli pre-programmati e facilmente selezionabili.
In fase di apprendimento è utile consultare la tabella di sterilizzazione redatta dal fabbricante. A secondo della sensibilità alla temperatura del materiale da trattare e dal tipo di confezionamento applicato, si dovranno selezionare i cicli più adatti. Frequentemente vi sono carichi di materiale diversamente resistente al calore e con diversi tipi di confezionamento. È, quindi, preferibile il trattamento a 121° perché è meno aggressivo sullo strumentario “delicato” optando per il ciclo di maggiore durata tra quelli disponibili. Si deve rilevare che l’imposizione di cicli pre-programmati ha il vantaggio di evitare errori di impostazione; impedisce però l’allungamento del tempo di sterilizzazione e di asciugatura anche quando necessario per un carico pesante o difficoltoso. Sarebbe sufficiente modificare i microprocessori di selezione impedendo, comunque, una riduzione dei valori pre-impostati. Dopo l’avvio del ciclo è necessario che l’operatore verifichi i parametri fisici di esercizio (norma EN 554) rilevabili dal pannello di controllo della macchina. Un valido supporto tecnico è dato dalle stampanti integrate o collegate all’autoclave: registrando l’intero processo ne rendono possibile la verifica al termine del ciclo. È consigliabile conservare la stampata, oppure, con un collegamento al computer si realizza un importante archivio che darà evidenza della regolarità dei parametri di esercizio.
Controllo dell’esito del ciclo in autoclave
Al termine del ciclo l’operatore verificherà che:
- l’indicatore di sterilizzazione sia correttamente virato;
- la stampa di fine ciclo evidenzi la regolarità del processo (oppure avrà rilevato in precedenza, dal pannello di controllo, il giusto valore dei parametri fisici). In presenza di alterazioni riguardanti pressione, temperatura e tempo il ciclo deve essere invalidato anche se il viraggio dell’indicatore è regolare;
- le confezioni siano asciutte. È ammissibile un residuo di umidità all’interno delle buste, ma se il lato carta è bagnato lo strumentario non può essere considerato sterile. Più precisamente: le confezioni sono da ritenersi sterilizzate ma non garantiscono il mantenimento della sterilità. Il lasciar asciugare le confezioni in autoclave non risolve il problema: una volta aperta l’autoclave l’acqua è il veicolo per il passaggio di batteri all’interno delle confezioni; non per ultimo, si produce un deterioramento della carta. Infatti, sul lato carta esistono “pori” che consentono l’ingresso selettivo di aria e si aprono solo al raggiungimento di una predeterminata temperatura. Una volta bagnata, la confezione non garantisce la dovuta “selettività”.
Il processo andrà registrato sia in caso di esito positivo che negativo. In quest’ultima eventualità vanno previste istruzioni per l’operatore:
- evidenziare la non conformità del carico;
- riprocessarlo appena possibile rinnovando le confezioni e il lotto. Se il ciclo fallisce nuovamente considerare l’autoclave inefficace e segregare il lotto;
- chiamare l’assistenza tecnica;
- se non si possiede una seconda autoclave, riorganizzare l’agenda in funzione degli strumenti sterili ancora disponibili e, se necessario, sospendere l’attività.
È necessario implementare un registro del processo di sterilizzazione dove l’operatore annoterà:
- il numero di lotto del carico verificato;
- l’esito del processo;
- allegherà l’indicatore di sterilizzazione relativo al ciclo e, quindi, firmerà per convalida.
È utile archiviare anche gli scontrini di fine ciclo: attenzione a che siano su carta comune, perché quelli su carta chimica “sbiadiscono” in breve tempo. La registrazione informatizzata rimane il sistema migliore. È consigliabile tenere archiviate le registrazioni per 5-10 anni.
Conservazione dello strumentario
Dopo la sterilizzazione il materiale dovrà essere ridistribuito negli appositi comparti. La conservazione deve avvenire in pensili, cassetti o comunque mobili chiusi lontani da umidità e sbalzi termici e, soprattutto, da fonti di inquinamento chimico-biologico.
È necessario manipolare le confezioni sterili il meno possibile e con mani pulite e asciutte. La sanificazione/disinfezione dei magazzini deve essere programmata con cadenza mensile. È conveniente disporre appositi comparti per il solo materiale sterile evitando inutili manipolazioni. In queste condizioni è prevedibile un’ottimale conservazione della sterilità la cui durata indicativa (minima) è di 30 giorni per le buste singole e di 60 per le doppie buste. Le indicazioni variano da regione a regione e da ASL ad ASL; è bene informarsi e attenersi a quanto regolamentato nella propria area di esercizio. Sarebbe opportuno un confronto con le istituzioni per ottenere disposizioni certe e razionali univoche per tutto il territorio nazionale.

Con una buona organizzazione di frese e strumentario in kit e vassoi è possibile evitare l’utilizzo di ferri “sfusi” prelevati dai servomobili. In ogni caso è consigliabile imbustare tutto lo strumentario (Figura 15) assicurando il mantenimento della condizione igienica ideale e la possibilità di rintracciare il processo. Non per ultimo, la confezione è garanzia di qualità “percepita” dal paziente.
Approntamento dello strumentario alla seduta operativa
Lo strumentario sarà approntato su superfici correttamente disinfettate o, in caso di chirurgia, in un campo sterile. Al momento dell’apertura è utile annotare sul diario clinico del paziente il lotto di sterilizzazione; in questa modo sarà archiviato un dato importante che collega il paziente con la seduta e lo “stato igienico” dei ferri usati. Con un sistema informatizzato sarà possibile ottenere un documento che elenca i lotti di sterilizzazione degli strumenti utilizzati: oltre al valore medico- legale, consegnandolo al paziente al termine del suo ciclo di cure è possibile far percepire la qualità operata.
La sterilizzazione dello strumentario rotante
La necessità di sterilizzare manipoli e turbine è già stata precedentemente discussa. Si ricorda che oltre le evidenze sul rischio d’infezione veicolato da questi strumenti, esiste una precisa normativa che rende obbligatoria la sterilizzazione. La presenza di cavità, lunghe e di piccolo diametro, e di organi meccanici (con residui di detriti e lubrificanti) rende particolarmente difficoltosa la sterilizzazione dello strumentario rotante. La necessità di lubrificazione è sempre stata sostenuta, dai fabbricanti, per preservare l’efficienza e la longevità dei manipoli e delle turbine.
Il lavoro di Devid Lewis et al., già precedentemente citato, evidenziava che strumenti odontoiatrici soggetti a lubrificazione, analogamente agli endoscopi, potessero essere una fonte di rischio infettivo difficilmente controllabile. Il Clinical Research Associates (Newsletter vol. 3, n. 6, 2-4 giugno 1988 e vol. 5, n. 1, 1-2 dicembre 2000) ha prodotto uno studio sulla reale necessità di lubrificazione per questi strumenti: i ricercatori concludevano che solo alcune marche di manipoli traevano beneficio dalla lubrificazione, solo se eseguita a ogni ciclo di sterilizzazione, mentre altre tipologie di manipoli presentavano più problemi quando lubrificati. Sorprendente è il dato relativo alla lubrificazione “saltuaria”: peggiorava, per la quasi totalità delle marche, la longevità. In tutti i casi e per tutte le marche la lubrificazione manuale provocava, a ogni ciclo di lubrificazione/sterilizzazione, un incremento di lubrificante “gommoso” attorno agli organi meccanici e scolo di olio.
La stessa efficacia della sterilizzazione è messa in dubbio dalla presenza di questo materiale. L’utilizzo di manipoli e turbine con tecnologia “lube free” (senza lubrificazione) risolve i problemi di scolo e di accumulo: in realtà, questi manipoli dimostrano la stessa longevità di quelli tradizionali usati senza mai lubrificarli. Di fatto, l’uso di manipoli a tecnologia “lube free”, o semplicemente di manipoli tradizionali senza sottoporli a lubrificazione, è una strategia praticabile.
I migliori risultati si ottengono con un trattamento di detersione interna e lubrificazione in una macchina (avente specifici liquidi detergenti e lubrificanti) dedicata allo scopo. La detersione evita l’accumulo di detriti e di olio “appiccicoso”, la lubrificazione avviene con una piccola quantità (non controllabile manualmente) di olio inserita mentre gli organi meccanici sono in movimento; gli eccessi sono espulsi con un getto d’aria. Attualmente sono disponibili sul mercato molte valide alternative per la detersione e lubrificazione interna di manipoli e turbine. Un altro aspetto è il metodo di sterilizzazione; lo studio dei ricercatori del CRA evidenziava che i migliori risultati si ottengono con l’autoclave a vapore d’acqua: in media si effettuano 539 cicli d’uso/sterilizzazione prima che si verifichi la rottura (si considera rottura anche la sola perdita di potenza <5 watt). Le marche migliori arrivano a 750/900 cicli; il processo di sterilizzazione, in “autoclavi performanti”, non riduce in maniera significativa la longevità dei manipoli. Al contrario, ci sono prodotti di alcune marche che sottoposti a sterilizzazione vedono la loro durata ridotta del 50% (per i dati completi: www.cranews.com).
Ai fini dell’efficacia della sterilizzazione è importante considerare la necessità della detersione interna e la riduzione a piccole quantità della presenza di lubrificante; o meglio ancora la completa assenza. Per quanto riguarda la sterilizzazione l’unico processo affidabile e il vapore d’acqua.
I manipoli e le turbine devono essere trattati in autoclavi in grado di superare la prova di Helix. La presenza di cavità, lunghe e strette, rende necessario il vuoto per assicurare che il vapore possa penetrare e accedere in questi anfratti. Nelle autoclavi termodinamiche (non dotate di vuoto) possono residuare, specie negli strumenti cavi, delle sacche d’aria che inficiano la sterilizzazione.
Le sacche d’aria vanno incontro a surriscaldamento (per compressione) costituendo zone di calore secco non efficace per la sterilizzazione e deleterio per organi meccanici.
Oltre che nelle autoclavi dotate di vuoto, manipoli e turbine possono essere sterilizzati con specifiche autoclavi dedicate allo scopo: classe S norma EN 13060. Le “miniautoclavi”, per manipoli e turbine hanno il vantaggio di essere molto rapide. Alcune autoclavi prevedono un ciclo completo di detersione, interna ed esterna, seguito dalla sterilizzazione. Il limite di queste autoclavi dedicate è l’impossibilità di confezionamento: non si possono trattare i manipoli destinati alla chirurgia in campo sterile.
La pulizia e la disinfezione del riunito e della sala operativa
Il riunito odontoiatrico è un veicolo d’infezione attraverso le superfici, il circuito idrico e il circuito d’aspirazione. Non esistono normative specifiche sulla sanificazione del riunito e della sala operativa odontoiatrica: la letteratura e alcune linee guida suggeriscono comportamenti, indubbiamente validi, ispirati al principio di precauzione. In attesa di riferimenti ad hoc, si propone quanto attualmente è evidente nelle linee guida più aggiornate e, dove carenti, quanto in linea con il principio di precauzione desumibile dalla letteratura attuale.
Le superfici (tavolette, faretra, pulsanti, maniglie, lampada)
Dopo ogni paziente le superfici del riunito, in particolare tutte le parti “toccate” con i guanti contaminati o che fungono da superfici d’appoggio per materiali e strumenti, devono essere pulite con acqua e detersivo (non si può disinfettare senza prima aver rimosso il materiale organico e inorganico) e successivamente disinfettate a medio livello (l’alcool a 70°, per efficacia e rapidità d’azione, è il prodotto d’elezione). L’utilizzo di pellicole protettive è vivamente consigliato dalle linee guida di tutti gli enti governativi (Figura 16).

Con l’uso “esteso” di barriere è accettabile che la fase di pulizia e disinfezione sia ridotta a uno “strofinamento” con panno monouso, imbevuto di detergente/disinfettante a basso livello. Le superfici non protette saranno trattate con detergente e successivamente con prodotto disinfettante, l’alcool isopropilico a 70° si è rivelato molto efficace. Sono comunque utili molti dei prodotti in commercio (in genere a base di ammonio quaternario e alcool) che riuniscono in un unico prodotto le caratteristiche di detergente e disinfettante a livello intermedio (verificare le caratteristiche dalla scheda tecnica o, meglio ancora, dalla perizia fornita dal produttore). In ogni caso il prodotto deve essere usato in due tempi (se la superficie non è stata protetta da pellicola): dapprima come detergente, erogando (tramite spray) un “velo” di prodotto fino a bagnare uniformemente la superficie; dopo tre minuti si raccoglie con panno monouso, quindi, si ripassa un leggero velo e si lascia evaporare per un altro minuto (Figura 17).

La poltrona non costituisce una superficie clinica, e può essere semplicemente lavata come qualsiasi superficie domestica e non necessita di “copertura”. È buona norma igienica l’utilizzo di copritestiera monouso e, per chi desidera dare un messaggio di qualità, coprire l’intera poltrona a patto di sostituire l’ involucro a ogni paziente.
La sanificazione del circuito d’aspirazione e la prevenzione del backflow
Abbiamo già detto, trattando le modalità e i veicoli dell’infezione, del pericolo di un reflusso dalla cannula d’aspirazione. Il fenomeno è conosciuto con il termine di backflow. Il reflusso riguarda il “film” liquido che è presente sulle pareti interne dei tubi dell’aspirazione chirurgica. La causa è un’improvvisa ostruzione nella cannula monouso (aspirasaliva) inserita nella bocca del paziente. L’ostruzione può verificarsi per:
- risucchio dei tessuti molli (pavimento della bocca) nella cannula aspirasaliva;
- risucchio di materiale (cementi, pezzi di amalgama);
- risucchio del foglio della diga;
- improvvisa chiusura delle labbra attorno alla cannula.
Sono maggiormente soggetti al fenomeno i circuiti d’aspirazione poco potenti. La prevenzione del backflow si attua nel seguente modo:
- utilizzare aspirazioni potenti e mantenerle efficienti;
- non appoggiare l’aspirasaliva direttamente al pavimento della bocca ma interporre una garza (Figura 18).
-
Fig. 18 – Fenomeno del backflow: interponendo una garza si evita il risucchio dei tessuti molli nell’orifizio dell’aspira-saliva.
È necessario porre attenzione alla sanificazione delle tubature utilizzando prodotti specifici (le linee guida della Regione Lombardia prevedono l’aspirazione di un litro di prodotto dopo il trattamento di ogni paziente) (Figura 19).

Disinfezione del circuito idrico
Alla luce delle attuali evidenze scientifiche è opportuno disinfettare i circuiti idrici del riunito secondo quanto indicato dal costruttore e nei libretti d’uso e manutenzione. Alcuni riuniti possiedono sistemi di disinfezione automatizzati, altri sono dotati, o dotabili, di serbatoi e sistemi per la disinfezione manuale (Figura 20).
I riuniti più vecchi non sono dotati di sistemi per la disinfezione dei circuiti idrici; è bene pertanto provvedere ad adeguamento/sostituzione. Il trattamento eseguito a fine giornata, settimanalmente o saltuariamente sembra non concretizzare alcun beneficio ai fini della riduzione del rischio infettivo.
La sanificazione delle superfici housekeeping e degli arredi
Per le superfici della sala operativa non direttamente coinvolte nella catena infettiva (pavimenti, pareti e arredi) non è richiesta la disinfezione (linee guida CDC), ma come le superfici domestiche (housekeeping) possono essere semplicemente pulite e lavate. Il voler insistere con la disinfezione si rivela, in qualche caso, un errore: è sottovalutata la necessità di lavaggio con acqua e detergenti. Chiunque desideri monitorare lo standard igienico delle superfici può utilizzare delle apposite striscette reagenti in grado di rilevare i residui di sporco. Sono “prove” molto utilizzate nel settore alimentare: rilevano residui proteici al di sopra dei 40-BSA (limite sporco/pulito fissato dalla farmacopea europea).
Sarà facile rendersi conto che i migliori risultati si ottengono utilizzando detergenti di uso domestico. Non ci si può illudere che il disinfettante sia efficace sempre e comunque; al contrario, una superficie perfettamente pulita presenta una carica batterica ridotta. L’utilizzo di ipoclorito di sodio (candeggina) è spesso indicato per la pulizia e la disinfezione di queste superfici: l’efficacia di questa sostanza è fortemente influenzata dalla presenza di residui organici; la concentrazione utile, in funzione del residuo, varia da 5000 a 500 parti per milione (pari a una diluizione da 1:100 a 1:10).

Quindi, utilizzato a 1:10 è indubbiamente efficace, ma decolora alcuni materiali ed è irritante per le mucose respiratorie. In concentrazioni basse è ottimo, ma necessita di un passaggio preliminare con detergenti. È importante che la sala operativa sia libera da ingombri e materiale esposto in modo da evitare la contaminazione di presidi e sostanze che entrano nel ciclo terapeutico; inoltre, è facilitato l’accesso alle manovre di sanificazione (Figura 21). Le manovre di detersione devono essere condotte con la tecnica del doppio secchio: un contenitore con acqua e detersivo e un altro con sola acqua da usarsi per il risciacquo di panni o stracci utilizzati per la pulizia (Figura 22).

I prodotti per l’igiene domestica, ad alto potere sgrassante, sono da preferirsi a qualsiasi disinfettante. Certamente la disinfezione, eseguita dopo aver pulito, concretizza uno standard igienico d’eccellenza (particolarmente efficace risulta la disinfezione ambientale tramite aerosolizzazione di prodotti specifici). La frequenza di trattamento deve essere opportunamente stabilita in relazione a diverse variabili: distanza degli arredi dalla zona operativa, tipo di trattamento odontoiatrico effettuato, numero di interventi eseguiti nella giornata. A titolo indicativo si suggerisce:
- pulizia delle superfici esterne degli arredi dopo ogni paziente per le superfici facilmente contaminate dall’aerosol connesso all’uso di manipoli, turbine e ablatori, e a fine giornata per le rimanenti superfici;
- pulizia dei pavimenti dopo imbrattamenti o spandimenti accidentali e sempre a fine giornata;
- pulizia interna dei cassetti e contenitori di stoccaggio dello strumentario ogni settimana, se sono presenti strumenti non imbustati (che andranno a loro volta sterilizzati settimanalmente), altrimenti una volta al mese in presenza di strumenti confezionati;
- vetri e arredi non dedicati allo stoccaggio dello strumentario da una settimana a un mese;
- lampade a soffitto ogni mese;
- pareti delle sale operative possibilmente ogni 1-3 mesi, massimo ogni 6 mesi.
La disinfezione dei dispositivi medici su misura
I dispositivi medici su misura sono veicoli d’infezione dallo studio al laboratorio e viceversa. Fin dalla fase d’impronta è necessario lavare e disinfettare i manufatti protesici e ortodontici. Il lavaggio può essere eseguito alla bacinella del riunito aiutandosi con un pennellino monouso imbevuto d’acqua ossigenata per rimuovere l’eventuale presenza di sangue. Dopo il lavaggio si procede alla disinfezione di medio/alto livello. È da evitare la disinfezione per immersione per due ragioni:
- la prima è che alcuni materiali, in particolare gli alginati, sono imbibiti e deformati;
- la seconda è che immergendo nello stesso bagno più dispositivi diminuisce la probabilità del corretto esito della disinfezione.

È consigliabile inserire il dispositivo in una ciotola monouso (Figura 23) ed erogare il disinfettante scelto tramite spray, cospargendo, con un abbondante “velo liquido” (fino a veder “colare” il disinfettante) l’impronta o il manufatto. Si lascerà agire per il tempo necessario, in media 10 minuti. Dopo la disinfezione si procederà al risciacquo e all’inserimento in una busta impermeabile. Lo stesso procedimento può essere eseguito in macchine per il lavaggio e la disinfezione d’impronte e dispositivi medici.
I dispositivi su misura che provengono dal laboratorio devono essere disinfettati con le stesse modalità dei dispositivi in uscita; il laboratorio è tenuto ad assicurare la pulizia del manufatto. Per i “ritocchi” in studio, con manipolo dritto e frese da laboratorio, è consigliabile utilizzare dei “banchetti” dotati d’aspirazione e facilmente igienizzabili (Figura 24).
Approntando dei set di frese sterili (Figura 25) per ogni paziente è possibile evitare la disinfezione dopo il ritocco; diversamente, sarà necessario procedere a una disinfezione di circa 10 minuti.

La contaminazione ambientale e il controllo dell’aria nella sala operativa
L’aria è lo specchio dell’ambiente; ciò che si trova nell’aria finisce con il ricadere sulle superfici dell’ambiente e ciò che è presente nell’ambiente finisce con il ritrovarsi nell’aria. Il controllo dell’aria della sala odontoiatrica ha tre scopi: ridurre le infezioni aerogene; abbattere la contaminazione microbiologica ambientale di tutta la sala operativa; migliorare l’efficienza degli operatori. In tutti e tre i casi è necessario ridurre la contaminazione microbiologica e particellare. In campo odontoiatrico il problema delle infezioni trasmesse per via aerea è stato sottovalutato; il rischio riguarda gli operatori prima ancora dei pazienti. Durante la seduta operativa si produce un alto inquinamento dell’aria; dopo 3 ore di inattività la carica batterica aerea è ancora 3 volte superiore a quella riscontrabile nei locali extraclinici e anche la contaminazione particellare (particelle da 0,3 a 5 micron) si mantiene elevata. L’inquinamento particellare è particolarmente sgradito per due ragioni: innanzitutto, le particelle più piccole sono facilmente immesse negli alveoli polmonari; in secondo luogo, le particelle costituiscono il veicolo su cui i microrganismi si muovono nell’ambiente.
Le particelle inalate, a seconda della loro natura, possono produrre inefficienza fisica ancor prima che patologie delle vie aeree e sistemiche. La contaminazione dell’aria è condizionata dell’ambiente ed è influenzata da diversi fattori; per prevenirla è necessario:
- limitare l’accesso alla zona clinica al minor numero di persone possibili;
- porre dei tappetini antibatterici nelle zone d’accesso all’area clinica;
- se necessario (pazienti con vestiario visibilmente sporco), invitare i pazienti a indossare camici monouso e copri- calzari;
- gli operatori devono indossare camici da lavoro puliti di giornata, cuffie e bavagli monouso per ogni paziente (Figura 26);
- gli operatori devono indossare calzature da lavoro lavabili periodicamente;
- abolire, nelle sale operative e di sterilizzazione, tendaggi, tappeti, quadri e quanto non strettamente necessario;
- invitare i pazienti, prima della seduta, a un risciacquo con clorexidina;
- utilizzare sempre l’aspirazione chirurgica e la diga quando possibile;
- pulire e disinfettare attentamente al termine di ogni intervento, a fine giornata e periodicamente secondo quanto prestabilito;
- assicurare un adeguato ricambio d’aria.
Il modo più semplice per cambiare l’aria è aprire la finestra per diversi minuti al termine di ogni intervento. È un sistema empirico, in quanto non consente di controllare l’effettivo ricambio, ma nei locali con un corretto rapporto aereo-illuminante è presumibile che in pochi minuti si possa esercitare un ricambio adeguato. Il problema sorge quando l’aria esterna è ricca di polveri sottili. Non per ultimo, nei periodi freddi o caldi si creano sbalzi termici inopportuni: la temperatura e l’umidità relativa dovrebbero essere comprese tra valori di 20-24 °C la prima e 40-60% la seconda. Non si tratta solo di assicurare il comfort, ma la corretta conservazione-manipolazione dei materiali e il controllo della contaminazione ambientale.
Per gli studi di maggiori dimensioni o dove si esercita chirurgia impiantare/rigenerativa, se possibile, è opportuno implementare sistemi di climatizzazione che prevedano un’adeguata filtrazione e ricambio d’aria, sia in termini di flusso (almeno un paio di ricambi ora, ma meglio di più: per una sala operatoria ne sono previsti 15/ora), che di direzione (pressione positiva, a porte chiuse, dalla sala operativa verso i locali limitrofi). In fase di progettazione dello studio i costi aggiuntivi a quelli di un normale impianto di condizionamento sono discretamente elevati, ma accettabili. Non si tratta di implementare filtri assoluti come quelli richiesti per le sale operatorie, ma di ottimizzare un impianto di climatizzazione per ottenere un ambiente di lavoro salubre per gli operatori e adeguato per l’esercizio della chirurgia. In mancanza di riferimenti “ad hoc” è possibile orientarsi sulle linee guida ISPSEL facendo riferimento non certo alla rigide condizioni previste per le sale operatorie (classe ISO 5 norma EN ISO 14644-1), ma, a puro titolo indicativo e volontario, ai parametri delle sale risveglio/sterilizzazione (classe ISO 8 EN 14644-1).

Una convalida ambientale (Figura 27) ha costi commisurati alle possibilità di uno studio di medie-grandi dimensioni con sala chirurgica dedicata. Consente di verificare parametri importanti (ricambio e flusso d’aria, contaminazione microbiologica e particellare). L’impianto deve essere mantenuto efficiente eseguendo pulizia e sostituzione periodica dei filtri. In alternativa agli impianti centralizzati si possono installare degli apparecchi per la “sterilizzazione” dell’aria: sono macchine che, con un eufemismo, sono chiamate sterilizzatori d’aria; in genere si tratta di apparecchi che convogliano l’aria in una camera d’irradiamento UVB con efficacia antibatterica e alcuni sono dotati di filtri in grado di ridurre il particellare. È necessario che siano dimensionati al volume d’aria da trattare e che vengano, periodicamente, sostituite lampade e filtri. Senza dubbio migliorano la qualità dell’aria, il limite è che non provvedono al suo ricambio, rimanendo quindi la necessità di aprire le finestre. Infine, sono da segnalare gli apparecchi per la nebulizzazione/aerosolizzazione dei disinfettanti ambientali. Si tratta di macchine che distribuiscono il disinfettante nell’aria e da qui in tutto l’ambiente. Gli aerosolizzatori (Figura 28) sono da preferirsi ai nebulizzatori perché non lasciano depositi “bagnati “ sulle superfici.
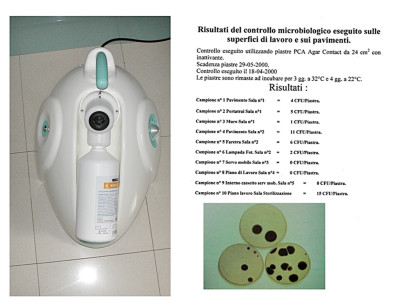
Il residuo “non umido” ricade in ogni angolo, anfratto e superficie della stanza. Nell’ambito di una convalida ambientale condotta nel nostro ambulatorio, aerosolizzando in una sala operativa di 9,45 m2 un prodotto a base di acqua ossigenata e ioni argento, la contaminazione microbiologica dell’aria e delle superfici (carica batterica totale a 37 °C) è stata azzerata (in fase “at rest” a 10 minuti dall’aerosolizzazione: 4 punti di campionamento e due prelievi per punto per l’aria + 4 punti e due prelievi per punto per le superfici; analisi eseguita mediante utilizzo di piastre e tamponi in accordo alle norme di buon campionamento UNI EN 45001). Ribadendo l’alto livello igienico prodotto con questo tipo di disinfezione, è bene ricordare che non si influisce sulla riduzione del particellare; anzi, immettendo “particelle” di disinfettante nell’aria la conta aumenta e rimane elevata per ameno un’ora. È bene, quindi, aerosolizzare il disinfettante a fine giornata, in modo che durante le ore notturne il principio attivo si possa depositare. È palese che questi interventi non influiscono sulla necessità di ricambio d’aria. Il “trattamento” dell’aria è semplicemente il veicolo per la diffusione ottimale del disinfettante.
Principi di gestione e controllo del processo di sterilizzazione
Nello studio odontoiatrico difficilmente si utilizzano procedure codificate controllate e condivise; ciò facilita gli errori in fase esecutiva e rende difficoltoso verificare e documentare il processo. La gestione e il controllo si realizzano con un sistema basato su 4 regole fondamentali: valutare, pianificare, documentare, verificare. In relazione alle dimensione dello studio la procedura/protocollo può concretizzarsi anche in una semplice istruzione operativa da appendere nel luogo di lavoro. L’importante è che sia controllata e condivisa: tutti gli operatori vengono formati e si attengono a quanto in questa descritto. Una modulistica semplice farà da supporto alle registrazioni che si riterranno opportune. Nel complesso, il sistema utilizzato dovrà consentire di identificare e documentare il processo. Per una corretta esecuzione, il personale deve essere adeguatamente formato e supportato da mezzi tecnologici e organizzativi. Attenersi a quanto scritto e condiviso, senza improvvisazioni, è il presupposto per una corretta esecuzione.
Il sistema viene controllato attraverso due modalità principali: la gestione della non conformità e la verifica (audit).
Non conformità
Con questa definizione si intende il mancato raggiungimento di requisiti specificati in rapporto a caratteristiche predefinite, per esempio: rilevare un ferro sporco dopo la sterilizzazione è una non conformità. Infatti, il sistema definisce che la pulizia dello strumento è un requisito indispensabile. Tutto quanto non risponde a requisiti predefiniti e specificati è una non conformità (una confezione non sigillata, la mancanza dell’etichetta indicante il numero di lotto, l’ubicazione errata di ferri, vassoi ecc.).
Ogni componente del team può e deve rilevare la non conformità accertandosi che venga annotata. Periodicamente verranno valutate le rilevazioni: se non conformità dello stesso tipo si presentano più volte (tre volte alla settimana si rileva un ferro sporco) si cercherà di porvi rimedio; se sono sporadiche (nel corso di un anno due segnalazioni per strumenti sporchi) si devono considerare fisiologiche. In caso di “non conformità” patologiche si deve analizzare perché:
- il protocollo/procedura utilizzata non è efficace?
- l’operatore non è correttamente addestrato?
- l’operatore non è sufficientemente supportato da mezzi e struttura organizzativa?
- l’operatore è sovraccarico di compiti?
- l’operatore non ha attitudine al tipo di funzione?
Si studierà, quindi, il modo migliore per risolvere il problema, indicando le azioni correttive, avvisando le persone coinvolte e stabilendo una scadenza per la rivalutazione.
Audit (attività di ascolto e verifica)
È necessario, almeno una volta l’anno, eseguire una verifica che parta dall’ascolto di chi opera “sul campo” per evidenziare eventuali carenze e programmare un corretto piano di miglioramento che andrà a integrarsi, in ottemperanza al decreto legislativo 81/08 (ex 626), con il documento di valutazione dei rischi. Si concorderà con il personale interessato, la data dell’audit. I presupposti per una corretta verifica sono:
- valutare la preparazione e la capacità di esecuzione del personale addetto;
- rilevare quanto di buono e positivo viene svolto e non solo le criticità;
- specificare dettagliatamente che cosa non funziona e non generalizzare;
- ricordare che la valutazione è un momento di crescita professionale per tutto il team.
Le non conformità e le carenze che emergeranno da questa valutazione verranno trattate con le stesse modalità esposte in precedenza.
Conclusioni
Il controllo dell’infezione crociata è una responsabilità dell’odontoiatra a cui è doveroso provvedere non solo per le conseguenze in ambito penale e civile, ma ancor prima per il rispetto dei pazienti e del codice deontologico. È, quindi, compito del dentista provvedere, con professionalità, alla formazione e all’aggiornamento necessari a:
- valutare il rischio biologico e compilare il DVR (D.Lgs. 81/08 e s.m.i), vedi scheda esemplificativa in calce all’articolo;
- assicurare la sterilizzazione dei ferri e la disinfezione delle sale operative;
- fornire adeguate procedure/protocolli per la corretta esecuzione del processo di decontaminazione/sterilizzazione;
- formare il personale addetto al processo e controllare quest’ultimo.
Le assistenti di studio sono collaboratrici preziose che necessitano del supporto scientifico, tecnologico e motivazionale per operare con efficacia ed efficienza. Il controllo dell’infezione crociata merita un approccio tecnico-scientifico-organizzativo, che può essere demandato solo dopo aver acquisito le dovute conoscenze, definito le procedure, i materiali, e i mezzi per la prevenzione del rischio e degli altri obiettivi fissati. È bene stabilire un percorso, con tappe/obiettivi, secondo le priorità evidenziate. Di seguito si suggerisce una lista di controllo utile allo scopo:
- organizzare la sala operativa evitando di lasciare materiale esposto, a eccezione del necessario per la seduta in programma;
- produrre una lista dei disinfettanti ”approvati” dallo studio con note sulla concentrazione/diluizione e destinazione d’uso;
- controllare i comportamenti, per esempio non toccare con i guanti nulla che non sia monouso, protetto da guaine o disinfettato/sterilizzato al termine della seduta. Se durante la seduta è necessario accedere a cassetti, contenitori eccetera, togliersi i guanti contaminati e rimetterne di puliti;
- implementare procedure organizzative (per i piccoli studi sono sufficienti degli ordini di servizio) per un’efficace pulizia e manutenzione degli ambienti e delle attrezzature;
- implementare procedure (ordine di servizio) organizzative per la pulizia, disinfezione e sterilizzazione di manipoli e turbine;
- sterilizzare tutto quanto entra in contatto con la cavità orale, registrare i cicli di sterilizzazione. Mantenere e controllare la sterilità confezionando in buste o carta medicale;
- dotarsi di autoclavi performanti ed effettuare i controlli, quindi registrare;
- implementare un sistema per la disinfezione dei circuiti idrici del riunito e valutare il rischio legionella all’interno del rischio biologico in ambito odontoiatrico (D.Lgs. 81/08);
- implementare sistemi, o semplicemente codificare comportamenti, per ridurre l’inquinamento dell’aria e la contaminazione ambientale.
Ogni operatore, durante lo svolgimento delle attività, può provocare un danno a se stesso, a un altro operatore o a un paziente: questo rischio deve essere controllato e ridotto. Risulta fondamentale tutelare i soggetti presenti in un ambiente di lavoro nei riguardi di una potenziale esposizione ad agenti biologici in grado di produrre un danno per la salute e occorre riflettere sull’attenzione che, di conseguenza, meritano i processi di sterilizzazione e, complessivamente, di controllo dell’infezione crociata.
Un articolo pubblicato nel 1997 (Cleveland JL, et al. Occupational Blood Exposures in Dentistry: a decade Review. Infect Control Hosp Epidemiology 1997;18(10): 717-721) evidenziava, con una review decennale, come la sola consapevolezza dei rischi portava ad adottare comportamenti preventivi che hanno ridotto drasticamente il numero di infortuni relativi a tagli e punture accidentali in ambito odontoiatrico. Per quanto datato, l’articolo ribadisce un principio sempre valido: “la consapevolezza del rischio biologico è frutto di un approccio scientifico senza del quale i rischi aumentano”.
Corrispondenza
Studio Balsano
l.balsano@studiobalsano.it
www.studiobalsano.it
ESEMPLIFICAZIONE COMPILAZIONE DVR per il RISCHIO BIOLOGICO, incluso legionella Premessa Tra le diverse variabili da considerare riveste un ruolo basilare la modalità di trasmissione dell’agente biologico che può avvenire per: Ai fini della valutazione del rischio si considerano solo quelle modalità di trasmissione che si possono verificare nell’ambito della lavorazione svolta. Per ciascun agente biologico la trasmissione può avvenire con una sola via di contagio o attraverso più modalità: il livello di esposizione risulta incrementato nel caso in cui sono numerose le vie di contagio che si possono verificare durante la procedura lavorativa valutata. È possibile individuare diverse tipologie di rischio biologico in ambito occupazionale: Gli agenti biologici possono provocare tre tipi di malattie: Obiettivi Revisione Definizioni ricorrenti Classificazione degli agenti biologici Nel caso in cui l’agente biologico oggetto di classificazione non può essere attribuito in modo inequivocabile a uno fra i gruppi sopraindicati, esso va classificato nel gruppo di rischio più elevato tra le due possibilità. Figure e Responsabili Datore di lavoro RSPP RLS Descrizione dell’attività lavorativa Valutazione dei rischi Secondo l’art. 271 del D.Lgs. 81/08 e s.m.i. il datore di lavoro tiene conto di tutte le informazioni disponibili relative alle caratteristiche dell’agente biologico e delle modalità lavorative, considerando in particolare: In relazione ai rischi individuati sono apportate le misure protettive e preventive adattandole alle particolarità delle situazioni lavorative. A seguito della valutazione dei rischi sarà redatto il DVR integrato dei seguenti dati: Misure di protezione e prevenzione Il datore di lavoro attua misure tecniche, organizzative e procedurali per evitare ogni esposizione dei lavoratori ad agenti biologici (art. 272 D.Lgs. 81/08 e s.m.i.). In particolare: evitare l’utilizzazione di agenti biologici nocivi, se il tipo di attività lavorativa lo consente; In base alla tipologia di attività lavorativa, sono da applicare misure specifiche per: Misure igieniche Tra le misure igieniche da adottare a seguito della valutazione dei rischi si evidenziano: Nelle aree di lavoro in cui c’è rischio di esposizione è vietato assumere cibi e bevande, fumare, conservare alimenti destinati al consumo umano, usare pipette a bocca e applicare cosmetici. Sorveglianza sanitaria Il D.Lgs. 81/08 e s.m.i. all’articolo 279 sancisce che i lavoratori addetti alle attività per le quali la valutazione dei rischi ha evidenziato un pericolo per la salute siano sottoposti a sorveglianza sanitaria. Il datore di lavoro adotta misure protettive particolari per quei lavoratori per i quali, anche per motivi sanitari individuali, si richiedono misure speciali di protezione, fra le quali: Il datore di lavoro fornisce ai lavoratori adeguate informazioni sul controllo sanitario cui sono sottoposti e sulla necessità di effettuare accertamenti sanitari anche dopo la cessazione dell’attività che comporta rischio di esposizione a particolari agenti biologici individuati nell’allegato XLVI, nonché su vantaggi e inconvenienti della vaccinazione e della non vaccinazione. Formazione e informazione Il datore di lavoro fornisce ai lavoratori, sulla base delle conoscenze disponibili, informazioni e istruzioni e una formazione adeguata per quanto riguarda: L’informazione e la formazione sono fornite prima che i lavoratori siano adibiti alle attività in questione, e ripetute, con frequenza almeno quinquennale, e comunque ogni qualvolta si verifichino nelle lavorazioni cambiamenti che influiscono sulla natura e sul grado dei rischi. Scheda di valutazione: AREA CLINICA Classificazione Agente Biologico Nome Virus batteri e funghi vari responsabili di trasmissione di patologia trasmissibile in ambito odontoiatrico, di cui HIV, HVC, HBV, herpes virus, candida albicans. virus influenzali, micobatteri, micoplasmi, Aspargillus, Streptococchi,Staphylococchi pseudomonas Tipo Batteri, virus, funghi Classificazione Classe 2 Modalità di trasmissione Percutanea: presenta un alto rischio di trasmissione (infezione trasmessa tramite strumenti pungenti taglienti: punture accidentali o trattamento inadeguato dello strumentario tra un paziente e l’altro) Contatto diretto: il rischio è anche in questo caso elevato; si verifica nell’esposizione di cute a mucose o lesioni infette (mancato uso/rottura guanti) specie se sono presenti microabrasioni sulle mani oppure schizzi di materiale infetto sulla congiuntiva o sulle mucose Inalazione di aerosol contenenti patogeni provenienti da spray/strumenti rotanti: in questo caso il rischio è moderato Contatto indiretto: presenta rischio basso (toccare superfici contaminate) o moderato (sfiorare superfici contaminate e poi le mucose: catena di contaminazione mano/ superficie/ mano/bocca Effetti sulla salute Infezioni con possibili conseguenze gravi per la salute, come nel caso di epatiti acute o croniche e AIDS Valutazione rischio e misure di prevenzione e protezione Livello di rischio Alto per le patologie trasmissibili per via percutanea e/o contatto diretto Misure tecniche, organizzative, procedurali Adottare procedure di vaccinazione Adottare procedure di lavoro per interrompere la catena di contagio (misure barriera e DPI) Misure igieniche Regolare lavaggio delle mani. Utilizzo conforme delle procedure di disinfezione e sterilizzazione e dei mezzi tecnologici (termodisinfettore e autoclavi) presenti nello studio Misure di emergenza Attuare quanto prescritto dalla Sanità Regione Lombardia nel protocollo punture o lesioni accidentali con veicoli potenzialmente infetti Misure di contenimento Non previste DPI da utilizzare Indumenti protettivi, guanti, mascherina, occhiali Responsabile attuazione: odontoiatri, igienisti, assistenti alla poltrona Revisione delle procedure: annuale VALUTAZIONE AGENTI BIOLOGICI: Scheda di valutazione: Acqua in circuito idrico riunito Descrizione attività/Lavorazione svolta Riunito circuito idrico Di seguito sono riportati gli agenti biologici oggetto della valutazione con relativa classificazione, modalità di trasmissione ed effetti sulla salute. Per ogni agente biologico sono riportati il livello di rischio, le misure tecniche, procedurali, organizzative, di emergenza e di contenimento adottate e i DPI da utilizzare. Classificazione agente biologico Nome Legionella pseudomonas Tipo Batterio gram negativo Modalità di trasmissione Acqua contaminata Effetti sulla salute Su individuo sano sono rari. Su persona con compromissione immunitaria e/o con patologie sistemiche croniche sono possibili: febbre, mialgia, infezioni respiratorie acute, complicanze neurologiche, cardiache, renali, epatiche e gastrointestinali, polmonite focale (forma subclinica, Pontiac 1, Pontiac 2, legionellosi) Valutazione rischio e misure di prevenzione e protezione Livello di rischio Basso Misure tecniche, organizzative, procedurali Disinfezione costante dell’acqua del riunito (trattamento con liquido disinfettante e tecnica indicata dal fabbricante) Individuazione, in anamnesi, dei pazienti a rischio (il trattamento odontoiatrico andrà eseguito con liquido d’irrigazione sterile) Misure igieniche Non ingerire acqua del riunito Misure di emergenza Non richieste Misure di contenimento Non richieste DPI da utilizzare Protezione, con mascherina, delle vie respiratorie e degli occhi con occhiali /visiere durante l’uso degli spray o l’irrigazione degli strumenti rotanti Responsabile attuazione: odontoiatri, igienisti, assistenti alla poltrona Revisione delle procedure: annuale Scheda di valutazione Reparto: tutti Descrizione attività/Lavorazione svolta Lavori in luoghi con climatizzatori Di seguito sono riportati gli agenti biologici oggetto della valutazione con relativa classificazione, modalità di trasmissione ed effetti sulla salute. Per ogni agente biologico sono riportati il livello di rischio, le misure tecniche, procedurali, organizzative, di emergenza e di contenimento adottate e i DPI da utilizzare. Classificazione agente biologico Nome Legionella pneumophila Tipo Batterio gram negativo Modalità di trasmissione Tramite spray, aerosol e acqua contaminata Effetti sulla salute A secondo della forma (subclinica, Pontiac 1, Pontiac 2, legionellosi): febbre, mialgia, infezioni respiratorie acute, complicanze neurologiche, cardiache, renali, epatiche e gastrointestinali, polmonite focale Valutazione rischio e misure di prevenzione e protezione Livello di rischio Basso Misure tecniche, organizzative, procedurali Adottare misure igieniche che prevedano la pulizia e la disinfezione, come minimo annuale, dei filtri dei condizionatori Misure igieniche e di emergenza Non richieste Misure di contenimento Non richieste DPI da utilizzare Non necessari Responsabile attuazione: datore di lavoro che lo commissione a ditta esterna Revisione delle procedure: annuale Scheda di valutazione Reparto: tutti Agente Biologico: vari responsabili di diverse patologie, trasmissibili in ambito odontoiatrico, a esclusione di quelle già sopra valutate Nome Vari Tipo Batteri e virus Classificazione Classe 2 Modalità di trasmissione Aria e aerosol Effetti sulla salute Infezioni con possibili conseguenze da lievi a moderate che si risolvono, nella maggioranza dei casi, con completa restitutio ad integrum Valutazione rischio e misure di prevenzione e protezione Valutazione Livello di rischio Basso per via aerea, Medio per gli aerosol Misure tecniche, organizzative, procedurali Adottare procedure di vaccinazione Adottare procedure di lavoro per interrompere la catena di contagio (misure barriera e dpi) Misure igieniche Regolare lavaggio delle mani. Utilizzo conforme delle procedure di disinfezione e sterilizzazione. Assicurare ricambio d’aria con mezzi tecnologici (pompa per il ricambio d’aria negli ambienti) o con apertura regolare delle finestre. Disinfettore per aerosol a fine giornata e/o filtrazione dell’area con macchina a filtri assoluti, dove disponibile Misure di emergenza Non previste Misure di contenimento Non previste DPI da utilizzare Indumenti protettivi, guanti, mascherina, occhiali Responsabile attuazione: odontoiatri, igienisti, assistenti alla poltrona Revisione delle procedure: annuale Conclusioni Il presente documento di valutazione dei rischi: Dispositivi di protezione dati in dotazione a ogni operatore Occhiali/visiera EN 166 Calzature antiscivolo EN 347 Guanti monouso EN 374-455 Mascherina medica monouso EN 14638 Dispositivi medici non sterili classe I Cappellino monouso Dispositivi medici non sterili classe I Abbigliamento monouso Dispositivi medici non sterili classe I La valutazione dei rischi è stata condotta dal Responsabile del Servizio di Prevenzione con il coinvolgimento preventivo del Rappresentante dei Lavoratori per la Sicurezza.
DVR
VALUTAZIONE ESPOSIZIONE AGENTI BIOLOGICI
(Titolo X, D.Lgs. 81/08 come modificato da D.Lgs. 106/09)
La durata e il livello dell’esposizione ad agenti biologici dipende soprattutto dalle caratteristiche del ciclo lavorativo e dell’ambiente di lavoro; sarà necessario conoscere e analizzare approfonditamente tutti i processi produttivi e altre operazioni che prevedono probabile contatto con agenti biologici. Nello specifico si valuterà:
Scopo del presente documento è valutare i livelli di rischio da esposizione ad agenti biologici ai sensi dell’art. 271 del D.Lgs. 81/08 e s.m.i. All’esito della valutazione saranno adottate e attivate specifiche misure di prevenzione e protezione, nonché apposite misure tecniche, organizzative e procedurali per evitare ogni esposizione dei lavoratori ad agenti biologici. Infine, per gli operatori esposti si dovrà garantire adeguata formazione e sorveglianza sanitaria.
La valutazione sarà programmata ed effettuata con cadenza triennale da personale adeguatamente qualificato. La presente valutazione sarà, comunque, aggiornata nel caso in cui gli elementi oggetto di valutazione subiscano variazioni e/o nel caso in cui emergano ulteriori elementi significativi ai fini della sicurezza e della salute dei lavoratori e anche in relazione ai risultati della sorveglianza sanitaria.
In base all’art. 267 del D.Lgs. 81/08 e s.m.i. si riportano le seguenti definizioni:
Gli agenti biologici sono ripartiti nei seguenti quattro gruppi a seconda del rischio di infezione (art.268 D.Lgs. 81/08 e s.m.i.):
Studio dentistico
Nel luogo di lavoro sono apposti in posizione ben visibile cartelli su cui sono riportate le procedure da seguire in caso di infortunio o incidente.
Reparto: sterilizzazione e assistenza
LEGIONELLA PNEUMOPHILA
Reparto: sale operatorie odontoiatriche (riunito circuiti idrico)





