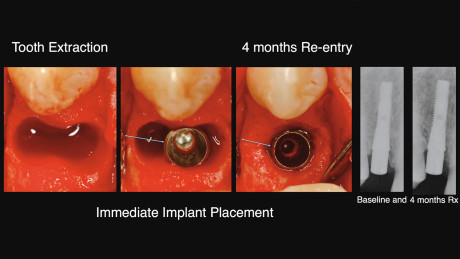
Negli ultimi anni l’inserimento immediato di un impianto dopo l’estrazione di un dente (protocollo di inserimento implantare di Tipo 1; Hammerle et al., 2004) è diventato un trattamento clinico terapeutico comune. Questo approccio chirurgico è stato introdotto nel 1976 (Schulte and Heimke, 1976) come alternativa al classico protocollo chirurgico ritardato proposto da Brånemark (Brånemark, 1983). I sostenitori di questo protocollo affermavano che riducendo l’esposizione chirurgica del paziente si aveva un limitato riassorbimento osseo fisiologico dopo l’estrazione del dente (Paolantonio et al., 2001). Studi istologici sulla guarigione di impianti inseriti in alveoli post-estrattivi hanno documentato che si verificano modelli simili di osteointegrazione nell’uomo (Wilson et al., 1998) e negli animali (Anneroth et al., 1985, Barzilay et al., 1996, Karabuda et al., 1999).
Diversi studi sperimentali su animali hanno valutato la dinamica di guarigione nell’ambito dell’alveolo post-estrattivo e i cambiamenti dimensionali che avvengono a carico delle pareti ossee dell’alveolo (Cardaropoli et al., 2003, Araujo and Lindhe, 2005), nonché l’influenza dell’inserimento di impianto in questo processo di guarigione (Araujo et al., 2006a, Araujo et al., 2006b). Sono stati evidenziati marcati cambiamenti morfologici della cresta alveolare, indipendentemente dall’inserimento dell’impianto, sebbene sia stata osservata un’elevata variabilità nei risultati. Questa eterogeneità può essere spiegata dall’uso di diversi modelli pre-clinici, diversi periodi di guarigione, dimensioni e geometrie implantari differenti, nonché di diversi protocolli chirurgici. I dati dalla ricerca clinica hanno riportato le percentuali di sopravvivenza e i valori radiografici della perdita ossea media, mentre solo pochi studi hanno evidenziato i parametri della salute perimplantare. Inoltre, studi recenti hanno analizzato il risultato clinico di questo protocollo chirurgico, valutando i risultati estetici e la guarigione ossea che si verifica nella procedura di riapertura, ottenendo risultati eterogenei (Ferrus et al., 2009, Sanz et al., 2009, Chen et al., 2009). Alla luce di questa variabilità, il clinico deve considerare che vi sono molti fattori che influiscono sul modellamento e ri-modellamento dell’alveolo post-estrattivo dopo l’inserimento immediato dell’impianto e che il tipo di guarigione ottenuta influirà il risultato finale, come la protesi su impianti, in termini di risultati clinici ed estetici a breve e lungo termine previsti. Quindi, l’obiettivo di questo lavoro è quello di evidenziare i fattori critici che guidano il processo di guarigione dell’alveolo dopo l’estrazione del dente e l’inserimento immediato dell’impianto che devono essere compresi quando si utilizza tale protocollo.
Processo di guarigione della ferita
Neoformazione ossea
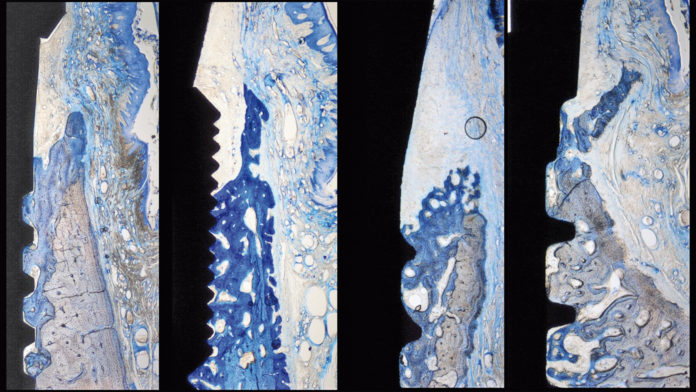
Le fasi precoci di integrazione del tessuto di impianti inseriti in alveoli post-estrattivi sono state valutate tramite l’analisi istomorfometrica del contatto osso-impianto (BIC) e delle aree ossee a 4 ore, 1, 2, 4 e 8 settimane (Vignoletti et al., 2009a). Dopo 4 ore di guarigione, gli Autori hanno osservato che l’interno dell’area filettata era occupato da tessuto non mineralizzato, composto principalmente da eritrociti e, in proporzione minore, da osso vecchio e trucioli ossei residui dovuti alla fresatura. Sono stati osservati occasionalmente residui di legamento parodontale attaccato al gruppo osseo. Dopo una settimana, la camera della ferita era riempita principalmente da tessuto di granulazione, ricco di cellule tipo fibroblasti nell’ambito di una matrice extracellulare tipo fibrina. In questo intervallo di tempo il processo di modellamento osseo era assente, con tracce minime di neoformazione ossea, mentre si osservavano aree di rimodellamento nell’osso genitore. Dopo 2 settimane il rimodellamento osseo era evidente, con formazione di tessuto osseo chiaramente identificabile. Si osservava formazione di nuovo osso nel contatto intimo con la superficie, nonché in posizione adiacente al vecchio osso genitore. Dopo 4 e 8 settimane si osservavano entrambi gli eventi di modellamento e ri-modellamento. La formazione di nuovo osso presentava una combinazione di osso fibroso, osso a fibre parallele, nonché osso lamellare maturo.
Morfogenesi della mucosa perimplantare
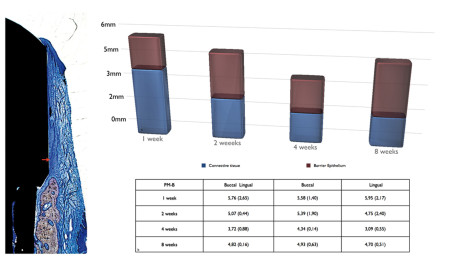
Le fasi precoci di formazione e maturazione dell’ampiezza biologica di impianti inseriti in alveoli post-estrattivi sono state valutate tramite l’analisi istologica e istometrica dopo 1, 2, 4 e 8 settimane (Vignoletti et al., 2009c). Dopo una settimana l’epitelio orale era continuo con quello di giunzione che era occasionalmente in contatto con la porzione più coronale della superficie dell’impianto. Il tessuto connettivo era infiltrato da cellule infiammatorie. Dopo 2 settimane l’infiammazione era ancora presente. L’epitelio, nella sua porzione coronale, era composto da strati multipli di cellule, mentre nella parte più apicale era in stretto contatto con la superficie di titanio con solo pochi strati cellulari. Il tessuto connettivo comprendeva molte cellule allungate tipo fibroblasti che erano allineate parallelamente alla superficie dell’impianto. Lateralmente a quest’area si osservavano molti vasi di piccole dimensioni e fibre di tessuto connettivo. A 4 e 8 settimane l’infiammazione era assente. L’epitelio barriera appariva maturo ed era in stretto contatto con la superficie in titanio dell’impianto o dell’abutment di guarigione. In alcuni siti, l’epitelio si estendeva alle filettature dell’impianto, vicino all’osso di nuova formazione. Il tessuto connettivo sopra-crestale, che era vicino alla superficie dell’impianto, era denso e ricco di fibroblasti. Nella porzione laterale, le fibre di collagene correvano soprattutto in una direzione parallela alla superficie dell’impianto, in una matrice di tessuto connettivo riccamente vascolarizzata. A 8 settimane l’analisi istometrica rilevava una dimensione media globale del tessuto molle di 4,82 (0,16) mm. Questa barriera di tessuto molle era composta da una porzione di tessuto connettivo che misurava 1,74 (0,23) mm e da una porzione epiteliale che misurava 3,07 (0,39) mm. Nell’aspetto buccale dell’impianto, l’epitelio giunzionale misurava 2,35 (0,84) mm a 1 settimana, mentre a 2 settimane si estendeva a 3,06 (0,97) mm. A 4 settimane si osservava un ritorno ai valori di baseline, mentre alla fine dello studio la posizione media dell’epitelio giunzionale era 3,34 (0,75) mm apicale al margine della mucosa.
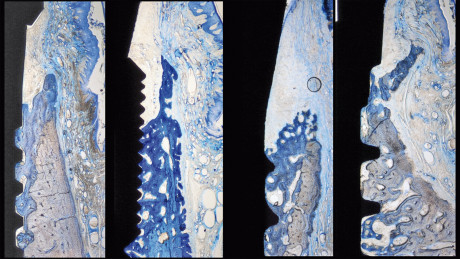
Riassorbimento della cresta buccale
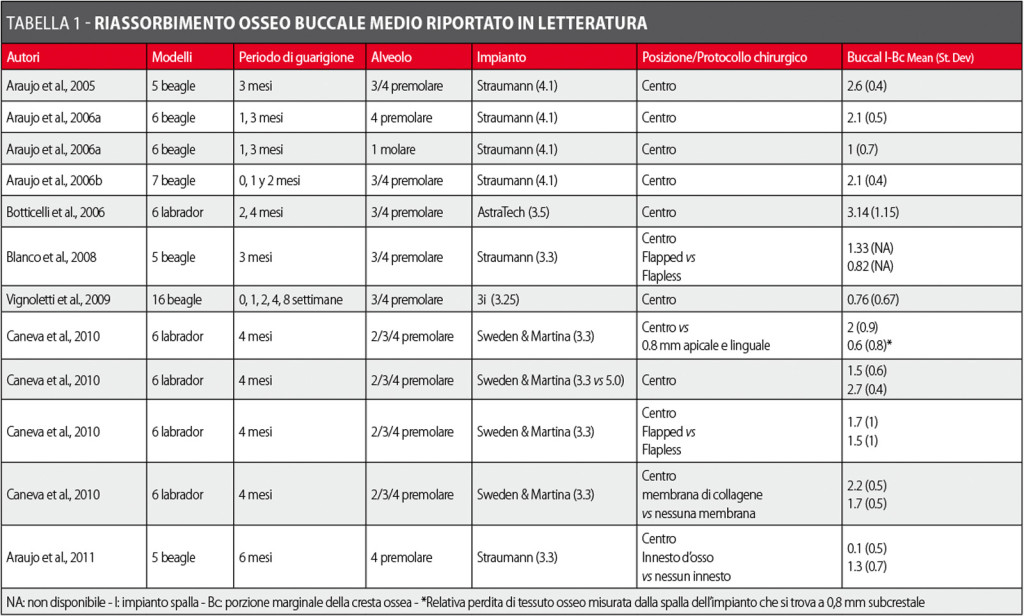
L’impatto dell’inserimento immediato di impianto sulle alterazioni del tessuto duro ha prodotto risultati eterogenei in letteratura, con un riassorbimento dell’osso buccale medio che varia da 3,14 (Botticelli et al., 2006) a 0,1 mm (Araujo and Lindhe, 2011) (tabella 1). Diversi fattori legati a impianto, alveolo e protocollo chirurgico sono stati considerati come rilevanti nell’ambito del processo di rimodellamento osseo dell’alveolo.
 Influenza dell’impianto (superficie, geometria, dimensioni e posizione)
Influenza dell’impianto (superficie, geometria, dimensioni e posizione)
La guarigione di impianti con superficie modificata tramite il discreto deposito cristallino (DCD) di nanoparticelle di fosfato di calcio (CAP) è stata confrontata con impianti con superficie con mordenzatura acida standard, dopo l’inserimento immediato in alveoli post-estrattivi. La valutazione dell’influenza della microtopografia di superficie sui cambiamenti dimensionali della cresta non ha indicato differenze significative tra i gruppi test e controllo. Alla fine dello studio vi era però una tendenza verso un minor riassorbimento del piano buccale per gli impianti con la superficie test (Vignoletti et al., 2009b). Un altro studio ha confrontato la guarigione a 6 settimane di quattro diversi sistemi implantari, posizionati secondo il protocollo chirurgico di inserimento immediato. Dei quattro sistemi implantari testati, Astra Tech, 3i e Thommen erano impianti cilindrici con design a 2 componenti, anche se quest’ultimo presentava un colletto macchinato di 1 mm. L’impianto Straumann era di forma cilindrica, con design monocomponente e colletto macchinato di 1,8 mm. La cresta alveolare intorno ai quattro tipi di impianti mostrava un marcato riassorbimento, con una perdita ossea media di 2,5 mm osservata nell’aspetto buccale della cresta, indicando che le diverse superfici e geometrie implantari non avevano influenzato il processo di rimodellamento osseo che si verifica nell’alveolo dopo l’estrazione del dente (de Sanctis et al., 2009). Caneva et al. (2010 a) hanno valutato nel cane labrador l’influenza della posizione dell’impianto in alveoli estrattivi. Nei siti controllo, gli impianti cilindrici di 3,3 mm sono stati posizionati nel centro degli alveoli mentre, nei siti di prova, sono stati collocati 0,8 mm più in profondità e più lingualmente. I risultati di questo studio hanno dimostrato che dopo 4 mesi di guarigione negli aspetti buccali dei siti controllo e in quelli test la posizione limite implantare ruvido/liscio era rispettivamente di 2 (SD 0,9 mm) e 0,6 (SD 0,9 mm). Il riassorbimento crestale buccale era meno pronunciato nei siti di test, anche se non in modo statisticamente significativo. Inoltre, un esperimento degli stessi laboratori ha valutato l’influenza della dimensione dell’impianto sulle modalità di riassorbimento della cresta alveolare. Impianti cilindrici di 3,3 mm con colletto lucido di 0,8 mm sono stati confrontati con impianti conici di diametro di 5,0 mm. Gli Autori hanno concluso che l’inserimento immediato di impianti conici a diametro largo in alveoli estrattivi non ha impedito il riassorbimento della cresta alveolare, bensì ha contribuito a un riassorbimento dell’osso alveolare più pronunciato rispetto a quello con impianti cilindrici di diametro standard di 3,3 mm (Caneva et al., 2010 b).
Influenza dell’anatomia dell’alveolo
La possibile influenza della larghezza dell’alveolo e dello spessore del piano dell’osso buccale è stata investigata da Araujo et al. sul cane beagle (2006b). Gli autori hanno osservato una minor riduzione dell’altezza dell’osso con l’inserimento di impianti di diametro di 4,1 mm in alveoli di molari rispetto all’inserimento degli stessi impianti in alveoli di premolari. Essi hanno quindi concluso che maggiore sono le dimensioni combinate di parete ossea-difetto e minore è la riduzione del contatto osso-impianto e dell’osso corticale buccale. Questi risultati sono stati recentemente confermati da una ricerca pre-clinica similare nel canino (Vignoletti et al., 2009b). Gli Autori hanno valutato se la dimensione dell’alveolo può influenzare i cambiamenti morfologici della cresta alveolare quando si inseriscono impianti cilindrici con diametro di 3,25 mm in alveoli distali del terzo e del quarto premolare del cane beagle. Un minimo cambiamento verticale di 0,3 mm è stato osservato tra i valori di baseline e quelli a 8 settimane a carico del piano buccale del sito del quarto premolare, mentre il cambiamento corrispondente a carico del sito del terzo premolare era in media di 1,1 mm. Anche le misurazioni istometriche hanno dimostrato due diversi tipi di guarigione in ciascun sito alveolare. Nell’alveolo distale di 3P3 non è stato osservato alcun difetto verticale nell’interfaccia osso marginale/impianto a causa del pronunciato riassorbimento del piano buccale, mentre nel sito del quarto premolare la componente intraossea del difetto ammontava a circa 1-1,5 mm.
Influenza del protocollo chirurgico
Una variabile che confonde e che può interferire con i cambiamenti dimensionali della cresta alveolare e che deve essere presa in considerazione è l’impatto dello scollamento lembo e dell’esposizione dell’osso crestale sottostante. La letteratura che ha valutato i cambiamenti morfologici degli alveoli post-estrattivi ha rilevato dati contrastanti. In un recente esperimento nel cane, Fickl et al. (2008) hanno dimostrato che lo scollamento di lembi mucosi e l’esposizione di osso crestale causavano un maggior riassorbimento (circa il 14% in più) di tessuto molle e duro rispetto alla rimozione del dente senza scollamento del lembo. I risultati di un esperimento similare da parte di Araujo e Lindhe (2009) non sono riusciti a dimostrare alcuna alterazione della dimensione della cresta significativamente maggiore dopo l’estrazione del dente con o senza scollamento del lembo. Questa inconsistenza di dati è stata notata anche nei protocolli con impianti immediati. Uno studio nel cane beagle che comparava la chirurgia con lembo e senza lembo con inserimento di impianti con diametro di 3,3 mm in alveoli post-estrattivi di 3P3 e di 4P4 ha riportato a 3 mesi di guarigione valori rispettivamente di 1,33 mm e 0,8 mm di riassorbimento del piano vestibolare (Blanco et al.,2008) mentre Caneva et al., (2010b) non hanno mostrato alcuna differenza tra i due protocolli. Più recentemente sono state proposte tecniche di incremento onde evitare i cambiamenti morfologici della cresta alveolare che si verificano dopo l’inserimento immediato dell’impianto. Caneva et al. (2010d) hanno valutato l’influenza di membrane riassorbibili sulle alterazioni del tessuto duro e sull’osteointegrazione di impianti inseriti in alveoli estrattivi in un modello di cane. Nella regione premolare mandibolare sono stati inseriti immediatamente impianti in alveoli estrattivi di sei cani labrador. Nei siti test sono state applicate membrane di collagene riassorbibili, mentre i siti controllo sono stati lasciati scoperti. Il riassorbimento osseo si è verificato sia nei siti test sia in quelli controllo. Mentre la maggior parte del contatto osso-impianto coronale risultava simile tra i vari siti, la cresta alveolare si era mantenuta a un grado più elevato nell’aspetto buccale dei siti test (perdita di 1,7 mm), rispetto ai siti controllo (perdita di 2,2 mm). Araujo et al. (2011) hanno voluto determinare se il processo di rimodellamento osseo dopo estrazione del dente e inserimento immediato di impianto era influenzato dall’inserimento di un innesto xenogenico nel vuoto formatosi tra la superficie dell’impianto e le pareti ossee dell’alveolo post-estrattivo. Il vuoto marginale buccale-prossimale che si verificava costantemente tra l’impianto e le pareti dell’alveolo è stato innestato con Bio-Oss Collagen, mentre nei siti contro-laterali non è stato eseguito alcun innesto. I risultati dopo 6 mesi di guarigione hanno dimostrato che mentre la cresta ossea buccale nei siti innestati era posizionata presso o vicino al bordo SLA, la corrispondente cresta nei siti controllo era meno spessa e posizionata a una distanza variabile sotto al bordo SLA.
Inserimento immediato dell’impianto rispetto alla guarigione spontanea dell’alveolo
In letteratura sono riportate poche informazioni sul confronto della guarigione di alveoli post-estrattivi con o senza inserimento di un impianto. Uno studio (Araujo et al., 2005) ha riportato che l’ammontare di riduzione dell’altezza dell’osso buccale dopo 3 mesi di guarigione era di circa 2,2 mm, in modo similare per i siti implantari e i siti edentuli in arcate controlaterali. Ovviamente, tale studio non è riuscito a dimostrare che l’inserimento immediato di un impianto può evitare i cambiamenti morfologici della cresta dopo l’estrazione. Più recentemente, un altro studio ha confrontato le alterazioni dimensionali della cresta alveolare che si verificano 6 settimane dopo l’inserimento immediato di un impianto o dopo la guarigione indisturbata. La valutazione delle misurazioni isometriche ha fatto rilevare che in entrambi i siti si era verificato un marcato riassorbimento osseo; questo cambiamento dimensionale è stato però costantemente più pronunciato nei siti implantari. La differenza tra la perdita ossea verticale buccale nei siti edentuli (1,20 (SD 0,76) mm) e con impianti immediati (2,32 (SD 0,36) mm) era statisticamente significativa (P<0,05) (Vignoletti et al., 2011, in pubblicazione).
Discussione
La guarigione di impianti inseriti immediatamente dopo l’estrazione del dente sembra condividere alcuni aspetti in comune con il protocollo chirurgico ritardato. La formazione ossea de novo e il processo di osteointegrazione sono similari quantitativamente e qualitativamente ai risultati riportati da Berglundh et al. (2003) quando hanno valutato la cascata biologica di eventi che guidano la guarigione di un impianto inserito in creste guarite. Valutando i tessuti molli sopracrestali, si sono rilevate alcune piccole differenze, soprattutto in termini di dimensione dell’ampiezza biologica. In un recente studio, sono state riportate dallo stesso gruppo la formazione e maturazione della mucosa perimplantare da 2 ore a 12 settimane intorno a impianti posizionati in una cresta guarita (Berglundh et al., 2007). Anche se la dimensione del tessuto connettivo era simile a quella riportata intorno a impianti immediati, sono state osservate differenze significative per quanto riguardo l’epitelio giunzionale. Durante le prime due settimane di guarigione, l’epitelio barriera era situato a 0,5 mm apicalmente alla mucosa marginale. Quattro settimane dopo l’inserimento dell’impianto la distanza era aumentata a 1,4 mm e dopo 6 settimane variava tra 1,7 e 2,1 mm. Questi risultati sono chiaramente diversi da quelli presentati nello studio dopo l’inserimento immediato dell’impianto (Vignoletti et al., 2009c) dove dopo 1 settimana l’epitelio era 4 volte maggiore, differenza che persisteva per tutto lo studio. Il risultato di un epitelio più lungo in caso di impianti inseriti in alveoli post-estrattivi è stato riportato anche da Rimondini et al. (2005). Essi hanno valutato le dimensioni epiteliali dopo l’inserimento di impianti in alveoli post-estrattivi e hanno riportato che 30-60 giorni dopo l’inserimento dell’impianto la lunghezza epiteliale era di 3,02 mm. È stato discusso che queste dimensioni epiteliali maggiori in impianti inseriti in alveoli post-estrattivi possono essere dovute alla presenza di un epitelio dente-dipendente che rimane dopo l’estrazione e che viene incorporato nel processo di guarigione dell’impianto (Vignoletti et al., 2009c). L’entità media del riassorbimento osseo buccale osservato nei siti implantari in diversi studi pre-clinici è riportata in tabella 1. Questi dati sono eterogenei, probabilmente a causa della mancanza di standardizzazione dei modelli pre-clinici usati per valutare questo protocollo. Ciò non di meno, l’evidenza di questi esperimenti su animali ha evidenziato i fattori critici che possono giocare un ruolo importante nelle alterazioni della cresta alveolare.
La presenza di un vuoto tra la superficie dell’impianto e la parete buccale dell’alveolo, così come lo spessore del piano osseo buccale, sono apparsi essere tra i fattori più critici. In effetti, diversi studi sperimentali hanno mostrato che maggiore era il diametro dell’alveolo e più spesso il piano buccale minore era il riassorbimento osseo buccale (Araujo et al., 2006, Vignoletti et al., 2009a). Questo ha condotto all’uso di impianti di diametro più piccolo onde permettere la presenza di un gap e impedire il contatto della superficie dell’impianto con l’osso buccale, riducendo così il trauma chirurgico della fresatura e della compressione durante l’inserimento dell’impianto (Caneva et al., 2010d). Tuttavia, è poco chiaro se ai fini di evitare il riassorbimento della cresta buccale sia più rilevante la parete ossea più spessa o il gap tra quest’ultima e la superficie dell’impianto. La mancanza di riassorbimento osseo osservata nell’aspetto linguale dell’alveolo e la frazione più ampia di fascio osseo che occupa l’osso buccale della parete dell’alveolo rispetto al lato linguale (Araujo et al., 2005) può suggerire che lo spessore del piano corticale residuo dopo l’estrazione può ricoprire un ruolo maggiore a questo riguardo.
È tuttora in discussione se lo scollamento del lembo e l’esposizione del sottostante osso crestale possano ridurre oppure no le alterazioni della cresta. I dati dalla letteratura hanno evidenziato una tendenza verso un minor riassorbimento di osso buccale in caso di approccio chirurgico senza lembo. Anche se la domanda rimane tuttora senza una chiara risposta, il protocollo chirurgico con o senza lembo sembra essere un fattore meno rilevante. I dati finora analizzati hanno chiaramente dimostrato che l’inserimento immediato dell’impianto non riesce a contrastare il rimodellamento osseo, ma è tuttora poco chiaro se l’inserimento immediato di un impianto sia di qualche vantaggio in termini di guarigione e conservazione del tessuto rispetto al lasciare che l’alveolo di estrazione guarisca spontaneamente. Anche in questo caso, i dati in letteratura sono controversi. Araujo et al. (2005), confrontando nelle stesse arcate la guarigione di alveoli post-estrattivi con e senza inserimento immediato di impianto, hanno osservato che l’entità della riduzione dell’altezza dell’osso buccale dopo 3 mesi di guarigione era similare in entrambi i siti delle mascelle controlaterali.
In contrasto con questi risultati, i dati istometrici di una recente ricerca dei nostri laboratori hanno chiaramente mostrato che sia nei siti di test che in quelli controllo si osservava un riassorbimento verticale del piano dell’osso buccale e che questo era però due volte più pronunciato nei siti implantari, con una differenza statisticamente significativa (Vignoletti et al., 2011). Il tempo di guarigione precoce (6 settimane) selezionato per questo studio può essere in parte responsabile delle marcate differenze osservate nello studio di Araujo et al., anche se sembra che l’inserimento di impianti in alveoli post-estrattivi non solo non è stato in grado di contrastare il rimodellamento delle pareti dell’alveolo, ma talvolta ha anche contribuito al riassorbimento dell’osso crestale buccale più pronunciato, danneggiando la guarigione spontanea dell’alveolo, almeno durante le fasi iniziali. Da un punto di vista clinico, una revisione sistematica sulla tempistica dell’inserimento implantare e i conseguenti risultati clinici ha sottolineato alcune delle limitazioni presenti in letteratura.
Gli Autori hanno dibattuto che la maggior parte degli studi presentava risultati a breve termine sulle percentuali di sopravvivenza, perdita ossea radiografica media, con assenza di informazioni sull’estetica e sulle percentuali di complicanze, quali la perimplantite (Quirynen et al., 2007). I risultati di studi controllati prospettici randomizzati, che mettono a confronto il protocollo dell’impianto immediato con quello ritardato, hanno riportato risultati molto simili e predicibili in termini di stabilità del tessuto molle (Cooper et al., 2010, Van Kesteren et al., 2010), mentre una serie di casi sull’inserimento immediato di impianti senza lembo ha evidenziato il rischio di risultati estetici compromessi (Chen et al., 2009). Più recentemente, sono stati presentati alla Comunità Scientifica diversi studi che hanno portato rilevanti informazioni per la pratica clinica. Ferrus et al. (2010) hanno valutato i fattori che possono potenzialmente influenzare le alterazioni della cresta che si verificano nell’aspetto buccale del sito di estrazione dopo l’inserimento immediato di impianti nel mascellare anteriore. Gli Autori hanno dimostrato che la posizione di inserimento dell’impianto (anteriore/posteriore), lo spessore dell’osso crestale buccale e la dimensione del gap buccale orizzontale hanno significativamente influenzato la percentuale di alterazione del tessuto duro durante il periodo di guarigione di 4 mesi dopo l’inserimento immediato di impianti negli alveoli post-estrattivi.
Quindi, nei siti implantari nel segmento premolare della mascella il riempimento del gap orizzontale era più pronunciato rispetto al segmento incisivo-canino, mentre la riduzione verticale della cresta era significativamente maggiore rispetto alla regione premolare. Inoltre, nei siti dove la parete dell’osso buccale era spessa (>1 mm), o dove il gap orizzontale era grande (>1), il grado di riempimento del gap era sostanziale. Per quanto riguarda il riassorbimento verticale crestale buccale, la perdita ossea ammontava a 1,2 (SD 2,1) mm nei siti con parete ossea buccale sottile, mentre i corrispondenti valori nei siti con parete ossea buccale spessa era di 0,4 (SD 13) mm. Considerando la rilevanza dello spessore dell’osso bucale, sono state recentemente valutate le dimensioni delle pareti ossee nei siti di estrazione in zona estetica (denti mascellari anteriori e premolari) al fine di indicare quali siano le aree anatomiche maggiormente “ideali” della mascella, adatte per l’inserimento immediato di un impianto. Come parte di uno studio prospettico (Guy Huynh-Ba et al., 2010) è stata registrata l’ampiezza delle pareti ossee buccali in 93 siti estrattivi. I risultati delle misurazioni intra-chirurgiche hanno dimostrato che la larghezza media generale delle pareti ossee buccali era di 1 mm.
Per i siti anteriori (da canino a canino) la larghezza media della parete ossea buccale era di 0,8 mm mentre per i siti posteriori (premolari) era di 1,1 mm. Nei siti anteriori l’87% delle pareti ossee buccali aveva un’ampiezza <1 e il 3% delle pareti era ampio 2 mm. Questi risultati sono stati confermati da uno studio con Cone-Beam su 250 soggetti con presenza di tutti i denti mascellari anteriori. Gli Autori hanno osservato che la parete ossea facciale nella maggior parte delle posizioni in tutti i siti esaminati aveva uno spessore <1 mm e che quasi il 50% dei siti aveva uno spessore della parete ossea che era <0,5 mm. Questi risultati anatomici hanno evidenziato le limitate indicazioni del protocollo con impianto immediato e le conseguenze cliniche del suo impiego nelle aree estetiche della bocca che devono essere tenute in considerazione.
Conclusioni
Riassumendo, si può concludere che l’inserimento immediato di un impianto non è in grado di evitare le alterazioni del tessuto duro che si verificano nella cresta alveolare dopo l’estrazione del dente. Sono tuttavia necessari altri dati, soprattutto dalla ricerca su animali, per capire l’influenza del riempimento con titanio dell’alveolo rispetto alla sua guarigione spontanea. La domanda se intorno a impianti immediati si stabilisca una maggior ampiezza biologica deve avere ancora una risposta, così come se tali risultati possano avere una eventuale rilevanza clinica. Dalla ricerca su animali e da quella clinica sembrerebbe che lo spessore della parete ossea e la presenza di un gap siano i fattori più critici per evitare il riassorbimento della parete buccale dell’alveolo. Di conseguenza, si raccomanda il posizionamento linguale/palatale degli impianti con diametro ridotto. I risultati di studi clinici e radiografici sullo spessore delle pareti dell’alveolo nell’uomo devono allertare il clinico sulle indicazioni molto limitate che questo protocollo chirurgico presenta. Al fine di superare il possibile riassorbimento osseo, si deve considerare la combinazione di procedure di incremento. Quando si utilizza questo protocollo chirurgico, si deve tenere conto anche della mancanza di dati a lungo termine per quanto riguarda l’estetica e la salute perimplantare.
Bibliografia
1. Anneroth G, Hedstrom KG, Kjellman O, Kondell PA & Nordenram A. Endosseus titanium implants in extraction sockets. An experimental study in monkeys. Int J Oral Surg 1985;14:50-54.
2. Araujo MG & Lindhe J. Dimensional ridge alterations following tooth extraction. An experimental study in the dog. J Clin Periodontol 2005;32: 212-218.
3. Araujo M G & Lindhe J. Ridge alterations following tooth extraction with and without flap elevation: an experimental study in the dog. Clin Oral Implants Res 2009;20:545-549.
4. Araujo M G & Lindhe J. Socket grafting with the use of autologous bone: an experimental study in the dog. Clin Oral Implants Res 2011;22:9-13. doi:10.1111/j.1600-0501.2010.01937.x.
5. Araujo MG, Sukekava F, Wennstrom JL & Lindhe J. Ridge alterations following implant placement in fresh extraction sockets: an experimental study in the dog. J Clin Periodontol 2005;32:645-652.
6. Araujo MG, Sukekava F, Wennstrom JL & Lindhe J. Tissue modeling following implant placement in fresh extraction sockets. Clin Oral Implants Res 2006a;17:615-624.
7. Araujo MG, Wennstrom JL & Lindhe J. Modeling of the buccal and lingual bone walls of fresh extraction sites following implant installation. Clin Oral Implants Res 2006b;17:606-614.
8. Barzilay I, Graser GN, Iranpour B, Natiella JR & Proskin HM. Immediate implantation of pure titanium implants into extraction sockets of Macaca fascicularis. Part II: Histologic observations. Int J Oral Maxillofac Implants 1996;11:489-497.
9. Berglundh T, Abrahamsson I, Welander M, Lange NP, Lindhe J. De novo alveolar bone formation adjacent to endosseous implants. Clin Oral Implants Res 2003; vol. 14 (3) pp. 251-262.
10. Berglundh T, Abrahamsson I, Lange NP, Lindhe J. Morphogenesis of the peri-implant mucosa: an experimental study in dogs. Clin Oral Implants Res 2007; vol. 18 (1) pp. 1-8
11. Blanco J, Nunez V, Aracil L, Munoz F & Ramos I. Ridge alterations following immediate implant placement in the dog: flap versus flapless surgery. J Clin Periodontol 2008; 35:640-648.
12. Botticelli D, Persson LG, Lindhe J & Berglundh T. Bone tissue formation adjacent to implants placed in fresh extraction sockets: an experimental study in dogs. Clin Oral Implants Res 2006;17:351-358.
13. Branemark PI. Osseointegration and its experimental background. J Prosthet Dent 1983;50:399-410.
14. Caneva M, Botticelli D, Salata LA, Scombatti Souza SL, Carvalho Cardoso L & Lang NP. Collagen membranes at immediate implants: a histomorphometric study in dogs. Clin Oral Implants Res 2010a; 21:891-897.
15. Caneva M, Botticelli D, Salata LA, Souza SL, Bressan E & Lang NP. Flap vs. “flapless” surgical approach at immediate implants: a histomorphometric study in dogs. Clin Oral Implants Res 2010b;21:1314-1319.
16. Caneva M, Salata LA, de Souza SS, Baffone G, Lang NP & Botticelli D. Influence of implant positioning in extraction sockets on osseointegration: histomorphometric analyses in dogs. Clin Oral Implants Res 2010c;21:43-49.
17. Caneva M, Salata LA, de Souza SS, Bressan E, Botticelli D & Lang NP. Hard tissue formation adjacent to implants of various size and configuration immediately placed into extraction sockets: an experimental study in dogs. Clin Oral Implants Res 2010d;21:885-890.
18. Cardaropoli G, Araujo M & Lindhe J (2003) Dynamics of bone tissue formation in tooth extraction sites. An experimental study in dogs. J Clin Periodontol 2003;30:809-818.
19. Chen ST, Darby IB, Reynolds EC, Clement JG. Immediate implant placement postextraction without flap elevation. J Periodontol 2009, vol. 80 (1) pp. 163-72.
20. Cooper et al. Comparison of radiographic and clinical outcomes following immediate provisionalization of single-tooth dental implants placed in healed alveolar ridges and extraction sockets. The International journal of oral & maxillofacial implants; 2010 vol. 25 (6) pp. 1222-1232.
21. de Sanctis M, Vignoletti F, Discepoli N, Zucchelli G & Sanz M. Immediate implants at fresh extraction sockets: bone healing in four different implant systems. J Clin Periodontol 2009;36:705-711.
22. Donath K & Breuner G. A method for the study of undecalcified bones and teeth with attached soft tissues. The Sage-Schliff (sawing and grinding) technique. J Oral Pathol 1982;11:318-326.
23. Ferrus J, Cecchinato D, Pjetursson EB, Lang NP, Sanz M & Lindhe J. Factors influencing ridge alterations following immediate implant placement into extraction sockets. Clin Oral Implants Res 2010;21:22-29.
24. Fickl S, Zuhr O, Wachtel H, Bolz W & Huerzeler M. Tissue alterations after tooth extraction with and without surgical trauma: a volumetric study in the beagle dog. J Clin Periodontol 2008;35:356-363.
25. Hammerle CH, Chen ST & Wilson TG Jr. Consensus statements and recommended clinical procedures regarding the placement of implants in extraction sockets. Int J Oral Maxillofac Implants 2004;19 Suppl, 26-28.
26. Huynh-Ba G, Bjarni E Pjetursson, Sanz M, Cecchinato D, Ferrus J, Lindhe J, Lang NP. Analysis of the socket bone wall dimensions in the upper maxilla in relation to immediate implant placement. Clin Oral Implants Res 2010; vol. 21 (1) pp. 37-42
27. Januário AL, Duarte WR, Barriviera M, Mesti JC, Guimarães Araújo M, Lindhe J. Dimension of the facial bone wall in the anterior maxilla: a cone-beam computed tomography study. Clinical Oral Implants Research early online publishing (2011).
28. Karabuda C, Sandalli P, Yalcin S, Steflik DE & Parr GR. Histologic and histomorphometric comparison of immediately placed hydroxyapatite-coated and titanium plasma-sprayed implants: a pilot study in dogs. Int J Oral Maxillofac Implants 1999;14:510-515.
29. Karnovsky MJ. A formaldehyde-glutaraldehyde fixative of high osmolarity for use in electron microscopy. Journal of Cell Biology 1965;27:137A-138A.
30. Paolantonio M, Dolci M, Scarano A, d’Archivio D, di Placido G, Tumini V & Piattelli A. Immediate implantation in fresh extraction sockets. A controlled clinical and histological study in man. J Periodontol 2001;72:1560-1571.
31. Quirynen M, Van Assche N, Botticelli D, Berglundh T. How does the timing of implant placement to extraction affect outcome? Int J Oral Maxillofac Implants 2007; vol. 22 Suppl pp. 203-223.
32. Rimondini L, Bruschi GB, Scipioni A, Carrassi A, Nicoli-Aldini N, Giavaresi G, Fini M, Mortellaro C & Giardino R. Tissue healing in implants immediately placed into postextraction sockets: a pilot study in a mini-pig model. Oral Surgery, Oral Medicine, Oral Pathology Oral Radiology, and Endodontics 2005;100:e43–e50.
33. van Kesteren et al. A prospective randomized clinical study of changes in soft tissue position following immediate and delayed implant placement. The International journal of oral & maxillofacial implants 2010;vol. 25 (3) pp. 562-70.
34. Sanz M, Cecchinato D, Ferrus J, Pjetursson EB, Lang NP & Lindhe J. A prospective, randomized-controlled clinical trial to evaluate bone preservation using implants with different geometry placed into extraction sockets in the maxilla. Clin Oral Implants Res 2010;21:13-21.
35. Schulte W & Heimke G. [The Tubinger immediate implant]. Quintessenz 1976;27:17-23.
36. Vignoletti F, de Sanctis M, Berglundh T, Abrahamsson I & Sanz M. Early healing of implants placed into fresh extraction sockets: an experimental study in the beagle dog. II: ridge alterations. J Clin Periodontol 2009a;36:688-697.
37. Vignoletti F, Johansson C, Albrektsson T, de Sanctis M, San Roman F & Sanz M. Early healing of implants placed into fresh extraction sockets: an experimental study in the beagle dog. De novo bone formation. J Clin Periodontol 2009b;36:265-277.
38. Vignoletti F, de Sanctis M, Berglundh T, Abrahamsson I & Sanz M. Early healing of implants placed into fresh extraction sockets: an experimental study in the beagle dog. III: soft tissue findings. J Clin Periodontol 2009c; vol. 36 (12) pp. 1059-66
39. Vignoletti F, Discepoli N, Müller A, de Sanctis M, Muñoz F, Sanz M. Bone modeling at fresh extraction sockets: immediate implant placement vs spontaneous healing. An experimental study in the beagle dog. J Clin Periodontol 2011 Accepted for pubblication.
40. Wilson TG Jr, Schenk R, Buser D & Cochran D. Implants placed in immediate extraction sites: a report of histologic and histometric analyses of human biopsies. Int J Oral Maxillofac Implants 1998;13:333-341.






La Socket Shield è attualmente l’unica tecnica che è in grado di evitare il cambiamento dimensionale dell’alveolo, mantenendo vitale i sia il legamento, sia il bundle bone che i relativi tessuti molli