L’obiettivo di questo aggiornamento monografico è quello di fornire al clinico una serie di spunti riguardanti un argomento complesso e ancora dibattuto, il riassorbimento cervicale invasivo esterno, in inglese “EICR” (External Invasive Cervical Resorption), a partire da una analisi della letteratura scientifica attuale per poi terminare con l’illustrazione di alcuni casi clinici esemplificativi
 Si laurea in Odontoiatria e Protesi Dentaria all’Universidad Europea de Valencia nel 2015. Nel 2018 consegue il master di II livello in Dental Research presso l’Università degli Studi Guglielmo Marconi. Attualmente è professore a contratto di Principi di Odontoiatria e Materiali Dentari presso l’Università degli Studi di Milano. Esercita la libera professione nel proprio studio in Milano e presso l’Istituto Stomatologico Italiano, collaborando con il reparto di Parodontologia e il dipartimento di Odontoiatria Materno-Infantile. Nella stessa struttura, è “referente di giornata” presso il reparto universitario diretto dal prof. Dino Re. È autore di pubblicazioni scientifiche su riviste nazionali e internazionali. Socio effettivo degli Amici di Brugg e socio ordinario dell’Accademia Italiana di Endodonzia e della Società Italiana di Odontoiatra Infantile
Si laurea in Odontoiatria e Protesi Dentaria all’Universidad Europea de Valencia nel 2015. Nel 2018 consegue il master di II livello in Dental Research presso l’Università degli Studi Guglielmo Marconi. Attualmente è professore a contratto di Principi di Odontoiatria e Materiali Dentari presso l’Università degli Studi di Milano. Esercita la libera professione nel proprio studio in Milano e presso l’Istituto Stomatologico Italiano, collaborando con il reparto di Parodontologia e il dipartimento di Odontoiatria Materno-Infantile. Nella stessa struttura, è “referente di giornata” presso il reparto universitario diretto dal prof. Dino Re. È autore di pubblicazioni scientifiche su riviste nazionali e internazionali. Socio effettivo degli Amici di Brugg e socio ordinario dell’Accademia Italiana di Endodonzia e della Società Italiana di Odontoiatra Infantile Laurea in Odontoiatria e Protesi Dentaria presso l’Universidad Europea de Valencia nel 2017. Master di I livello in Odontoiatria Ospedaliera presso l’Universitat de Valencia e Master di II livello in Endodonzia Clinica presso l’Università Alma Mater di Bologna. Collabora con il reparto universitario dell’Istituto Stomatologico Italiano in qualità di tutor, oltre a svolgere la propria attività presso studi privati e strutture ospedaliere
Laurea in Odontoiatria e Protesi Dentaria presso l’Universidad Europea de Valencia nel 2017. Master di I livello in Odontoiatria Ospedaliera presso l’Universitat de Valencia e Master di II livello in Endodonzia Clinica presso l’Università Alma Mater di Bologna. Collabora con il reparto universitario dell’Istituto Stomatologico Italiano in qualità di tutor, oltre a svolgere la propria attività presso studi privati e strutture ospedaliere  Laureata con lode in Odontoiatria e Protesi Dentaria all’Università degli Studi di Milano nel 2021. Frequenta il Master di Perfezionamento in Odontoiatria di Base presso l’Istituto Stomatologico Italiano di Milano. Libera professionista a Milano e provincia. Socio ordinario della Società Italiana di Odontoiatria Infantile (SIOI)
Laureata con lode in Odontoiatria e Protesi Dentaria all’Università degli Studi di Milano nel 2021. Frequenta il Master di Perfezionamento in Odontoiatria di Base presso l’Istituto Stomatologico Italiano di Milano. Libera professionista a Milano e provincia. Socio ordinario della Società Italiana di Odontoiatria Infantile (SIOI) Laureata con lode in Igiene Dentale presso l’Università degli Studi dell’Insubria di Varese nel 2016. Dal 2018 è iscritta al corso di laurea in Odontoiatria e Protesi Dentaria presso l’Università degli Studi di Milano con sedi Policlinico di Milano e Istituto Stomatologico Italiano. Libera professionista in provincia di Varese. È iscritta all’Albo della Professione Sanitaria di Igienista Dentale presso l’ordine TSRM PSTRP di Varese
Laureata con lode in Igiene Dentale presso l’Università degli Studi dell’Insubria di Varese nel 2016. Dal 2018 è iscritta al corso di laurea in Odontoiatria e Protesi Dentaria presso l’Università degli Studi di Milano con sedi Policlinico di Milano e Istituto Stomatologico Italiano. Libera professionista in provincia di Varese. È iscritta all’Albo della Professione Sanitaria di Igienista Dentale presso l’ordine TSRM PSTRP di Varese  Laureata in Odontoiatria e Protesi dentaria all’Universidad Alfonso X El Sabio di Madrid nel 2021. Attualmente frequenza presso reparto universitario dell’Istituto Stomatologico Italiano e Master in chirurgia e parodontologia presso l’Universidad Católica San Antonio. Esercita la libera professione a Busto Arsizio
Laureata in Odontoiatria e Protesi dentaria all’Universidad Alfonso X El Sabio di Madrid nel 2021. Attualmente frequenza presso reparto universitario dell’Istituto Stomatologico Italiano e Master in chirurgia e parodontologia presso l’Universidad Católica San Antonio. Esercita la libera professione a Busto Arsizio Laureato con pieni voti in Odontoiatria e Protesi Dentaria presso l’Università degli Studi di Milano nel 2006. Corso di perfezionamento in Ortodonzia clinica, Università degli studi di Milano. Master II livello in tecnica SWM-MBT in Ortodonzia, Università Roma Tor Vergata. Corso avanzato annuale tecnica straight wire SWM. Relatore in corsi nazionali e internazionali sulla riabilitazione estetica con materiali compositi. Relatore in congressi nazionali a tema endodontico. Professore a contratto presso l’Università degli studi di Milano per l’insegnamento di Materiali Dentari. Socio ordinario SIE (Società Italiana di endodonzia). Socio ordinario SIDO (Società Italiana Di Ortodonzia). ESE Certified Member (European Society of Endodontology). Autore di pubblicazioni scientifiche su riviste nazionali e internazionali
Laureato con pieni voti in Odontoiatria e Protesi Dentaria presso l’Università degli Studi di Milano nel 2006. Corso di perfezionamento in Ortodonzia clinica, Università degli studi di Milano. Master II livello in tecnica SWM-MBT in Ortodonzia, Università Roma Tor Vergata. Corso avanzato annuale tecnica straight wire SWM. Relatore in corsi nazionali e internazionali sulla riabilitazione estetica con materiali compositi. Relatore in congressi nazionali a tema endodontico. Professore a contratto presso l’Università degli studi di Milano per l’insegnamento di Materiali Dentari. Socio ordinario SIE (Società Italiana di endodonzia). Socio ordinario SIDO (Società Italiana Di Ortodonzia). ESE Certified Member (European Society of Endodontology). Autore di pubblicazioni scientifiche su riviste nazionali e internazionali  Laureato col massimo dei voti in Odontoiatria e Protesi Dentaria presso l’Università degli Studi di Bari. Perfezionato in Endodonzia presso il Dipartimento di Odontostomatologia dell’Università di Firenze. Professore a.c. in Odontoiatria Conservativa ed Endodonzia 2 presso il CLOPD Università dell’Insubria Varese. Socio Attivo della Accademia Italiana di Endodonzia (AIE). Socio Attivo della Società Italiana di Endodonzia (SIE). Certified Member European Society of Endodontology (ESE). Specialist Member America Academy of Endodontists (AAE). Ha frequentato il Microscope training center della University of Pennsylvania School of Dental medicine Department of Endodontics, di Philadelphia. Si occupa di endodonzia e odontoiatria restaurativa con l’ausilio del microscopio operatorio
Laureato col massimo dei voti in Odontoiatria e Protesi Dentaria presso l’Università degli Studi di Bari. Perfezionato in Endodonzia presso il Dipartimento di Odontostomatologia dell’Università di Firenze. Professore a.c. in Odontoiatria Conservativa ed Endodonzia 2 presso il CLOPD Università dell’Insubria Varese. Socio Attivo della Accademia Italiana di Endodonzia (AIE). Socio Attivo della Società Italiana di Endodonzia (SIE). Certified Member European Society of Endodontology (ESE). Specialist Member America Academy of Endodontists (AAE). Ha frequentato il Microscope training center della University of Pennsylvania School of Dental medicine Department of Endodontics, di Philadelphia. Si occupa di endodonzia e odontoiatria restaurativa con l’ausilio del microscopio operatorio Professore Associato dell’Università degli Studi di Milano, Facoltà di Medicina e Chirurgia, Corso di Laurea in Odontoiatria e Protesi Dentaria, Dipartimento di Scienze Biomediche, Chirurgiche ed Odontoiatriche. Titolare dell’Insegnamento di Protesi dentaria. Direttore del Reparto Universitario di Estetica Dentale presso l’Istituto Stomatologico Italiano di Milano. Specialista in Odontostomatologia. Specialista in Ortognatodonzia. Socio delle seguenti società scientifiche: AAE (American Association of Endodontists), ESE (European Society of Endodontic), IADR (International Association of Dental Research), IADT (International Association of Dental Traumatology). Socio attivo della SIDOC (Società Italiana di Odontoiatria Conservatrice) e della Società Italiana di Endodonzia (SIE). È Autore di oltre 200 pubblicazioni scientifiche nonché relatore a numerosi corsi e congressi in campo nazionale e internazionale. La sua attività di ricerca riguarda prevalentemente l’odontoiatria restauratrice, la protesi, l’endodonzia e la traumatologia dentale
Professore Associato dell’Università degli Studi di Milano, Facoltà di Medicina e Chirurgia, Corso di Laurea in Odontoiatria e Protesi Dentaria, Dipartimento di Scienze Biomediche, Chirurgiche ed Odontoiatriche. Titolare dell’Insegnamento di Protesi dentaria. Direttore del Reparto Universitario di Estetica Dentale presso l’Istituto Stomatologico Italiano di Milano. Specialista in Odontostomatologia. Specialista in Ortognatodonzia. Socio delle seguenti società scientifiche: AAE (American Association of Endodontists), ESE (European Society of Endodontic), IADR (International Association of Dental Research), IADT (International Association of Dental Traumatology). Socio attivo della SIDOC (Società Italiana di Odontoiatria Conservatrice) e della Società Italiana di Endodonzia (SIE). È Autore di oltre 200 pubblicazioni scientifiche nonché relatore a numerosi corsi e congressi in campo nazionale e internazionale. La sua attività di ricerca riguarda prevalentemente l’odontoiatria restauratrice, la protesi, l’endodonzia e la traumatologia dentaleIl riassorbimento radicolare, altrimenti conosciuto con il termine rizolisi, è una perdita dei tessuti duri del dente, che può essere di tipo fisiologico o patologico. Il primo caso si osserva generalmente durante il corso dell’esfoliazione dei denti decidui, permette la successiva eruzione del dente sottostante e le principali cellule responsabili di questo fenomeno sono gli odontoclasti1.
La nutrizione e le funzioni endocrine regolano l’eruzione dei denti permanenti e, indirettamente, controllano anche il riassorbimento della radice dei denti decidui2.
Il riassorbimento patologico, invece, riguarda i denti permanenti e può associarsi a determinate problematiche cliniche, che possono richiedere un trattamento di tipo conservativo, endodontico o estrattivo nei casi più gravi1. Nella classificazione delle patologie che inducono la rizolisi si osservano differenti cause: infiammatorie, come la pulpite, i traumi dentali, le lesioni parodontali, le forze ortodontiche applicate a livello radicolare, il trauma occlusale nei casi di pazienti con problemi gnatologici, la pressione esercitata dai denti inclusi, da cisti o tumori3.
Il tipo di riassorbimento che si sviluppa dipende direttamente dalla tipologia e dall’intensità della noxa, oltre che dallo stato della radice e della polpa dell’elemento colpito. La stessa causa può essere comune a diversi tipi di riassorbimento, mentre la severità ne determina il tipo: un impatto traumatico minore produrrà un riassorbimento autolimitante, che si interrompe spontaneamente senza che sia necessario un intervento terapeutico4; mentre l’interessamento di un’area più ampia, oltre il 20% del cemento radicolare, comporterà un’estesa necrosi che non potrà guarire spontaneamente, con conseguente riassorbimento radicolare5.
Il cemento funge da barriera protettiva, ma nel caso in cui venga meno la dentina risulta aggredibile e, assieme al tessuto osseo, può subire un processo di rimodellamento. In seguito a gravi traumi, come avulsione o lussazione, è probabile che si verifichi un riassorbimento sostitutivo: le cellule trasformano la dentina radicolare in osso, non essendo in grado di distinguere i diversi tessuti, provocando quindi l’anchilosi del dente4, 6. L’eziopatogenesi di questa patologia dentale non è ancora stata del tutto chiarita. Nell’ultimo decennio, sono stati pubblicati diversi articoli che affrontano e analizzano i possibili fattori causanti, tra i quali ritroviamo:
- l’occlusione e il trauma occlusale;
- il bruxismo e le parafunzioni dentali;
- i trattamenti di odontoiatria estetica, come lo sbiancamento, data la diffusione chimica dell’agente attraverso i tubuli dentinali o il legamento parodontale7, 8.
Generalmente, i riassorbimenti si presentano come lesioni asintomatiche; le caratteristiche cliniche possono variare in base al tipo di lesione. Nelle patologie infiammatorie esterne il dente tende ad assumere una discolorazione tendenzialmente rosacea o rossastra e, dal punto di vista clinico, sono osservabili lesioni parodontali. Si possono effettuare test di vitalità, anche se la diagnosi definitiva si raggiunge grazie al corretto impiego degli esami radiografici di primo e secondo livello; l’interessamento della vitalità del dente può dipendere dall’estensione e dalla tipologia di riassorbimento9.
Tipologie di riassorbimento radicolare
Il riassorbimento può essere interno o esterno, in base alla localizzazione in cui inizia il processo1. Generalmente quello esterno è causato dall’infiammazione iniziale del tessuto parodontale, mentre quello interno è direttamente correlato alla flogosi del tessuto pulpare.
Le cellule coinvolte nel riassorbimento radicolare, interno ed esterno, sono gli osteoblasti ed odontoclasti attivati da uno stimolo; inoltre, intervengono anche le cellule infiammatorie come linfociti, macrofagi e fibroblasti10.
Durante un riassorbimento esterno si ha una penetrazione delle tossine batteriche, provenienti dal parodonto, all’interno dei tubuli dentinali, che stimolano il processo di riassorbimento stesso. Nei denti giovani, i tubuli dentinali hanno una maggior ampiezza, favorendo l’accesso delle sostanze irritanti e quindi rendendo il processo di riassorbimento più veloce.
Nel fluido crevicolare dei denti affetti da riassorbimento, si osserva l’aumento di IL – α (Interleuchina 1: citochina che favorisce i processi infiammatori), IL – β e TNF (fattore di necrosi tumorale, citochina coinvolta nell’infiammazione acuta)10.
Il riassorbimento esterno viene diviso in quattro categorie: riassorbimento superficiale (ESR), riassorbimento infiammatorio esterno (EIR), riassorbimento cervicale esterno (ECR), riassorbimento sostitutivo esterno (ERR) e riassorbimento apicale transitorio (TAB). A sua volta, il riassorbimento di tipo infiammatorio esterno può essere: cervicale, con o senza vitalità della polpa, e apicale1.
L’ESR è un tipo di riassorbimento dovuto alla pressione, che si risolve quando si rimuove lo stimolo causante. Le principali cause sono: tumori, cisti, denti inclusi ed il trattamento ortodontico9, 11, 12.
L’EIR si ritrova in denti necrotici ed è comune nei denti con parodontite periapicale. Laux et al. dimostrano che i processi patologici nella zona periapicale determinano vari gradi di compromissione del periapice in quattro elementi dentali su cinque13. Clinicamente la sintomatologia è simile a quella della parodontite periapicale, con vitalità negativa e dolore alla percussione. Radiograficamente si osserva una riduzione della lunghezza radicolare e un’immagine radiotrasparente a forma di cratere sulla superficie della radice colpita. Il trattamento d’elezione è la terapia endodontica9.
L’ECR è un tipo di riassorbimento aggressivo: si sviluppa a seguito di danno e/o alterazione del legamento parodontale e del cemento sottoepiteliale1, 14. È dovuto all’azione clastica, attivata da un trauma sul cemento e stimolata successivamente da un’infezione. In questo processo sono presenti tre fasi: in primo luogo lo stimolo, posteriormente la fase di riassorbimento, che solitamente è prolungata data l’invasione della superficie radicolare da parte degli osteoclasti del parodonto con la conseguente formazione di una lesione fibrovascolare, e, per ultimo, quella riparativa, dove la lesione si calcifica e si trasforma in tessuto osteoide15. È considerato un fenomeno patologico raro a causa del ridotto numero di casi clinici riportati.
Il suo tasso di prevalenza varia dallo 0,02% allo 0,08% a seconda degli studi epidemiologici effettuati25, 47.
Tuttavia, nello studio di Irinakis et al.48, pubblicato recentemente, la prevalenza complessiva di ECR tra i pazienti endodontici durante il follow-up a 10 anni è stata del 2,3%. L’ECR era più frequente negli elementi dentali del settore antero-superiore, a livello del II sestante (31,6%) e la diagnosi di classe 2 di Heithersay era quella con maggior prevalenza (38,8%).
Pur non essendo ancora stata individuata una determinata causa, vari fattori possono incidere: traumi, trattamento ortodontico, trattamento parodontale, chirurgia dento-alveolare, sbiancamento, bifosfonati, virus Varicella Zoster e cause non ancora identificate14,16, 17.
L’ECR è clinicamente asintomatico, tranne nei casi più avanzati, in cui c’è un coinvolgimento pulpare; il segno clinico tipico è una colorazione rosacea. La diagnosi differenziale viene fatta con la lesione cariosa. Anche in questo caso è molto importante la diagnosi radiografica: un segno radiografico tipico è il canale radicolare visibile attraverso la lesione18.
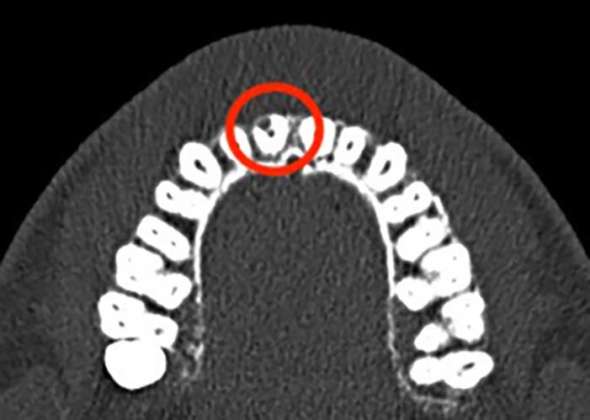
La CBCT è fondamentale per un corretto piano di trattamento, poiché permette di visualizzare l’ECR su qualsiasi piano, senza sovrapposizioni e distorsioni, favorendo dunque una valutazione dettagliata del caso clinico19. I possibili trattamenti sono molteplici e variano in base all’estensione della lesione, alla presenza di comunicazione con il canale radicolare e alla possibilità di restauro del dente18, 20.
L’ERR è frequente dopo traumi da lussazione e avulsione. Il segno clinico tipico di questa patologia è il suono metallico acuto alla percussione. I test di vitalità risultano positivi. In questi casi si consiglia di tenere sotto controllo il dente in questione e di fare una CBCT nel caso in cui la lesione aumenti gradualmente nel tempo. È fondamentale poter diagnosticare questa patologia nei bambini e negli adolescenti poiché, a causa della mancata eruzione dei denti anchilosati, si ha un difetto di crescita ossea, che bisognerà trattare chirurgicamente1, 9.
Il TAB è un riassorbimento transitorio non infetto della porzione apicale della radice e dell’osso alveolare, dovuto a un trauma da lussazione moderato9.
Il riassorbimento radicolare interno, invece, può essere di tipo infiammatorio (IIR) o per sostituzione (IRR). Il primo tipo si verifica a seguito di danni alla predentina, sia per traumi fisici e/o chimici, sia per infiammazione cronica della polpa dentale.
Ciò che contraddistingue l’IRR attivo è la necrosi del canale radicolare coronale alla lesione, mentre apicalmente la polpa è vitale. Questa è una situazione ideale per la proliferazione degli odontoclasti e la progressione della lesione stessa. Tuttavia, se il dente perde vitalità, il riassorbimento cessa di progredire9.
Esistono, infine, variazioni in cui il riassorbimento esterno viene combinato con l’interno 21. Gli odontoblasti e la predentina non mineralizzata fungono da barriera protettiva per il riassorbimento, ma nei casi in cui i denti presentano una pulpite cronica, questo stato protettivo si perde, dando luogo dunque a un riassorbimento radicolare interno22.
Riassorbimento Cervicale Invasivo Esterno (EICR)
Eziologia dell’EICR
Il riassorbimento cervicale invasivo esterno (EICR) è la forma di riassorbimento meno conosciuta ed è stata ampiamente descritta da Heithersay, il quale aggiunse il termine “invasivo”18, per descrivere al meglio la sua natura. È un processo dinamico che coinvolge il parodonto, i denti e anche i tessuti pulpari14. La causa esatta dell’EICR è ancora poco conosciuta. Gli studi sull’eziologia si sono concentrati principalmente su tre aspetti23.
- Analisi istopatologica della lesione: l’EICR inizia all’esterno della superficie del dente, sopra la cresta ossea alveolare, e porta alla graduale sostituzione della struttura mineralizzata del dente con tessuto fibrovascolare granulomatoso24. Il processo inizia con un’interruzione del legamento parodontale - causata da un trauma oppure dalla naturale chiusura incompleta della giunzione amelo-cementizia (CEJ) - che porta alla perdita degli strati di pre-cemento non mineralizzati, al richiamo di cellule infiammatorie e odontoclastiche, che si accumulano sotto l’attacco epiteliale della gengiva, e alla formazione di tessuto di granulazione, che penetra nella dentina, a livello della CEJ. Il cemento è un tessuto protettivo per la dentina radicolare perché previene il suo riassorbimento. La letteratura concorda nel dire che il danno o la carenza di questo strato protettivo espone la superficie radicolare agli osteoclasti, che iniziano il processo di riassorbimento25. Rimane ancora dibattuto se i microrganismi possano essere responsabili dell’osteoclastogenesi (teoria dell’infezione) oppure no (teoria dell’infiammazione)24. È fondamentale ricordare che nella dentatura decidua il riassorbimento radicolare è fisiologico e facilita l’eruzione del corrispettivo permanente23.
- Potenziali fattori predisponenti: Heithersay, studiando un gruppo di 222 pazienti e di 257 denti, è stato il primo a descrivere i fattori predisponenti all’EICR26. Notò che in molti casi c’era una correlazione con precedenti trattamenti ortodontici, traumi, sbiancamenti endodontici, chirurgia, bruxismo, restauri, e nel 16,4% dei casi il riassorbimento veniva definito idiopatico, ovvero senza una causa apparente14. Il limite dello studio di Heithersay è che non c’è stato un follow-up, soprattutto nei pazienti ortodontici, avendo lui identificato il trattamento ortodontico come prima causa di riassorbimento esterno. Negli ultimi anni, nuovi studi hanno dimostrato che anche altri fattori possono essere collegati all’ECR: la malocclusione, la parodontite e i suoi trattamenti (eliminazione accidentale del cemento durante le manovre di levigatura radicolare), l’autotrapianto di dente, l’herpes zoster, l’uso di bifosfonati, l’ipoplasia e l’ipomineralizzazione del cemento, le malattie sistemiche (specialmente iperossaluria e ossalosi)18, la predisposizione genetica e l’ipossia, che potrebbe svolgere un ruolo nella continua produzione di tessuto di granulazione. Comunque, nella maggior parte dei casi, l’EICR sembra essere multifattoriale, oppure causato da due o tre fattori in combinazione, e non sembra essere legato al sesso del paziente14.
- Patogenesi del riassorbimento radicolare: le fasi di sviluppo dell’EICR derivano da osservazioni isto-morfologiche e da esami clinici. Nella fase iniziale avvengono, in ordine, l’interruzione del legamento parodontale, il reclutamento delle cellule infiammatorie, la conseguente produzione di tessuto di granulazione e quindi l’esposizione dentinale. Nella fase progressiva si richiamano gli osteoclasti e avviene la formazione delle lacune di riassorbimento. Infine, nella fase riparativa c’è la sostituzione del tessuto di granulazione e il rimodellamento. La fase riparativa e la fase progressiva avvengono sempre insieme23.
Un’altra importante distinzione che deve essere fatta è quella tra dente vitale e quello trattato endodonticamente: quali sono le differenze? Perché le lesioni da riassorbimento invadono raramente lo spazio pulpare? Si ipotizza che sia il pre-cemento non mineralizzato sia la dentina dello spazio peri-canalare, definiti Pericanalar Resorption-Resistant Sheet (PRRS)27, fungano come protezione dal riassorbimento: il loro minor contenuto minerale inibisce l’attecchimento degli osteoclasti e la normale tensione dell’ossigeno, che deriva dall’apporto di sangue al tessuto pulpare, attenua le attività clastiche. Infatti, quando la lesione da riassorbimento si avvicina al tessuto pulpare, i foglietti impediscono l’ingresso della lesione nello spazio peri-canalare. Ci sono due differenze nel pattern di generazione24:
- Intensità del riassorbimento: nei denti trattati endodonticamente si osserva un riassorbimento più esteso e questo può essere dovuto al fatto che parte della PRRS viene danneggiata durante la terapia canalare.
- Presenza di tessuto osseo: la rimozione del tessuto pulpare determina una condizione di ipossia, attorno ai PRRS, che contribuisce alla continua crescita del tessuto di granulazione, che a sua volta stimola la crescita osteoclastica. I denti vitali, invece, mantengono degli ambienti normossici attorno ai PRRS, consentendo così la sostituzione del tessuto granulomatoso con tessuto osseo.
Classificazione di Heithersay
Per aiutare il clinico a scegliere il trattamento più corretto, sono state proposte, da diversi autori, delle classificazioni dell’EICR. Tuttavia, quella più riconosciuta è quella di Heithersay, che ha classificato l’EICR in base all’estensione della lesione all’interno del dente26.
- Classe 1: piccola lesione vicino all’area cervicale con scarsa penetrazione nella dentina.
- Classe 2: lesione ben definita che è penetrata vicino alla camera pulpare, ma mostra poco o niente estensione nella dentina radicolare.
- Classe 3: un’invasione più profonda della dentina che coinvolge non solo la dentina coronale, ma anche il terzo coronale della radice.
- Classe 4: grande processo di riassorbimento invasivo che si estende oltre il terzo coronale del canale radicolare e può interessare quasi l’intera radice.
Un’attenta selezione dei casi è fondamentale per ottenere una buona prognosi23: Le lesioni di classe da 1 a 3 possono essere trattate, mentre il trattamento di quelle di classe 4, a causa della loro natura estensiva, ha un maggior rischio di fallimento, quindi è forse meglio optare per l’avulsione dell’elemento. La classificazione di Heithersay è utile per valutare l’estensione del difetto, ma solo per quelle lesioni che si trovano a livello prossimale. Tuttavia, è molto di più difficile identificare la vera natura dei difetti localizzati, o progrediti, sul lato labiale o palatale. La vera natura di questi difetti può essere valutata solo con CBCT18.
Diagnosi clinica e differenziale
La valutazione diagnostica del riassorbimento è molto complicata, a causa della sua insorgenza quiescente. Sebbene l’EICR possa essere casualmente rilevato con una radiografia, nella maggior parte dei casi non viene mai diagnosticato fino a quando i sintomi di pulpite o parodontite apicale non sono evidenti23. La presentazione clinica dell’EICR è determinata dalla localizzazione e dall’estensione della lesione. Il primo passo da fare per la diagnosi è l’esaminazione endodontica di base, che ci consente di ottenere una visione generale della lesione23.
- Ispezione: nei casi in cui la lesione si trovi in zona vestibolare o linguale/palatale, può essere visibile una colorazione rosea sulla corona, che rappresenta il tessuto di granulazione visibile attraverso il tessuto duro dentale danneggiato. Tuttavia, questo colore potrebbe non essere evidente se la lesione si localizza in zona interprossimale o palatale o se si estende apicalmente o coronalmente alla radice.
- Sondaggio: è una procedura essenziale per la diagnosi differenziale tra EICR e carie sottogengivale. La prima al sondaggio ha una consistenza simile a quella della dentina, la seconda ne ha una morbida e appiccicosa. Inoltre, quando sondiamo la base della cavità di riassorbimento, potremmo sentire un suono raschiante e vedere sanguinamento.
- Mobilità dei denti: la mobilità è causata dalla degradazione del tessuto dentale in zona cervicale e avviene nelle fasi avanzate della malattia.
- Stato gengivale: nelle prime fasi il margine gengivale appare leggermente irregolare e, talvolta, anche ipertrofico e iperemico. Queste caratteristiche non sono distintive di questa condizione e devono entrare in diagnosi differenziale con stati di gengivite.
- Condizione della cavità della polpa: sebbene lo spazio della polpa non sia spesso coinvolto dai processi di riassorbimento, il dente colpito mostra una risposta positiva al test di vitalità. Tuttavia, in fase avanzata, quando il riassorbimento penetra attraverso la PRRS, i pazienti potrebbero riportare sintomi di pulpite o di parodontite apicale, rispondendo negativamente al test di vitalità (Tabella 1).

Diagnosi radiologica
La vera diagnosi di EICR viene fatta utilizzando metodiche di imaging, a causa della mancanza di veri segni e sintomi patognomonici della malattia23. Per la diagnosi si utilizzano principalmente la radiografia periapicale e la CBCT (Come Bean Computer Tomography). La radiografia periapicale in passato era la modalità diagnostica d’elezione per gli EICR, tuttavia è stato assodato che non poter vedere la lesione tridimensionalmente sia un fattore limitante19. Altri svantaggi sono l’impossibilità di diagnosticare precocemente le lesioni, sottostimando quindi l’incidenza, di misurarle, una volta identificate, a causa della vicinanza con altre strutture anatomiche, soprattutto quando si trova in zona vestibolare o linguale/palatale (72% dei casi), e di stimare la vicinanza con la camera pulpare23. L’unico caso in cui si può valutare un EICR da una radiografia periapicale è quando si trova prossimale alla radice19.
La tomografia computerizzata a fascio conico (CBCT) è diventata un’opzione di imaging sempre più importante nella diagnosi delle problematiche endodontiche, poiché consente di visualizzare l’EICR su qualsiasi piano, senza la sovrapposizione di strutture sovrastanti e senza distorsione geometrica. Questo permette una valutazione più dettagliata della lesione, soprattutto le proiezioni canalari che partono dalla lesione principale, importanti perché possono comunicare con il legamento parodontale e possono contenere del tessuto di riassorbimento che fa propagare l’EICR, e la presenza di materiale radiopaco calcificato ectopico, che può determinare un continuo riassorbimento del tessuto fibro-osseo. Inoltre, la CBCT permette di valutare la sua posizione, la vicinanza al canale, la possibilità di accessibilità: questo è fondamentale per il piano di trattamento19. Se confrontiamo la radiografia periapicale con la CBCT vediamo che la seconda ha migliore sensibilità, specificità e accuratezza della prima28; inoltre, riesce a valutare se una lesione è in fase di arresto, riparazione o progressione nel periodo di follow-up dopo il trattamento.
L’associazione americana degli endodontisti (AAE – American Association of Endodontists) raccomandava di eseguire la CBCT con un campo limitato, al fine di ridurre la dose di radiazione e di ottenere maggior spazialità. Tuttavia, si è visto che in caso di riassorbimento multiplo è meglio avere un campo visivo maggiore. Inoltre, la CBCT non dovrebbe essere usata come screening e un esame obiettivo preciso e mirato dovrebbe essere eseguito prima di effettuare un esame radiologico23.
Da uno studio che comparava due differenti dispositivi CBCT e la radiografia periapicale è emerso che la presenza di EICR è stata correttamente rilevata circa nell’80% degli incisivi, nel 90% dei premolari e nell’80% dei molari con le metodiche tridimensionali, invece, con la radiografia periapicale, nel 60% degli incisivi e premolari e nel 25% dei molari. È emerso, inoltre, che entrambi i dispostivi CBCT hanno identificato correttamente l’EICR sulle superfici dei denti per oltre l’87%, mentre le radiografie periapicali in meno del 50%. Infine, i dispositivi CBCT hanno identificato correttamente le lesioni secondo la classificazione di Heithersay, invece le periapicali hanno prodotto scarsi risultati.
Ricordiamo che questa classificazione è rilevante solo se l’EICR è limitato all’aspetto prossimale del dente, che può essere visto anche bidimensionalmente. Quando la lesione è sul versante linguale/palatale o vestibolare, allora diventa fondamentale l’utilizzo della radiologia tridimensionale. Pertanto, la maggior parte delle lesioni diventa impossibile da descrivere in tre dimensioni utilizzando la classificazione di Heithersay, poiché mancano alcune categorie come la circonferenza e la posizione della lesione29.
Nuova classificazione radiologica
Questa nuova classificazione clinica, ideata da Patel e colleghi, tiene conto della localizzazione della lesione, della diffusione circonferenziale e della vicinanza al canale radicolare, che devono essere valutate solo dopo aver analizzato la radiografia periapicale e la CBCT. Solamente in questo modo l’EICR può essere classificato tridimensionalmente19.
Localizzazione apico-coronale: è valutata in base alla sua massima estensione verticale, all’interno della superficie radicolare, e al livello di osso crestale, che è fondamentale per il trattamento. La radice è divisa in terzo coronale, medio e apicale, usando la CEJ come punto di riferimento. L’altezza può essere valutata al meglio utilizzando sia la radiografia periapicale che la CBCT, in proiezione sagittale e coronale. Si classificano quattro stadi della lesione:
- a livello della CEJ o coronale alla cresta ossea (sovra-crestale);
- nel terzo coronale della radice ed è apicale alla cresta ossea (sotto-crestale);
- nel terzo medio della radice;
- nel terzo apicale della radice.
Diffusione circonferenziale: la circonferenza della lesione è classificata secondo la sua massima diffusione all’interno della radice, grazie alle proiezioni sagittali della CBCT.
A: ≤90°;
B: da >90° a ≤180°;
C: da >180° a ≤270°;
D: >270°.
Vicinanza al canale radicolare: può essere valutata utilizzando proiezioni CBCT assiali.
- d: lesione confinata alla dentina;
- p: probabile coinvolgimento pulpare.
Trattamento del riassorbimento invasivo cervicale esterno
Il trattamento dell’EICR dipende dalla gravità e dalla localizzazione del difetto di riassorbimento, nonché dalla fattibilità del restauro dentale30. Le strategie operative utilizzate nella terapia dell’EICR si distinguono in base al tipo di approccio adottato (Tabella 2).
- L’approccio esterno prevede un accesso alla lesione dall’esterno: se la lesione è al di sopra del terzo coronale della radice e non si estende al di sotto della cresta ossea alveolare è sufficiente un trattamento esterno non chirurgico, al contrario si rende necessario l’intervento chirurgico (incisione intrasulculare e lembo mucoperiostale a seconda dell’entità della lesione) qualora la localizzazione sia molto al di sotto del margine gengivale.
- L’approccio interno prevede un accesso endodontico ortogrado non chirurgico al difetto, indipendentemente dalla posizione della lesione24. Questo tipo di trattamento viene indicato quando l’accesso è localizzato al di sotto della giunzione epiteliale, di piccola entità, intraosseo e coinvolge ampiamente il sistema camerale. Un approccio esterno, in tal caso, comporterebbe un importante sacrificio di sostanza dentale sana e di osso alveolare30. La terapia canalare è necessaria ogni volta che l’EICR abbia perforato il sistema dei canali radicolari creando una comunicazione diretta. I segni e sintomi di pulpite irreversibile, necrosi pulpare e sofferenza periapicale dell’elemento dentale guidano il clinico nella scelta del trattamento endodontico. In tali situazioni l’otturazione canalare impedisce un blocco involontario della pervietà dell’endodonto durante le fasi di restauro del difetto e fornisce, allo stesso tempo, una barriera contro la quale il materiale da restauro può essere adeguatamente condensato30.

Nei casi in cui l’approccio esterno (chirurgico e non) e interno non siano praticabili, l’opzione terapeutica può ricadere sul reimpianto intenzionale46. La localizzazione dell’EICR nel terzo medio/apicale della radice o interprossimale lo rende inaccessibile alla chirurgia ed incline ad un reimpianto intenzionale.
Al contrario, i denti con malattia parodontale avanzata e a rischio di frattura radicolare e/o coronale durante le manovre estrattive sono controindicati al reimpianto. L’estrazione atraumatica e lo splintaggio di almeno due settimane, associati ad un ridotto tempo di permanenza dell’elemento in sede extraorale (inferiore ai 15 minuti), permettono di conservare la vitalità delle fibre del legamento parodontale, del cemento e rappresentano dei fattori prognostici positivi per il successo del reimpianto30.
Esistono situazioni cliniche in cui l’elemento dentale affetto da EICR risulta non trattabile. In un contesto clinico in cui l’accesso al difetto richiede un’ampia rimozione di osso alveolare e di struttura dentale sana per essere riparato, l’odontoiatra (in accordo con il paziente) può scegliere di monitorare nel tempo l’evoluzione del riassorbimento30. Di fatto si potrebbe assistere all’interruzione della progressione della lesione e il passaggio alla fase riparativa30.
È consigliata una valutazione periodica annuale dell’andamento del processo di riassorbimento al fine di individuare manifestazioni cliniche quali comparsa di sintomatologia, decolorazione della corona ed eventuale frattura coronale. Il monitoraggio clinico deve essere accompagnato da un’attenta valutazione radiografica in grado di intercettare precocemente segni di malattia parodontale e/o periapicale18, 30.
Qualora non siano visibili segni di miglioramento del quadro clinico, al termine del follow-up potrà essere necessario procedere all’estrazione chirurgica del dente. La terapia estrattiva rappresenta il trattamento di scelta per tutti gli elementi dentali non restaurabili, con EICR estesi e che hanno eccessivamente indebolito la struttura dentale residua30 (Figura 1).
Definiti i protocolli clinici, quali materiali utilizzare per la riparazione di tali difetti? Quali sono i vantaggi dei nuovi materiali bioattivi?
Tradizionalmente l’Acido Tricloroacetico (TCA) veniva impiegato nella gestione delle lesioni da riassorbimento favorendo la necrosi coagulativa e facilitando la rimozione del tessuto di riassorbimento20. Il suo utilizzo però non era privo di controindicazioni, quali l’infiammazione a carico del tessuto parodontale e la rimozione dei cristalli di idrossiapatite dalla superficie dentinale, con conseguente riduzione dell’efficacia del sistema adesivo.
Nella moderna endodonzia, l’utilizzo di opportuni inserti ultrasonici sostituisce l’applicazione topica di acido TCA garantendo un accesso sicuro alle aree di riassorbimento, senza danni alla struttura dentale sana20. Per la rimozione non meccanica delle lesioni, la medicazione con idrossido di calcio associata alla irrigazione di ipoclorito di sodio permette di dissolvere, necrotizzare il tessuto granulomatoso di riassorbimento e di arrestare l’emorragia all’interno della lesione 43.
In letteratura, i cementi vetroinomerici (GIC) e i cementi vetroinomerici modificati con resina (RMGIC) vengono descritti come materiali per il restauro dei riassorbimenti cervicali esterni grazie alle loro proprietà di idrofilia, rilascio di fluoro e capacità di adesione chimica al tessuto dentinale. Nei difetti sottogengivali tali materiali consentono l’attacco gengivale, senza però indurre rigenerazione del cemento e del tessuto osso alveolare adiacente24. Ad oggi, questi materiali vengono ampiamente sostituiti dai cementi bioceramici ad elevata biocompatibilità quali MTA e Biodentine.
Il cemento MTA (Mineral Trioxide Aggregate) è un composto a base di silicato tricalcico, alluminio tricalcico, ossido tricalcico e ossido di silicato, che presenta ottime proprietà meccaniche quali microdurezza, resistenza all’erosione e alla compressione24. Alla sua forte forza di adesione si associa una risposta ottimale dei tessuti biologici31. La Biodentine, prodotto a base di silicato di calcio e nata dall’evoluzione dell’MTA, ha dimostrato una superiorità in termini di resistenza all’usura e alla compressione nonché una migliore maneggevolezza rispetto all’aggregato minerale di triossido. Questo materiale bioattivo è significativamente meno influenzato dalla contaminazione dei fluidi biologici (sangue) e degli irriganti endodontici quali ipoclorito e clorexidina rispetto all’MTA34. Inoltre, dati clinici hanno dimostrato la sua capacità di promuovere la differenziazione dei fibroblasti favorendo la crescita delle fibre del legamento parodontale36. Un altro dato da non sottovalutare è l’inferiore decolorazione di questa bioceramica nel tempo, in grado di prevenire il rischio di complicanze estetiche specialmente a carico degli elementi incisivi del settore frontale35. I cementi endodontici bioattivi presentano ottime proprietà antibatteriche e un’eccellente capacità sigillante. L’assorbimento di acqua è responsabile della bioattività di questi materiali: il silicato di calcio, interagendo con l’acqua, libera idrossido di calcio e questo, a contatto con i fosfati dei tessuti periapicali, induce la precipitazione di cristalli di carbonato apatite favorendo ottimi sigilli anche in presenza di ampi difetti di riassorbimento. Promuovendo la formazione di dentina riparativa, cemento e la differenziazione degli osteoblasti, contribuiscono alla corretta riparazione dei difetti di riassorbimento localizzati in sede sottogengivale/sottocrestale e con ampio coinvolgimento del tessuto pulpare30, 32, 33.
Inoltre, il loro utilizzo induce un aumento di valore del pH. Il pH alcalino, a sua volta, rappresenta una minaccia per l’azione osteoclastica, arrestando così il processo di riassorbimento37,38.
In letteratura viene documentato l’impiego dei materiali bioattivi anche per il restauro completo di difetti da riassorbimento localizzati in sede sottogengivale e con una comunicazione diretta alla cavità orale39, 40. Infatti, i bioceramici presentano un aspetto estetico ragionevole e promuovono la crescita dell’attacco parodontale
lungo la loro superficie36. Tuttavia, nei casi clinici ad alta valenza estetica (specialmente elementi incisivi e canini del settore frontale) è indicato ripristinare il difetto rimanente con una resina composita41, 42. Le resine composite, associate ad un corretto sistema adesivo, garantiscono al restauro un’adeguata forza di adesione e rappresentano il materiale in grado di fornire i migliori risultati estetici. A seguito delle manovre di lucidatura, il restauro in resina composita restituisce una superficie completamente liscia, che impedisce lo sviluppo della placca sottogengivale a differenza della ruvida superficie dell’MTA. Un altro importante vantaggio di questi materiali è il breve setting time se confrontato con quello molto lungo dell’aggregato minerale di triossido (più di 3h), che richiede necessariamente sedute operative multiple41. Nonostante le resine composite siano meno accettate dal punto di vista biologico dai tessuti parodontali, rispetto ai materiali bioattivi è stata rilevata la presenza di una migrazione coronale del tessuto marginale gengivale. Il “Creeping Attachment”, come viene definito da Goldman, se associato a una condizione di salute gengivale, assenza di infiammazione e risoluzione dei sintomi, predispone la creazione di un nuovo attacco epiteliale gengivale con conseguente opportuno sigillo marginale44. É bene ricordare che solo un buon isolamento è in grado di garantire l’efficacia del sistema adesivo, in tutti quei casi in cui non sia possibile avere un buon controllo dell’umidità viene sconsigliato l’utilizzo delle resine composite a favore dell’MTA (il cui indurimento avviene in ambiente umido)45. Questi interventi riparativi hanno l’obiettivo ripristinare il difetto, curare i sintomi e migliorare l’estetica. L’eventuale progressione della malattia non è da escludere e per questo motivo tutti i pazienti dovrebbero essere sottoposti a regolari controlli clinici e radiografici. Attualmente non esistono linee guida relative alla frequenza di questi controlli, ma i tempi e le modalità dovranno essere concordati in relazione al caso clinico45.
Casi clinici. Riassorbimenti cervicali esterni
A continuazione vengono descritti quattro casi clinici eseguiti presso il Reparto Universitario dell’Istituto Stomatologico Italiano, nei quali si possono osservare le diverse tipologie di approccio clinico in funzione alle caratteristiche del riassorbimento e all’elemento dentario da trattare.
Caso 1 – Dr. Aiuto
Il primo caso clinico riguarda un paziente maschio di 35 anni, ASA I, che si presenta in visita per sintomatologia algica a livello del II sestante; egli inoltre è preoccupato per la comparsa di una colorazione rossastra a livello del margine cervicale del 2.1. L’esame obiettivo ci fa subito sospettare la presenza di un EICR, in un quadro di gengivite, che viene confermato dalla CBCT prescritta per determinare l’estensione e l’entità della lesione (Figure 2a, b, c).
Vista l’entità della lesione (grado 3 di Heithersay), si programmano il restauro del difetto radicolare, la terapia canalare dell’elemento, data anche la sintomatologia presente, e la riabilitazione dello stesso con una corona in disilicato di litio cementata con tecnica adesiva. Previa anestesia plessica con adrenalina (1.100.000), viene eseguita un’incisione intrasulculare e realizzato un lembo a spessore totale per l’esposizione del difetto (Figura 3).
Una volta rimosso il tessuto di granulazione con una fresa a rosetta su manipolo dritto, si posiziona un uncino 212 per il montaggio della diga di gomma, potendo così visualizzare tutti i margini della lesione. Una volta isolato il campo operatorio, si completa la rimozione del tessuto interessato dalla lesione che porta all’esposizione del lume canalare; si inserisce pertanto un cono di guttaperca con lo scopo di restaurare il difetto con il composito senza obliterare lo spazio endodontico (Figure 4 a-d e 5).
La terapia canalare si esegue per via ortograda con accesso palatino, con strumenti rotanti e abbondante detersione canalare con niclor 5% e edta al 17%. Il canale è stato chiuso con la tecnica del cono singolo e cemento bioceramico (Figure 6 a,b).
Il trattamento si completa con la realizzazione di una corona singola in disilicato di litio cementata con tecnica adesiva (Figure 7 e 8 a-f); il paziente viene inserito in un rigoroso programma di follow-up clinici e radiografici e controlli di igiene (Figure 9 a-c).
Caso 2 – Dr. Fumei, Dr. Aiuto
Il caso clinico descritto riguarda un paziente maschio di 38 anni, con anamnesi priva di patologie sistemiche di rilievo, che riferisce la presenza di sintomatologia algica in zona 1.1 (Figura 10a) durante lo spazzolamento.
All’esame obiettivo, si registra la presenza di sanguinamento al sondaggio parodontale a carico dell’elemento 1.1 (Figura 10b), che presenta inoltre un restauro pregresso di V classe. I test eseguiti rivelano l’assenza di vitalità pulpare.
L’esame radiografico periapicale evidenzia una radiotrasparenza a livello radicolare, in prossimità del restauro cervicale (Figura 11). Il sospetto diagnostico di EICR, visti i segni patognomonici della lesione, è confermato dall’analisi di indagini radiografiche più approfondite (CBCT), che suggeriscono il grado 2 della classificazione di Heithersay (Figura 12).
Vista l’età del paziente e l’elevata valenza estetica dell’elemento, si opta per un approccio minimamente invasivo con tecniche adesive. Il piano di trattamento prevede l’esposizione chirurgica del difetto radicolare e il conseguente restauro in resina composita dello stesso. L’assenza di vitalità determina la necessità di terapia canalare.
Durante la prima seduta, previa anestesia per infiltrazione, si disegna un lembo d’accesso a tutto spessore. Scollato il lembo e individuata la lesione, si procede con l’asportazione del tessuto di granulazione presente e, servendosi di una fresa a rosetta montata su manipolo dritto, con la rimozione di tutto il tessuto patologico senza invadere l’endodonto.
Prima di proseguire con le procedure adesive, si effettua un accurato controllo dell’emostasi: l’evidente impossibilità di posizionare la diga di gomma, obbliga a ricorrere alla diga liquida per evitare contaminazioni del campo operatorio. Le fasi successive rispettano i passaggi di una comune ricostruzione estetica: applicazione del sistema adesivo, inserimento di un composito flowable sul fondo della cavità e successiva stratificazione per un reintegro morfo-funzionale dell’elemento. Il restauro termina con una minuziosa fase di rifinitura e lucidatura, fondamentale per la guarigione dei tessuti molli. L’intervento si conclude con la fase di sutura (Figure 13 a-d).
Al successivo appuntamento, si rimuovono i punti di sutura e si procede con la terapia canalare, seguita dalla realizzazione di un post space per la cementazione di un perno in fibra di vetro. Questa scelta è dettata dalla pericolosa scarsità di tessuto residuo a livello cervicale. Successivamente, su richiesta del paziente, si procede con il rifacimento del restauro pregresso sul medesimo elemento dentario (Figure 14 a-c e 15).
Tutte le fasi cliniche vengono eseguite con l’ausilio del microscopio operatorio. Il paziente viene richiamato periodicamente con visite di controllo programmate a 1, 3, 6, 12, 24 e 36 mesi; le immagini dei follow-up a 4 e a 6 anni testimoniano la buona salute dei tessuti parodontali, l’assenza di sanguinamento al sondaggio e la completa remissione della sintomatologia (Figure 16 e 17).
Caso 3 – Dr. Bucci
Il terzo caso clinico riportato riguarda un paziente maschio di 45 anni, ASA I, che si presenta in visita per un dolore, secondario a stimoli termici, localizzato a livello del 1.3. All’esame clinico intraorale e radiografico si osserva una lesione profonda in prossimità della superficie palatale dell’elemento dentale (Figure 18 a, b e 19).
I test diagnostici rivelano la vitalità del dente. Si decide dunque di procedere a un restauro con bioceramici preservando la vitalità del dente. Previa anestesia per infiltrazione con articaina (adrenalina 1:100.000) si realizza un lembo a spessore completo, esponendo tutto il margine palatale interessato dalla lesione.
Rimosso il tessuto patologico con una fresa a rosetta, si procede con la ricostruzione dell’elemento con materiale bioceramico (Figura 20 a-c).
In questo caso, la scelta di non utilizzare la resina composita si deve a un difficile controllo dell’umidità e del sanguinamento del campo operatorio. L’intervento viene concluso con una sutura in seta; si fissano infine i controlli per il follow-up a 30, 60 e 90 giorni (Figura 21).
Caso 4 – Dr. Aiuto
Il caso clinico riguarda un giovane paziente maschio di 22 anni, ASA I, al quale viene diagnosticato un sospetto riassorbimento cervicale come reperto occasionale per un controllo radiografico in seguito a un riassorbimento avanzato della radice distale del 4.6; inoltre si può notare l’agenesia dell’elemento 4.5 e la presenza del deciduo (Figure 22 a,b).
Come nel caso precedente, data la vitalità dell’elemento dentale e la posizione sfavorevole del riassorbimento in termini di possibilità di isolamento con diga di gomma, si decide di procedere a una ricostruzione tramite l’applicazione di materiali bioceramici.
Previa anestesia tronculare con mepivacaina (senza adrenalina), si esegue un lembo a spessore totale per favorire un migliore accesso alla parete distale, viene rimosso il tessuto di granulazione, e si applica, a livello della cavità, il materiale bioceramico.
Infine si sutura la ferita chirurgica e si fissano i controlli periodici (Figure 23 e 24).
Al termine della procedura clinica, viene eseguita una radiografia endorale che dimostra il sigillo congruo della cavità.
La prognosi dell’elemento rimane comunque incerta; bisognerà valutare il grado di riassorbimento della radice distale nel tempo anche se il follow-up a 2 anni sembra incoraggiante (Figura 25).
Conclusioni
Il riassorbimento cervicale invasivo esterno rimane una sfida nella pratica clinica quotidiana: la diagnosi precoce ricopre un ruolo chiave nella prognosi e nella gestione di questo fenomeno patologico. Una volta intercettata la lesione, la CBCT rappresenta un esame radiologico di secondo livello imprescindibile per valutare l’entità del riassorbimento e guidare il clinico nell’approccio terapeutico.
La resina composita è il materiale d’elezione nel trattamento dell’EICR sempre e quando si riesca ad ottenere un buon isolamento del campo operatorio e un perfetto controllo dell’umidità. Se ciò non fosse possibile, i bioceramici parrebbero rappresentare una valida alternativa terapeutica ai più tradizionali materiali da riparazione radicolare per garantire risultatati durevoli e predicibili.
*Gli autori dichiarano che non vi è conflitto d’interesse nell’articolo.
Corrispondenza: riccardo.aiuto@unimi.it>
Riassunto
L’obiettivo di questo aggiornamento monografico è quello di fornire al clinico una serie di spunti riguardanti il tema dei riassorbimenti cervicali invasivi esterni. L’eziopatogenesi di questa patologia dentale non è ancora stata del tutto chiarita. Tra le possibili cause troviamo: occlusione, traumi, parafunzioni e sbiancamenti. La patogenesi vede nell’ordine: interruzione del legamento parodontale, reclutamento delle cellule infiammatorie, produzione di tessuto di granulazione, esposizione dentinale, formazione delle lacune di riassorbimento. L’iter diagnostico prevede: esame obiettivo, radiografia periapicale (utile ad individuare la patologia), CBCT (Cone Beam Computer Tomography); la radiologia tridimensionale permette di analizzare approfonditamente l’estensione del riassorbimento e l’interessamento di strutture del dente e tessuti circostanti. Il trattamento dell’EICR dipende da gravità, localizzazione del difetto e fattibilità del restauro dentale. La terapia prevede diversi approcci. Approccio esterno: si accede alla lesione dall’esterno, in modo non chirurgico se la localizzazione è sovracrestale o viceversa allestendo un lembo mucoperiostale. Approccio interno: si aggredisce la lesione attraverso un accesso endodontico ortogrado quando si ha un accesso localizzato al di sotto della giunzione epiteliale, di piccola entità, intraosseo con ampio coinvolgimento dell’endodonto. La necessità di una terapia canalare è secondaria all’interessamento della componente pulpare. Reimpianto intenzionale: quando gli approcci precedenti non sono praticabili per localizzazione apicale o interprossimale. In alcuni casi non è possibile trattare l’elemento interessato: in tale situazione si procederà al monitoraggio nel tempo.
La diagnosi precoce ricopre un ruolo chiave nella prognosi e nella gestione di questo fenomeno patologico e la CBCT rappresenta un esame radiologico di secondo livello imprescindibile. La resina composita è il materiale d’elezione nel trattamento dell’EICR sempre e quando si riesca ad ottenere un buon isolamento del campo. Se ciò non è possibile, i bioceramici parrebbero rappresentare una valida alternativa terapeutica.
Invasive external cervical resorption:
the state of the art
The aim of this monographic update is to provide to the clinician a series of information on the theme of external invasive cervical resorptions. The etiophtogenesis of this dental pathology is still unclear. Possible causes can be: occlusion, traumatism, parafunctions, bleaching. Pathogenetic process shows: interruption of periodontal ligament, recruiting of inflammatory cells, production of granulation tissue, dentinal exposure, resorptions’ appearance. The diagnostic process is: physical examination, periapical rx (useful to determine the pathology), CBCT (Cone Beam Computer Tomography); 3d imaging allows a detailed analisys of the resorption’s extension and the involvement of dental structures and the nearby tissues.The therapy of EICR depends on severity, location and feasibility of the restoration. There are different approaches. External approach: the access is non surgical if the lesion is sovracrestal, otherwise is performed through a mucoperiostal flap. Internal approach: the clinician arrives to the lesion through an orthograde endodontic access if the entrance is located under the epithelial junction, small, intraoxeus with large involving of the pulp. The need of a pulp therapy is mandatory if the resorption involves the pulpar tissues. Intentional reimplantation: when the former approaches aren’t feasible due to apical or interproximal location. Sometime it isn’t possible to treat the tooth: in these situations the clinitian will track the lesion through the time. Early diagnosis has a key role in prognosis and managing of this pathological phenomenon and the CBCT is a mandatory second level radiological exam. Composite resins are the election material for the treatment of EICR if there is the possibility to perform a good isolation of the surgical field. Otherwise bioceramic materials can provide a good therapeutic alternative.
- Patel S, Mavridou AM, Lambrechts P, Saberi N. External cervical resorption-part 1: histopathology, distribution and presentation. Int Endod J. 2018 Nov;51(11):1205-1223.
- Harokopakis-Hajishengallis E. Physiologic root resorption in primary teeth: molecular and histological events. J Oral Sci. 2007 Mar;49(1):1-12.
- Fuss Z, Tsesis I, Lin S. Root resorption–diagnosis, classification and treatment choices based on stimulation factors. Dent Traumatol. 2003 Aug;19(4):175-82.
- Tronstad L. Root resorption–etiology, terminology and clinical manifestations. Endod Dent Traumatol. 1988 Dec;4(6):241-52.
- Andreasen JO, Kristerson L. The effect of limited drying or removal of the periodontal ligament. Periodontal healing after replantation of mature permanent incisors in monkeys. Acta Odontol Scand. 1981;39(1):1-13.
- Galler KM, Grätz EM, Widbiller M, Buchalla W, Knüttel H. Pathophysiological mechanisms of root resorption after dental trauma: a systematic scoping review. BMC Oral Health. 2021 Mar 26;21(1):163.
- Harris DA, Jones AS, Darendeliler MA. Physical properties of root cementum: part 8. Volumetric analysis of root resorption craters after application of controlled intrusive light and heavy orthodontic forces: a microcomputed tomography scan study. Am J Orthod Dentofacial Orthop. 2006 Nov;130(5):639-47. Erratum in: Am J Orthod Dentofacial Orthop. 2007 Sep;132(3):277.
- Topkara A. External apical root resorption caused by orthodontic treatment: a review of the literature. Eur J Paediatr Dent. 2011 Sep;12(3):163-6.
- Patel S, Saberi N. The ins and outs of root resorption. Br Dent J. 2018 May 11;224(9):691-699.
- Gregorczyk-Maga I, Kaszuba M, Olszewska M, Lichołai S, Iwaniec T, Kościelniak D, Krzyściak W, Jurczak A. Biomarkers of inflammatory external root resorption as a result of traumatic dental injury to permanent teeth in children. Arch Oral Biol. 2019 Mar;99:82-91.
- Trope M (2002) Root resorption due to dental trauma. Endodontic Topics 1, 79–100.
- Gunraj MN. Dental root resorption. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1999 Dec;88(6):647-53.
- Laux M, Abbott PV, Pajarola G, Nair PN. Apical inflammatory root resorption: a correlative radiographic and histological assessment. Int Endod J. 2000 Nov;33(6):483-93.
- Mavridou AM, Bergmans L, Barendregt D, Lambrechts P. Descriptive Analysis of Factors Associated with External Cervical Resorption. J Endod. 2017 Oct;43(10):1602-1610.
- Gunst V, Mavridou A, Huybrechts B, Van Gorp G, Bergmans L, Lambrechts P. External cervical resorption: an analysis using cone beam and microfocus computed tomography and scanning electron microscopy. Int Endod J. 2013 Sep;46(9):877-87.
- Heithersay GS. Invasive cervical resorption: an analysis of potential predisposing factors. Quintessence Int. 1999 Feb;30(2):83-95.
- Iwamatsu-Kobayashi Y, Satoh-Kuriwada S, Yamamoto T, Hirata M, Toyoda J, Endo H, Kindaichi K, Komatsu M. A case of multiple idiopathic external root resorption: a 6-year follow-up study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2005 Dec;100(6):772-9.
- Patel S, Kanagasingam S, Pitt Ford T. External cervical resorption: a review. J Endod. 2009 May;35(5):616-25.
- Patel S, Foschi F, Mannocci F, Patel K. External cervical resorption: a three-dimensional classification. Int Endod J. 2018 Feb;51(2):206-214.
- Heithersay GS. Treatment of invasive cervical resorption: an analysis of results using topical application of trichloracetic acid, curettage, and restoration. Quintessence Int. 1999 Feb;30(2):96-110.
- Ne RF, Witherspoon DE, Gutmann JL. Tooth resorption. Quintessence Int. 1999 Jan;30(1):9-25.
- Lo Muzio L, Favia G, Farronato G, Piattelli A, Maiorano E. Primary gingival leiomyosarcoma. A clinicopathological study of 1 case with prolonged survival. J Clin Periodontol. 2002 Feb;29(2):182-7.
- Chen Y, Huang Y, Deng X. A Review of External Cervical Resorption. J Endod. 2021 Jun;47(6):883-894.
- Rotondi O, Waldon P, Kim SG. The Disease Process, Diagnosis and Treatment of Invasive Cervical Resorption: A Review. Dent J (Basel). 2020 Jul 1;8(3):64.
- Chen Y, Huang Y, Deng X. External cervical resorption-a review of pathogenesis and potential predisposing factors. Int J Oral Sci. 2021 Jun 10;13(1):19.
- Heithersay GS. Invasive cervical resorption following trauma. Aust Endod J. 1999 Aug;25(2):79-85.
- Mavridou AM, Hauben E, Wevers M, Schepers E, Bergmans L, Lambrechts P. Understanding External Cervical Resorption in Vital Teeth. J Endod. 2016 Dec;42(12):1737-1751.
- Deliga Schröder ÂG, Westphalen FH, Schröder JC, Fernandes Â, Westphalen VPD. Accuracy of Digital Periapical Radiography and Cone-beam Computed Tomography for Diagnosis of Natural and Simulated External Root Resorption. J Endod. 2018 Jul;44(7):1151-1158.
- Vaz de Souza D, Schirru E, Mannocci F, Foschi F, Patel S. External Cervical Resorption: A Comparison of the Diagnostic Efficacy Using 2 Different Cone-beam Computed Tomographic Units and Periapical Radiographs. J Endod. 2017 Jan;43(1):121-125.
- Patel S, Foschi F, Condon R, Pimentel T, Bhuva B. External cervical resorption: part 2 – management. Int Endod J. 2018 Nov;51(11):1224-1238.
- White C Jr, Bryant N. Combined therapy of mineral trioxide aggregate and guided tissue regeneration in the treatment of external root resorption and an associated osseous defect. J Periodontol. 2002 Dec;73(12):1517-21.
- Parirokh M, Torabinejad M. Mineral trioxide aggregate: a comprehensive literature review–Part III: Clinical applications, drawbacks, and mechanism of action. J Endod. 2010 Mar;36(3):400-13.
- Prati C, Gandolfi MG. Calcium silicate bioactive cements: Biological perspectives and clinical applications. Dent Mater. 2015 Apr;31(4):351-70.
- Guneser, M.B.; Akbulut, M.B.; Eldeniz, A.U. Effect of various endodontic irrigants on the push-out bond strength of Biodentine and conventional root perforation repair materials. J. Endod. 2013, 39, 380–384.
- Vallés M, Roig M, Duran-Sindreu F, Martínez S, Mercadé M. Color Stability of Teeth Restored with Biodentine: A 6-month In Vitro Study. J Endod. 2015 Jul;41(7):1157-60.
- Yan P, Yuan Z, Jiang H, Peng B, Bian Z. Effect of bioaggregate on differentiation of human periodontal ligament fibroblasts. Int Endod J. 2010 Dec;43(12):1116-21.
- Arnett TR. Extracellular pH regulates bone cell function. J Nutr. 2008 Feb;138(2):415S-418S.
- Gandolfi MG, Iezzi G, Piattelli A, Prati C, Scarano A. Osteoinductive potential and bone-bonding ability of ProRoot MTA, MTA Plus and Biodentine in rabbit intramedullary model: Microchemical characterization and histological analysis. Dent Mater. 2017 May;33(5):e221-e238.
- Rajasekharan S, Martens LC, Cauwels RG, Verbeeck RM. Biodentine™ material characteristics and clinical applications: a review of the literature. Eur Arch Paediatr Dent. 2014 Jun;15(3):147-58.
- Koubi S, Elmerini H, Koubi G, Tassery H, Camps J. Quantitative evaluation by glucose diffusion of microleakage in aged calcium silicate-based open-sandwich restorations. Int J Dent. 2012;2012:105863.
- Karypidou A, Chatzinikolaou ID, Kouros P, Koulaouzidou E, Economides N. Management of bilateral invasive cervical resorption lesions in maxillary incisors using a novel calcium silicate-based cement: A case report. Quintessence Int. 2016;47(8):637-42.
- Patel S, Vincer L (2017) Case report: Single visit indirect pulp cap using biodentine. Dental Update 44, 141-145.
- Shemesh A, Ben Itzhak J, Solomonov M. Minimally Invasive Treatment of Class 4 Invasive Cervical Resorption with Internal Approach: A Case Series. J Endod. 2017 Nov;43(11):1901-1908.
- Bell LA, Valluzzo TA, Garnick JJ, Pennel BM. The presence of “creeping attachment” in human gingiva. J Periodontol. 1978 Oct;49(10):513-7.
- Darcey J, Qualtrough A. Resorption: part 2. Diagnosis and management. Br Dent J. 2013 May;214(10):493-509.
- Cho SY, Lee Y, Shin SJ, Kim E, Jung IY, Friedman S, Lee SJ. Retention and Healing Outcomes after Intentional Replantation. J Endod. 2016 Jun;42(6):909-15.
- Gulsahi A, Gulsahi K, Ungor M. Invasive cervical resorption: clinical and radiological diagnosis and treatment of 3 cases. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2007 Mar;103(3):e65-72.
- Irinakis E, Aleksejuniene J, Shen Y, Haapasalo M. External Cervical Resorption: A Retrospective Case-Control Study. J Endod. 2020 Oct;46(10):1420-1427.