Il diabete mellito (DM) è una sindrome – o una serie di sindromi – derivante da un deficit assoluto o relativo di insulina (Pombo, 2003) e affligge circa 285 milioni di persone, corrispondenti al 6,4% della popolazione adulta mondiale (Montaldo et al., 2010). Sono identificati due tipi principali di diabete: il Tipo 1 è attribuibile alla distruzione di cellule isole e questo tipo di pazienti dipende dall’insulina esogena per sopravvivere; inoltre, è caratterizzato da un rapido insorgere in età giovanile dei sintomi. I pazienti con diabete di Tipo 2 non sono insulino-dipendenti; si tratta del tipo più comune di diabete (85-90%), e appare quando i tessuti aumentano la loro resistenza all’insulina o quando diminuisce la produzione pancreatica di insulina (Montaldo et al., 2010; Llambes et al., 2005; Yalda et al., 1994). Spesso è associato all’obesità e caratterizzato da un lento insorgere dei sintomi. Il diabete è stato accomunato a molte complicanze, come risultato di uno stato iperglicemico cronico, e le maggiori sono: malattie renali, retinopatia, neuropatia, malattie vascolari periferiche e malattie coronariche; il diabete è anche la causa principale di cecità e di amputazione degli arti inferiori nei paesi industrializzati (Montaldo et al., 2010; Llambes et al., 2005; Yalda et al., 1994). Tra le principali complicanze orali vi sono: perdita di denti, gengivite, parodontite, ascessi odontogeni e lesioni ai tessuti molli di lingua e mucosa.
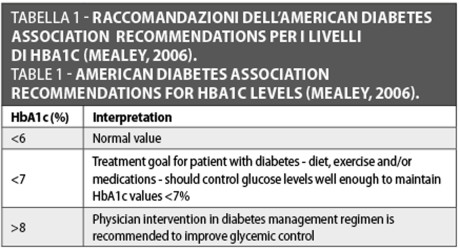
Secondo i parametri diagnostici pubblicati dall’American Diabetes Association nel 1997, e successivamente adottati dall’Organizzazione mondiale della sanità nel 1998, un paziente è diabetico se: 1) appaiono i classici sintomi di diabete e il glucosio nel sangue è uguale o maggiore a 200 mg/dl; 2) il glucosio nel sangue a digiuno è uguale o maggiore di 126 mg/dl; 3) il glucosio prost-prandiale a 2-h è uguale o maggiore a 200 mg/dl nel corso di un test di tolleranza al glucosio orale. Almeno uno dei test precedentemente menzionati deve mantenersi in ordine per confermare un caso di diabete (Llambés et al., 2005). Il test dell’emoglobina A1c (HbA1c) viene utilizzato per monitorare il controllo glicemico generale del paziente. Non è raccomandato per la diagnosi perché non è la valutazione gold standard per HbA1c e molti paesi non hanno accesso al test. In ogni caso, permette di sapere che cosa è avvenuto in questi pazienti durante gli ultimi 3 mesi (Mealey, 1996) (Tabella 1).
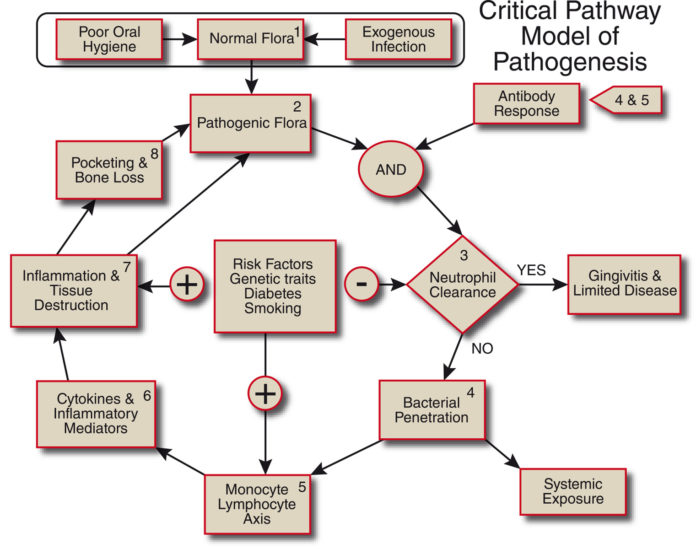
I segni e i sintomi parodontali sono riconosciuti come la “sesta complicanza del diabete mellito” (Awartani, 2009). La malattia parodontale è una malattia multifattoriale che risulta da una complessa interazione di microrganismi, ambiente e ospite (S. Offenbacher, 1996). Questa infezione interessa il parodonto e secondo Armitage (G. Armitage, 1999) deve essere classificata come: cronica o aggressiva in base al tempo di progressione; localizzata (≥30) o generalizzata (<30) in base al numero di posizioni; lieve = 1 o 2 mm di perdita di attacco clinico (CAL), moderata = 3 o 4 mm CAL, grave = ≥5 mm CAL. Dato il ruolo evidente dei microrganismi nell’eziopatogenesi della malattia, la terapia è diretta alla riduzione dei batteri (C.M. Cobb, 1996). Però vi sono alcuni fattori di rischio che modificano e aumentano l’espressione della malattia (suscettibilità genetica, fumo, diabete mellito, stress e altro ancora).
Diabete e malattia parodontale: epidemiologia
Fin dagli anni Sessanta sono state condotte ricerche per studiare il rapporto tra il diabete e la malattia parodontale, e diversi Autori hanno cercato di stabilire una relazione tra il diabete e la distruzione parodontale maggiore. Una metanalisi di quattro studi con un totale di 3524 pazienti adulti (>18 anni) ha mostrato che i soggetti diabetici corrono due volte il rischio di sviluppare la malattia parodontale rispetto ai non diabetici (P.N. Papapanou, 1996).
Chávarry et al. (2009) hanno studiato il rapporto tra il diabete mellito e la malattia parodontale distruttiva. Gli articoli selezionati sono stati pubblicati tra gennaio 1980 e giugno 2007, e sono tutti relativi a studi su uomo che investigano se il diabete rappresenti un fattore di rischio per la parodontite e quale la sua influenza sulla risposta alla terapia parodontale. Dei 2440 studi identificati, 49 studi trasversali e 8 longitudinali hanno soddisfatto i criteri di inclusione. 27 dei 49 studi trasversali che sono stati inclusi in questa revisione hanno rilevato una maggior incidenza di malattia parodontale nei soggetti diabetici rispetto a quelli non diabetici. Il rischio maggiore di progressione della malattia è stato associato al DM Tipo 2, e uno studio ha accomunato il DM con la risposta alla terapia parodontale. Gli errori metodologici della maggior parte degli studi includevano il controllo inadeguato dei co-fattori, un’analisi statistica insufficiente e la mancanza di informazioni riguardo al design della campionatura. Il modello di effetto random ha mostrato una significativa associazione con il livello di attacco clinico (differenza media = 1.00 [CI 95% = da 0.15 a 1.84]) e la profondità della tasca parodontale (differenza media = 0.46 [CI 95% = da 0.01 a 0.91]) tra diabetici di Tipo 2 e non diabetici. Essi hanno concluso che il DM Tipo 2 può essere considerato un fattore di rischio della malattia parodontale. Le stesse conclusioni riguardo a questo rapporto sono state trovate nella revisione sistematica di Salvi et al. (2008). Gli Autori hanno concluso che il diabete scarsamente controllato potrebbe essere considerato un fattori di rischio per una maggior gravità della parodontite. Nello studio controllato randomizzato di F. Awartani (2009), 74 pazienti con DM T2 e grave parodontite cronica sono stati divisi in due gruppi (HbA1c meno del 9% e HbA1c più del 9%). La conclusione di questo studio controllato randomizzato è stata che lo scarso controllo glicemico aumenta la percentuale di tartaro e il rischio di parodontite, corroborando le conclusioni della precedente metanalisi. Nel 2006, Khader et al. hanno pubblicato cuna metanalisi per valutare l’associazione tra il diabete mellito e la malattia parodontale. Essi hanno confrontato l’estensione e la gravità della malattia parodontale nei pazienti diabetici e non diabetici, misurando l’indice di placca (PI), l’indice gengivale (GI), la profondità delle tasche (PD) e il livello di attacco clinico (CAL). La conclusione è stata che il diabete ha una gravità significativamente superiore, ma la stessa estensione di malattia parodontale rispetto ai non diabetici. Però l’analisi delle ricerche pubblicate è fuorviata dall’ampia eterogeneità delle popolazioni di studio. Alcuni Autori si sono focalizzati sul diabete di Tipo 1 (De Pommereau et al., 1992; Hugoson et al., 1989; Thorstensson et al., 1993) e alcuni sul diabete di Tipo 2 (Shlossman et al. 1990; Emrich et al., 1991; Taylor et al., 1991; Morton et al., 1995; Nelson et al., 1990), mentre altri non hanno differenziato (Bacic et al., 1988; Grossi et al., 1994) o riportato il tipo di diabete. Alcuni studi sono su persone giovani (Wolf, 1977; Benveniste et al., 1967) e altri su adulti (Wolf, 1977; Finestone et al., 1967; Oliver et al., 1993; Bacic et al., 1988; Belting et al., 1964; Sandler et al., 1960; Hove et al., 1970). Anche i trattamenti del diabete applicati in questi studio variano. Nonostante ciò, al di là di queste limitazioni l’analisi di questi lavori mostra un’associazione tra malattia parodontale e diabete, indipendentemente dal tipo di diabete. Questo rapporto positivo sembra diminuire con l’aumentare dell’età, perché il fattore diabete è mascherato dal fattore età. Tutti gli Autori menzionati discutono sulle complicanze del diabete, e una di queste è la malattia parodontale. Dato che altre complicanze sono state positivamente associate al grado di controllo del diabete, sorge la domanda se la malattia parodontale abbia questo rapporto anche con il controllo metabolico. L’analisi degli studi inerenti questo argomento incontra le difficoltà sopra riportate. Quindi, seguendo lo stesso ordine di prima, i gruppi hanno studiato il Tipo 2 (Taylor et al., 1998; Sandberg et al., 2000; Ainamo et al., 1990; Unal et al., 1993; Novaes et al., 1996), il Tipo 1 (Sastrowijoto et al., 1989; Safkan-Seppala et al., 1992; De Pommermereau et al., 1992), entrambi i tipi (Oliver et al., 1993; Alpagot et al., 2001; Bacic et al., 1988) o non hanno menzionato il tipo di diabete (Hayden et al., 1998). Però, a differenza dell’analisi precedente non si può trarre una conclusione generale dall’ampia varietà di risultati e conclusioni di questi studi.
Diabete e malattia parodontale: effetto del trattamento parodontale
L’evidenza scientifica sugli effetti della malattia parodontale nel diabete è sia diretta sia indiretta. Quest’ultima concerne la risposta al trattamento parodontale nei diabetici e la sua influenza sul controllo metabolico. Gli articoli possono essere suddivisi un studi sul trattamento (Iwamoto et al., 2001; Séppala et al., 1993; Sépala et al., 1994; Miller et al., 1992; Grossi et al., 1996; Aldridge et al., 1995; Smith et al., 1996; Westfelt et al., 1996; Grossi et al., 1997; Christgau et al., 1998; Stewart et al., 2001; Al-Mubarak et al., 2002) e studi osservazionali (Taylor et al., 1996; Collin et al., 1998). Gli Autori che hanno valutato se il trattamento della parodontite o di altre infezioni della cavità orale possa migliorare il controllo glicemico nei diabeti hanno riportato risultati apparentemente contraddittori. Queste disparità possono risultare dalle differenze nel design dello studio, dal tipo di popolazione (diabetici di Tipo 1 o 2 o entrambi), dalla gravità della malattia parodontale (salute, gengivite, gradi diversi di parodontite), dalla lunghezza del periodo di studio (adeguata o no per registrare le variazioni nei livelli HbA1c), dalle variabili di studio o dal tipo di trattamento (scaling e levigatura delle radici da soli o associati ad antibiotici sistemici o locali). Tutti gli studi hanno riportato che le variabili cliniche parodontali erano migliorate dal solo trattamento meccanico i cui effetti però sul controllo metabolico nel diabete sono controversi, con alcuni Autori che non trovano alcuna influenza sulle variabili metaboliche (Aldridge et al., 1995; Smith et al., 1996; Westfelt et al., 1996; Christgau et al., 1998) e altri che riportano un miglioramento (Stewart et al., 2001; Al-Mubarak et al., 2002). Gli studi sugli effetti della combinazione di trattamento meccanico e antibiotici sul controllo metabolico hanno dimostrato un miglioramento nelle variabili metaboliche (Iwamoto et al., 2001) quando vengono somministrati antibiotici locali o sistemici (Miller et al., 1992; Grossi et al., 1996). Ci sono diverse possibili spiegazioni di questo effetto. L’antibiotico usato in questi studi era la doxiciclina, che ha effetti antimicrobici e modulatori sulla risposta dell’ospite, nonché un possibile effetto inibitorio sulla glicazione. In letteratura sembra esserci un’evidenza clinica ed epidemiologica chiara che la malattia parodontale peggiori il controllo glicemico del diabete. Però, è necessaria un’ulteriore ricerca per spiegare gli effetti del trattamento parodontale su questo controllo. Nel revisionare la letteratura, abbiamo trovato elementi ancora non correttamente provati, come l’influenza del trattamento parodontale nei pazienti diabetici. Lo scopo di questo articolo è quello di esaminare e discutere la letteratura esistente su questo particolare argomento.
Metodi
Abbiamo iniziato il nostro approccio cercando nel database Cochrane (motore di ricerca secondario) dove troviamo una metanalisi. Inoltre, abbiamo condotto una ricerca in PubMed con la combinazione di termine MeSH (Malattia parodontale e Diabete Mellito). I limiti di questa ricerca erano: metanalisi, revisioni sistematiche o studio clinico randomizzato; prestazione nell’uomo; scritto in inglese; pubblicato negli ultimi 10 anni (la ricerca è stata condotta il 22/3/2012). Dei 33 articoli trovati, ne abbiamo esclusi 6 (dopo aver letto il testo completo, dato che non rispondevano al nostro quesito “Trattamento della malattia parodontale e sua influenza sui pazienti diabetici”). Alla fine della ricerca sono stati selezionato 28 articoli dato che abbiamo manualmente introdotto una metanalisi.
Discussione
Presenteremo i risultati degli articoli selezionati in due diversi gruppi, secondo il tipo di studio: metanalisi/revisione sistematica (Tabella 2) e studi clinici randomizzati (Tabella 3).
Metanalisi e revisione sistematica
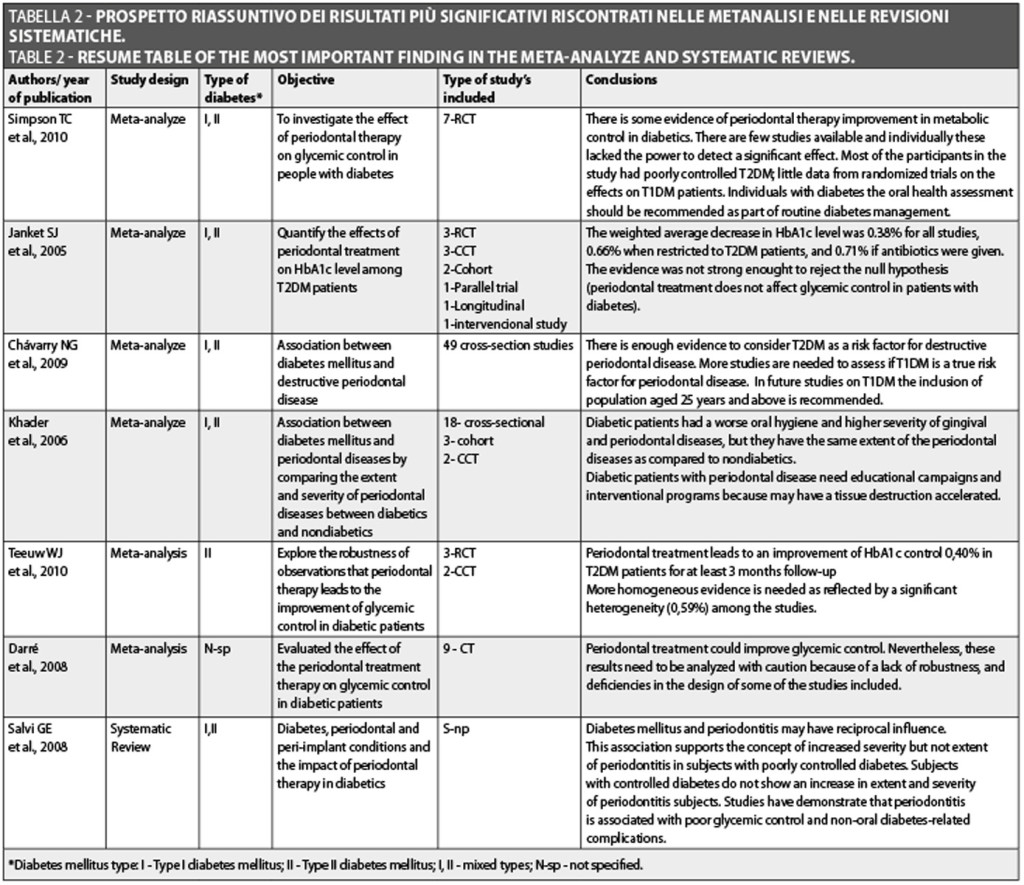
Abbiamo selezionato 4 metanalisi e 1 revisione sistematica pubblicate negli ultimi 10 anni. In tutte le metanalisi (Chávarry et al., 2009; Khader et al., 2006) e nella revisione sistematica (Salvi et al., 2008) lo scopo era quello di capire il possibile rapporto tra i pazienti diabetici e l’influenza di questa malattia sulla gravita della parodontite. Tutte queste metanalisi hanno concluso che il diabete mellito ha aumentato significativamente il fattore di rischio della gravità in pazienti con parodontite. Janket et al. (2005) hanno condotto una metanalisi di 10 studi per quantificare gli effetti del trattamento parodontale sul livello di HbA1c tra pazienti diabetici, per esplorare le possibili cause di report discrepanti e fare raccomandazioni per studi futuri. Le fonti dei dati sono state Medline (da gennaio 1980 a gennaio 2005), EBMR, Cochrane Register e le bibliografie degli articoli pubblicati. Solo tre esaminatori hanno estratto i dati inerenti l’intervento, i risultati e le dimensioni dell’effetto. In quest’analisi sono stati inclusi 456 pazienti, con trattamento parodontale come algoritmo e l’effettivo cambio di livello di emoglobina A1c come risultato. La diminuzione della media ponderata nell’effettivo livello di HbA1c era di 0.38% per tutti gli studi, 0.66% in caso di diabete di Tipo 2, 0.71% in caso di somministrazione di antibiotici. Nessun valore, però, era statisticamente significativo.
Nel 2008, Darré et al. hanno valutato l’effetto della terapia parodontale sul controllo glicemico dei pazienti diabetici. Hanno effettuato una ricerca della letteratura da sette database (Medline, Embase, Lilacs, Cochrane Library, Pascal, IADR Abstracts and Current Contents), senza restrizioni di lingua. Dei 25 studi, con 976 pazienti, solo 9 erano controllati, corrispondenti a 485 pazienti. La differenza media standardizzata in HbA(1c) con trattamento della malattia parodontale era 0.46 (95% CI: 0.11, 0.82). Questi risultati suggeriscono che il trattamento parodontale ha una riduzione significativa dello 0.79% (95% CI: 0.19, 1.40) del livello di HbA(1c). Gli Autori hanno quindi concluso che il trattamento parodontale potrebbe migliorare il controllo glicemico. Nonostante ciò, questi risultati devono essere analizzati con cautela perché mancano di robustezza e vi sono alcune carenze nel design di alcuni studi. Gli Autori suggerivano che uno studio controllato randomizzato con potenza statistica sufficiente aiuterebbe a confermare i risultati di questa metanalisi.
Teeuw et al. (2010) hanno pubblicato una metanalisi per esplorare la robustezza dell’effetto del trattamento parodontale nel miglioramento del controllo glicemico nei pazienti diabetici. Hanno utilizzato due database (Medline e Cochrane Library) con limitazione alla lingua inglese. Le pubblicazioni selezionate si basavano su tre scopi: 1) ricerche originali, 2) studi di intervento parodontale controllati con il gruppo controllo dei diabetici che non riceveva alcun trattamento parodontale, 3) durata dello studio di > o = 3 mesi. Dai 639 studi inizialmente identificati e il controllo della bibliografia, sono risultati 5 articoli adatti. In totale, in quest’analisi sono stati inclusi 371 pazienti con parodontite come algoritmo ed effettivo cambio assoluto in A1C (DeltaA1C) come risultato. La durata del follow-up era di 3-9 mesi. Tutti gli studi descrivevano una popolazione di ricerca di pazienti con diabete di tipi 2 il cui il controllo glicemico aumentava dopo la terapia parodontale rispetto al gruppo controllo (range DeltaA1C: Delta-1.17 fino a Delta-0.05%). Gli studi in una metanalisi hanno dimostrato una differenza media ponderata di DeltaA1C prima e dopo la terapia di -0.40% (95% CI: -0.77, -0.04%, P = 0.03) favorendo l’intervento in pazienti con diabete di Tipo 2. Nonostante ciò, questo miglioramento in % A1C deve essere interpretato con cura a causa della limitata robustezza come evidenziato dalla eterogeneità tra gli studi (59.5%, P = 0.04). Questi risultati hanno permesso agli Autori di concludere che il trattamento parodontale porta a un miglioramento del controllo glicemico nei pazienti con diabete di Tipo 2 per almeno 3 mesi. Nella metanalisi condotta da Simpson et al. nel 2010, l’oggetto era la valutazione dell’effetto della terapia parodontale sul controllo glicemico nei pazienti diabetici. È stata condotta una ricerca mediante database (Cochrane Oral Health Group´s Trials Register, Cochrane Library, Medline, Embase, Cinahl, Lilacs, ISI Web of Knowledge e Zetoc) associata a una ricerca manuale. Questa ricerca esaustiva ha portato a 690 studi, lettere e conferenze, ma solo 7 studi clinici randomizzati soddisfacevano i criteri di inclusione della metanalisi.
Scaling/levigatura radicolare e igiene orale (+/- terapia antibiotica) per 3/4 mesi era -0.40% (95% intervallo di confidenza (CI) effetto fisso da -0.78% a -0.01%), rappresentando una riduzione statisticamente significativa in HbA1c (P = 0.04). Quando facciamo un’analisi di sottogruppo, è possibile visualizzare che un solo studio ha un basso rischio di bias e gli altri due hanno un rischio da moderato a elevato; tenendo presenti questi elementi, i risultati dimostrano: senza aggiunta di antibiotici -0.80% (uno studio: 95% CI: -1.73%, 0.13%; P = 0.09), con aggiunta di antibiotici nel gruppo test -0.36% (uno studio: 95% CI: -0.83%, 0.11%; P = 0.14), con antibiotico nel gruppo test e nei gruppi controllo dopo 3/4 mesi -0.15% (uno studio: 95% CI: -1.04%, 0.74%; P = 0.74). Gli Autori hanno concluso che vi è una certa evidenza del fatto che la terapia parodontale migliori il controllo metabolico nei pazienti diabetici. Sono disponibili pochi studi e individualmente mancano di potenza nel rilevare un effetto significativo. La maggior parte dei partecipanti nello studio aveva un DM T2 scarsamente controllato e vi erano pochi dati da studi randomizzati sugli effetti su pazienti con DM T1. In individui con diabete mellito, si dovrebbe raccomandate la valutazione della salute orale come parte della gestione di routine del diabete.
Studi clinici randomizzati
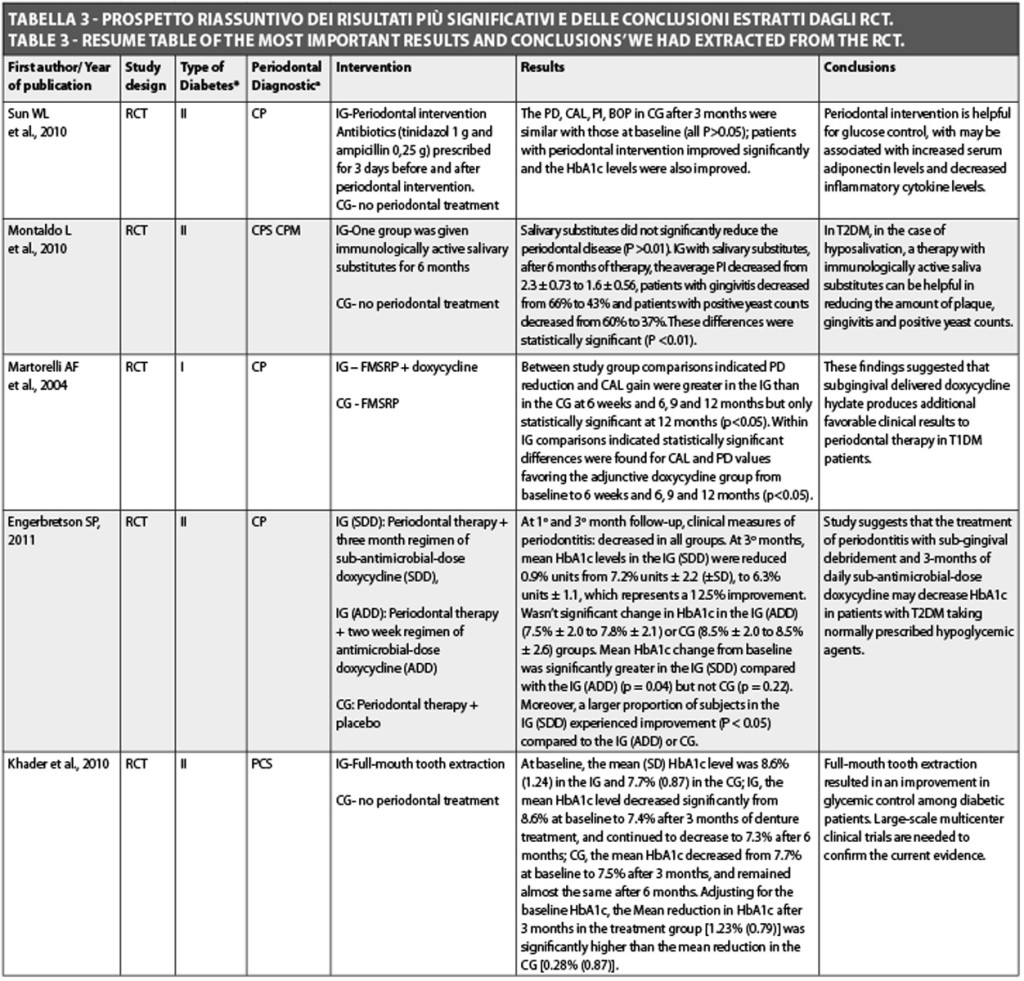
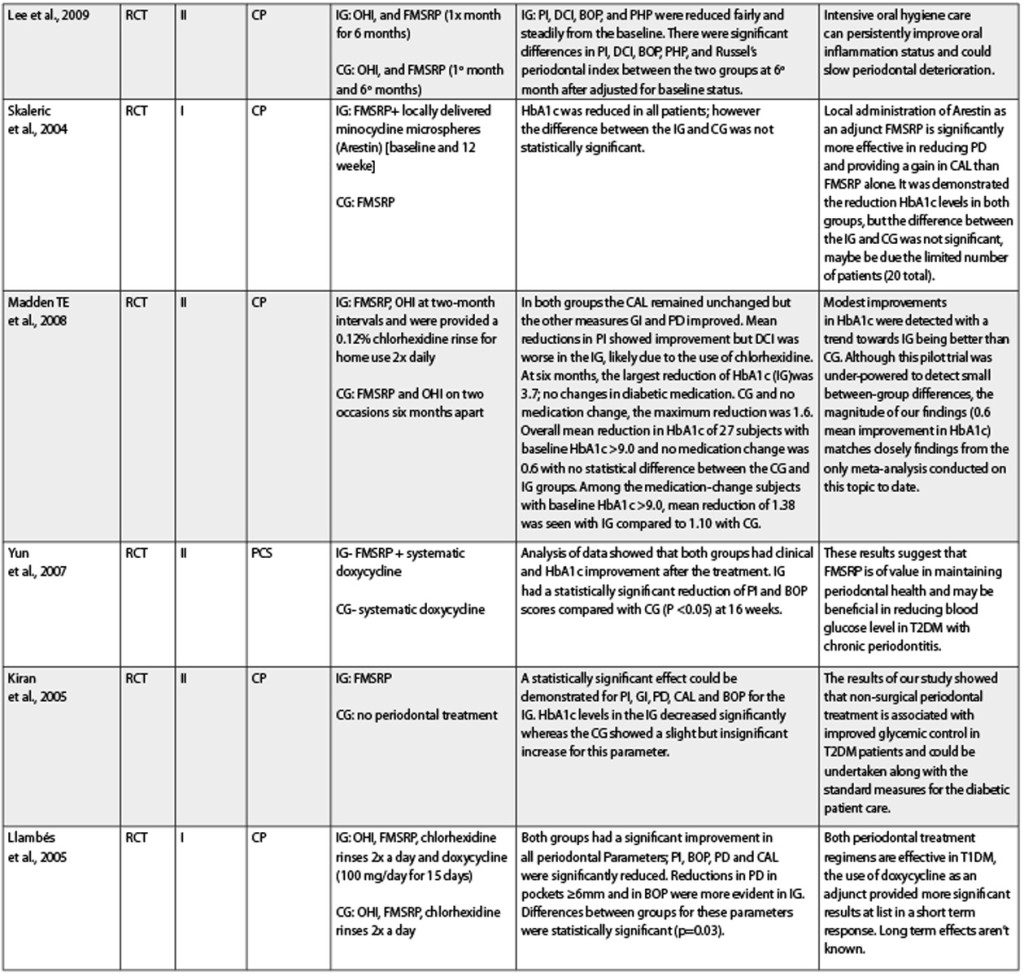
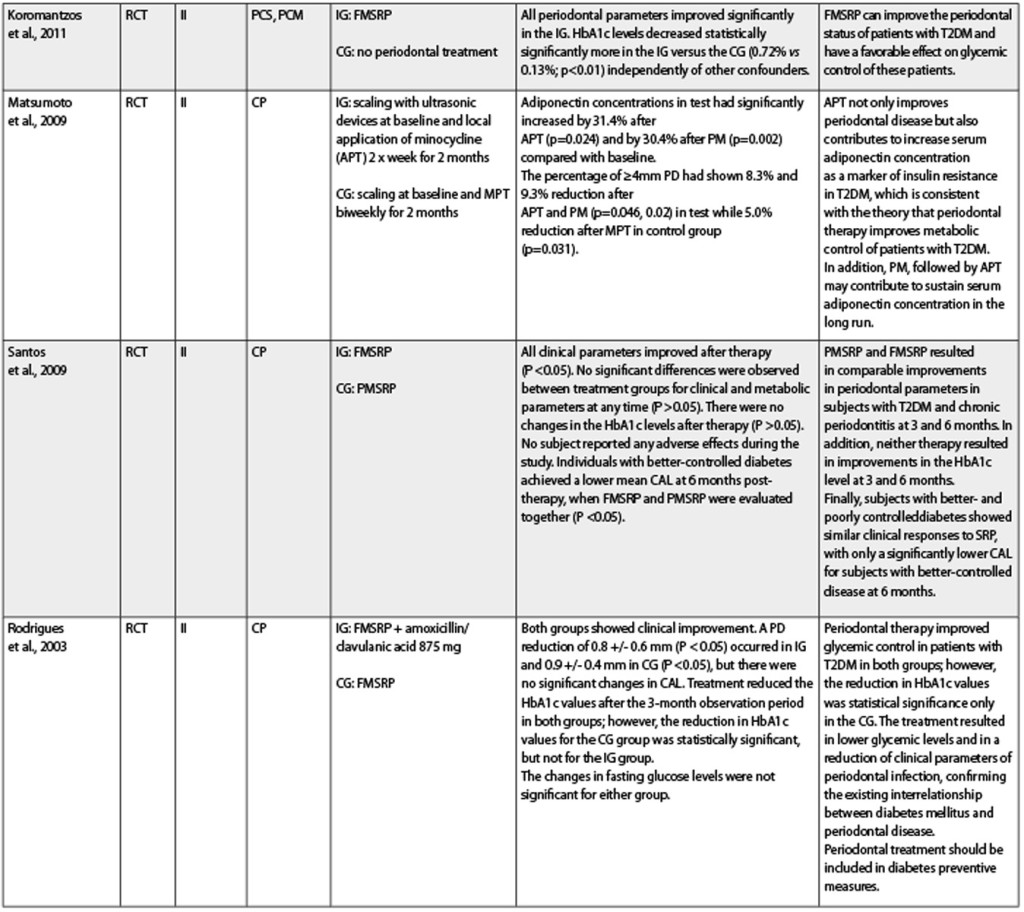
Diversi studi clinici randomizzati (Randomized Clinical Trial-RCT) nell’uomo sono stati pubblicato negli ultimi 10 anni sul possibile trattamento della malattia parodontale e la sua influenza sul controllo metabolico di HbA1c. Dopo aver analizzato gli studi clinici randomizzati e il tipo di popolazione diabetica, è stato possibile rilevare che la maggior parte dei lavori è stata condotta nella popolazione DM T2 (Sun et al., 2010; Montaldo et al., 2010; Engerbretson et al., 2011; Khader et al., 2010; Lee et al., 2009; Madden et al., 2008; Yun et al., 2007; Kiran et al., 2005; Koromantzos et al., 2011; Matsumoto et al., 2009; Santos et al., 2009; Rodrigues et al., 2003; Al-Zahrani et al., 2009; Sun et al., 2011), 4 RCT nella popolazione DM T1 (Martorelli et al., 2004; Skaleric et al., 2004; Llambés et al., 2005; Llambes et al., 2008). Quando si analizzano gli RCT in base alla diagnostica parodontale, si può concludere che tutti includevano una popolazione con parodontite cronica, ma solo pochi RCT informavano riguardo alla gravità della diagnosi parodontale (Montaldo et al., 2010; Khader et al., 2010; Yun et al., 2007; Koromantzos et al., 2011; Al-Zahrani et al., 2009; Sun et al., 2011). Khader et al. (2010) hanno condotto un RCT per studiare l’effetto dell’estrazione dentale totale sul controllo glicemico nei pazienti DM T2. È stata fatta una suddivisione dei campione in 2 gruppi: 29 pazienti senza trattamento parodontale e 29 con estrazione dentale totale. I risultati evidenziano una riduzione significativamente superiore in HbA1c nel gruppo di trattamento [1.23% (0.79)] rispetto al gruppo controllo [0,28% (0.79)]. Essi hanno concluso che l’estrazione dentale totale ha portato a un miglioramento del controllo glicemico nei pazienti DM T2. Però, sono necessari studi clinici multicentrici su ampia scala per confermare questa evidenza clinica. Nel 2009 Lee et al. hanno pubblicato un RCT che aveva come obiettivo principale quello di osservare gli effetti dell’igiene orale professionale in DM T2. Al fine di raggiungere questo obiettivo, essi hanno suddiviso il campione in 2 gruppi, il gruppo test (n=40) veniva trattato con scaling e levigatura radicolare di entrambe le arcate, più istruzioni orali una volta al mese, e il gruppo controllo (n=35) veniva trattato con scaling e levigatura radicolare di entrambe le arcate, più istruzioni orali a 1 e a 6 mesi. Essi hanno riportato differenze significative in PI, DCI, BOP, PHP e indice parodontale di Russel tra i due gruppi sei mesi dopo il trattamento e dopo aver modificato lo stato di baseline. Questi risultati suggeriscono che un’intensa igiene orale può migliorare in modo persistente lo stato di infiammazione orale e potrebbe diminuire il peggioramento parodontale. Le stesse conclusioni sugli effetti dello scaling e della levigatura radicolare di entrambe le arcate nel controllo glicemico di DM T2 sono state rilevate nell’RCT di Kiran et al. (2005); Koromantzos et al. Nel 2011 hanno concluso che il trattamento parodontale non chirurgico si associa a un miglioramento del controllo glicemico nel pazienti DM T2.
Santos et al. (2009) hanno condotto un RCT per confrontare lo scaling e la levigatura radicolare di entrambe le arcate (gruppo intervento: 18 pazienti) vs lo scaling e la levigatura radicolare parziale (gruppo intervento: 18 pazienti) e il suo impatto sullo stato glicemico della risposta clinica e metabolica in DM T2. Le conclusioni evidenziano che nessuna delle terapie ha portato un miglioramento del livello di HbA1c a 3 e a 6 mesi.
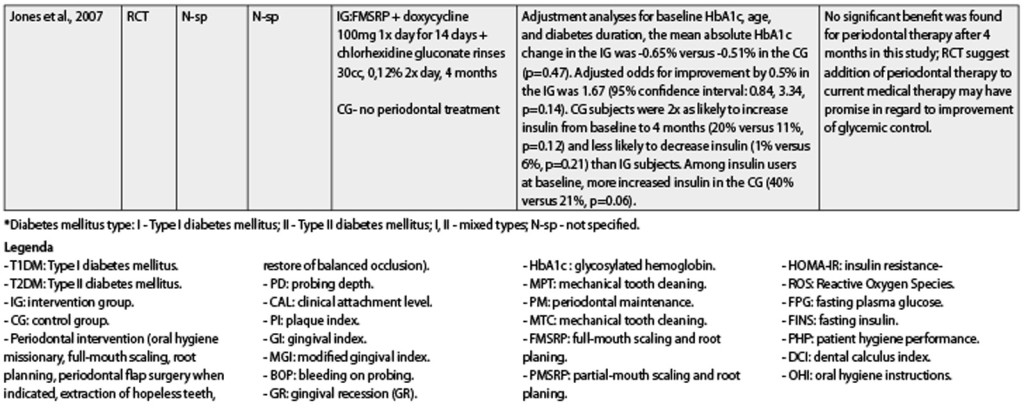
Nello studio condotto da Madden et al. (2008) i pazienti sono stati trattati con scaling e levigatura radicolare di entrambe le arcate e sono state implementate istruzioni orali nel gruppo intervento con sciacqui di clorexidina (CHX) 2 volte al giorno. Essi hanno riportato le stesse conclusioni pubblicate da Lee et al., con risultati migliori per CHX con una differenza in media di 0,6 per HbA1c. Ci sono alcuni RCT (Sun et al., 2011; Martorelli et al., 2004; Skaleric et al., 2004; Yun et al., 2007; Matsumoto et al., 2009; Rodrigues et al., 2003; Sun et al., 2011) che includono la terapia antibiotica nel trattamento della malattia parodontale.
La somministrazione di antibiotici è combinata con l’intervento parodontale (igiene orale missionaria, scaling full-mouth, levigatura radicolare, chirurgia parodontale a lembo quando indicata, estrazione di denti irrimediabilmente compromessi, ripristino dell’occlusione bilanciata) o solo con scaling e levigatura radicolare di entrambe le arcate. Alcuni studi (Llambés et al., 2005 e 2008; Jones et al., 2007) contemplano anche questa terapia con sciacqui di clorexidina due volte al giorno. Si è anche osservata una grande eterogeneità negli antibiotici utilizzati (tinidazolo, ampicillina, amoxicillina, doxiciclina, Arestin, minociclina, ampicillina) e nel modo di somministrazione (sistemica o locale). Nonostante ciò, al di là di queste limitazioni, l’analisi di questi studi per DM T2 mostra che dopo l’intervento parodontale nel sondaggio di profondità delle tasche il livello di attacco clinico, il sanguinamento al sondaggio, l’indice di placca e i livelli di HbA1c erano migliorati. Nell’RCT condotto da Rodrigues et al.
Nel 2003 la riduzione di HbA1c è stata statisticamente significativa solo nel gruppo controllo (scaling e levigatura radicolare di entrambe le arcate). Il solo RCT che ha confrontato la terapia antibiotica (doxiciclina) vs lo scaling e la levigatura radicolare di entrambe le arcate combinati con terapia antibiotica (doxiciclina) è quello di Yun et al. (2007). Gli Autori hanno suggerito che lo scaling e la levigatura radicolare di entrambe le arcate avevano un grande valore per il mantenimento della salute parodontale, probabilmente come conseguenza di una diminuzione dei livelli di glucosio nel sangue. Le conclusioni di Sun et al. (2010 e 2011) associano questo miglior controllo a un aumento dei livelli di adiponectina nel siero e a una diminuzione dei livelli infiammatori di citochine che aiutano a ristabilire la sensibilità all’insulina, migliorando così il controllo glicemico. Al fine di osservare altre alternative di trattamento, Montaldo et al. (2010) hanno dato sostituti salivari a pazienti DM T2 con iposalivazione e hanno osservato una riduzione della quantità di placca, gengivite e conta positiva dei lieviti. Almubarak et al. nel 2002 hanno cercato di completare lo scaling e la levigatura radicolare di entrambe le arcate con irrigazione subgingivale due volte al giorno e hanno concluso che questa procedura può determinare un parodonto più sano nei pazienti DM T1 o DM T2. Un’altra alternativa sperimentata da Al-Zahrani et al. nel 2009 è stata la terapia fotodinamica in un RCT. Si è concluso che questa terapia non è di beneficio a quella convenzionale parodontale non chirurgica in pazienti DM T2. Dopo aver analizzato i risultati per DM T1, possiamo concludere che sono controversi. Alcuni articoli hanno mostrato un effetto positivo della terapia antibiotica (Martorelli et al., 2004; Llambés et al., 2005) e altri no (Skaleric et al., 2004; Llambes et al., 2008). La causa per DM T1 potrebbe essere il numero limitato di pazienti che compongono i campioni o il diverso comportamento metabolico dopo il trattamento parodontale.
Conclusioni
È stato possibile verificare un effetto positivo dell’intervento parodontale in DM T2 e nella diminuzione di HbA1c. Vi sono pochi studi disponibili su DM T1 e quelli esistenti hanno un numero limitato di pazienti e nessuna possibilità statistica di rilevare effetti significativi e quindi le conclusioni sono dubbie. Sono necessari ulteriori studi per raggiungere una conclusione.
Corrispondenza/Correspondence
Ricardo Faria-Almeida
Campo 24 Agosto, 129 – 4 andar, sala 416
4300-100 Porto
Portugal
Ricardo Faria-Almeida1
Francisco Correia2
Mónica Morado-Pinho3
1Professore Associato, Dipartimento di Chirurgia Orale e Medicina, Università di Porto, Portogallo
2Studente di Chirurgia Orale, Università di Porto, Portogallo
3Professore-assistente Dipartimento di Parodontologia, Università Fernando Pessoa, Porto, Portogallo
– Montaldo L, Montaldo P, Papa A, Caramico N, Toro G. Effects of saliva substitutes on oral status in patients with Type 2 diabetes. Diabet Med 2010 Nov;27(11):1280-3. – Llambés F, Silvestre FJ, Hernández-Mijares A, Guiha R, Caffesse R. Effect of non-surgical periodontal treatment with or without doxycycline on the periodontium of type 1 diabetic patients. J Clin Periodontol 2005 Aug;32(8):915-20. – Yalda B, Offenbacher S, Collins JG. Diabetes as a modifier of periodontal disease expression. Periodontol 2000 1994 Oct;6:37-49. Mealey B. Periodontal implications: Medically compromised patients. Annals of Periodontology 1996;1:256-61. – Awartani F. Evaluation of the relationship between type 2 diabetes and periodontal disease. Odontostomatol Trop 2009 Dec;32(128):33-9. – Offenbacher S. Periodontal diseases: pathogenesis. Ann Periodontol 1996 Nov;1(1):821-78. – Armitage GC. Development of a classification system for periodontal diseases and condition. Ann Periodontol 1999;4(1):1-6. – Cobb CM. Non-surgical pocket therapy: mechanical. Ann Periodontol 1996 Nov;1(1):443-90. – Papapanou PN. Periodontal Diseases: Epidemiology. Ann Periodontol 1996;1:1-36. – Chávarry NG, Vettore MV, Sansone C, Sheiham A. The relationship between diabetes mellitus and destructive periodontal disease: a meta-analysis. Oral Health Prev Dent 2009;7(2):107-27. – Salvi GE, Carollo-Bittel B, Lang NP. Effects of diabetes mellitus on periodontal and peri-implant conditions: update onassociations and risks. J Clin Periodontol 2008 Sep;35(8 Suppl):398-409. – Khader YS, Dauod AS, El-Qaderi SS, Alkafajei A, Batayha WQ. Periodontal status of diabetics compared with nondiabetics: a meta-analysis. J Diabetes Complications 2006 Jan-Feb;20(1):59-68. – De Pommereau V, Dargent-Paré C, Robert JJ, Brion M. Periodontal status in insulin-dependent diabetic adolescents. Jounal of Clinical Periodontology 1992;19:628-32. – Hugoson A, Thorstensson H, Falk H, Kuylenstierna J. Periodontal conditions in insulin-dependent diabetics. Journal of Clinical Periodontology 1989:16:215-23. – Thorstensson H, Hugoson A. Periodontal disease experience in adult long-duration insulin-dependent diabetics. Journal of Clinical Periodontology 1993;20:352-8. – Shlossman M, Knowler WC, Pettitt DJ, Genco RJ. Type 2 diabetes mellitus and periodontal disease. Journal of American Dental Association 1990;121:532-6. – Emrich LJ, Shlossman M, Genco RJ. Periodontal disease in non-insulin-dependent diabetes mellitus. J Periodontology 1991;62:23-30. – Taylor GW, Burt BA, Becker MP. Non-insulin dependent diabetes mellitus and alveolar bone loss progression over 2 years. J. Periodontol 1998;69:76-83. – Morton A, Williams RW, Watts LP. Initial study of periodontal status in non-insulin-dependent diabetics in Mauritius. Journal of Dentistry 1995;23:343-5. – Nelson RG, Shlossman M, Budding LM. Periodontal disease and NIDDM in Pima Indians. Diabetes Care 1990;13:836-40. – Bacic M, Plancak D, Granic M. CPITN assessment of periodontal disease in diabetics patients. Journal of Periodontology 1988;59:816-22. – Grossi SG, Zambon JJ, Ho AW. Assessment of risk for periodontal disease. I. Risk indicators for attachment loss. Journal Periodontology 1994;65:260-7. – Wolf J. Dental and periodontal conditions in diabetes mellitus. A clinical and radiographic study. Proc Finn Dent Society 1977;73(4-6supll.):1-56. – Benveniste R, Bixler D, Conneally PM. Periodontal disease in diabetics. Journal of Periodontology 1967;38:271-9. – Finestone AJ, Boorujy SR. Diabetes mellitus and periodontal disease. Diabetes 1967;16:336-40. – Oliver RC, Tervonen T. Periodontits and tooth loss: comparing diabetics with general population. Journal of American Dental Association 1993;124(12):71-6. – Belting CM, Hiniker JJ, Dummett CO. Influence of diabetes mellitus on the severity of periodontal disease. Journal of Periodontology 1964;35:476-80. – Sandler HC, Stahl SS. Prevalence of periodontal disease in a hospitalised population. Journal Dent Res 1960;39:439-49. – Hove KA, Stallard RE. Diabetes and the periodontal patient. Journal of Periodontology 1970;41:713-8. – Taylor GW, Burt BA, Becker MP, Genco RJ, Shlossman M. Glycemic control and alveolar bone loss progression in Type 2 diabetes. Ann Periodontology 1998;3:30-9. – Sandberg GE, Sundberg HE, Fjellstrom CA, Wikblad KF. Type 2 diabetes and oral health. A comparison between diabetic and non-diabetic subjects. Diabetes Res Clin Pract 2000;50:27-34. – Ainamo J, Lahtinen A, Uitto V-J. Rapid periodontal destruccions in adult humans with poorly controlled diabetes. A report of 2 cases. Journal of Clinical Periodontology 1990;17:22-8. – Unal T, Firatli E, Sivas A, Meric H, Oz H. Fructosamine as a possible monitoring parameter in non-insulin dependent diabetes mellitus patients with periodontal disease. Journal of Periodontology 1993;64:191-4. – Novaes AB Jr, Gutierrez FG, Novaes AB. Periodontal disease progression in type II non-insulin-dependent diabetes mellitus patients (NIDDM). Part I – Probing pocket depth and clinical attachement. Braz Dent 1996;7:65-73. – Sastrowijoto SH, Hillemans P, vanSteenbergen TJM, Abraham-Inpijn L, de Graaff J. Periodontal condition and microbiology of healthy and disease periodontal pockets in Type 1 diabetes mellitus patients. Journal of Clinical Periodontology 1989;16;316-22. – Safkan-Seppälä B, Ainamo J. Periodontal conditions in insulin-dependent diabetes mellitus. Journal of Clinical Periodontology 1992;19:24-9. – Oliver R, Tellervo T, Flynn DG, Keenan KM. Enzyme activity in crevicular fluid in relation to metabolic control of diabetes and other periodontal risk factors. Journal of Periodontology 1993;64;358-62. – Alpagot T, Silverman S, Lundergan W, Bell C, Chambers DW. Crevicular fluid eleastase levels in relation to periodontitis and metabolic control of diabetes. Journal Periodontal Research 2001;36:169-74. – Hayden P, Buckley LA. Diabetes mellitus and periodontal disease in an Irish population. Journal Periodontal Research 1998;24:298-302. – Iwamoto Y, Nishimura F, Nakagawa M, Sugimoto H, Shikata K, Makino H, Fukuda T, Tsuji T, Iwamoto M, Murayama Y. The effect of antimicrobial periodontal treatment on circulating tumor necrosis factor-alpha and glycated hemoglobin level in patients with type 2 diabetes. Journal of Periodontology 2001;72:774-8. – Seppäla B, Sepäpla M, Ainamo J. A longitudinal study on insulin-dependent diabetes mellitus. Journal of Clinical Periodontology 1993;20:161-5. – Seppäla B, Ainamo J. A site-by-site follow-up study on the effect of controlled versus poorly controlled insulin-dependent diabetes mellitus. Journal of Clinical Periodontology 1994;21:161-5. – Miller LS, Manwell MA, Newbold D. The relationship between reduction in periodontal inflamation and diabetes control: A report of 9 cases. Journal Periodontology 1992;63:843-8. – Grossi SG, Skrepcinski FB, DeCaro T, Zambon JJ, Cummins D, Genco RJ. Response to periodontal therapy in diabetes and smokers. Journal of Periodontology 1996;67:1094-1102. – Aldridge JP, Lester V, Watts TLP, Collins A, Viberti G, Wilson RF. Single-blind studies of the effects of improved periodontal health on metabolic control in type 1 diabetes mellitus. Journal of Clinical Periodontology 1995;22:271-5. – Smith GT, Greenbaum CJ, Johnson BD, Persson GR. Short-term responses to periodontal therapy in insulin-dependent diabetic patients. Journal of Periodontology 1996;67:764-802. – Westfelt E, Rylander H, Blohmé G, Jonasson P, Lindhe J. The effects of periodontal therapy in diabetics. Results after 5 years. Journal of Clinical Periodontology 1996;23:92-100. – Grossi SG, Skrepcinski FB, DeCaro T. Treatment of periodontal disease in diabetics reduces glycated hemoglobin. Journal of Periodontology 1997;68:713-9. – Christgau M, Palitzsch KD, Schmalz G, Kreiner U, Frenzel S. Healing response to non-surgical periodontal therapy in patients with diabetes mellitus: clinical, microbiological and immunologic results. Journal of Clinical Periodontology 1998;25:112-24. – Stewart JE, Wager KA, Friedlander AH, Zadeh HH. The effect of periodontal treatment on glicemic control in patients with type 2 diabetes mellitus. Journal of Clinical Periodontology 2001;28:306-10. – Al-Mubarak S, Ciancio S, Aljada A, Awa H, Hamouda W, Ghanim H, Zambon J, Boardman TJ, Mohanty P, Ross C, Dandona P. Comparative evaluation of adjunctive oral irrigation in diabetics. Journal of Clinical Periodontology 2002;29:295-300. – Taylor GW, Burt BA, Becker MP. Severe periodontitis and risk for poor glicemic control in patients with non-insulin-dependent diabetes mellitus. Journal of Periodontology 1996;67:1085-93. – Collin HL, Uusitupa M, Niskanen L, Kontturi-Närhi V, Markkanen H, Koivisto A, Meurman JH. Periodontal findings in elderly patients with non-insulin dependent diabetes mellitus. Journal of Periodontology 1998;69:962-6. – Stewart JE, Wager KA, Friedlander AH, Zadeh HH. The effect of periodontal treatment on glicemic control in patients with type 2 diabetes mellitus. Journal of Clinical Periodontology 2001;28:306-10. – Al-Mubarak S, Ciancio S, Aljada A, Mohanty P, Ross C, Dandona P. Comparative evaluation of adjunctive oral irrigation in diabetics. J Clin Periodontol 2002 Apr;29(4):295-300. – Janket SJ, Wightman A, Baird AE, Van Dyke TE, Jones JA. Does periodontal treatment improve glycemic control in diabetic patients? A metaanalysis of intervention studies. J Dent Res 2005 Dec;84(12):1154-9. – Darré L, Vergnes JN, Gourdy P, Sixou M. Efficacy of periodontal treatment on glycaemic control in diabetic patients: a meta-analysis of interventional studies. Diabetes Metab 2008 Nov;34(5):497-506. – Teeuw WJ, Gerdes VE, Loos BG. Effect of periodontal treatment on glycemic control of diabetic patients: a systematic review and meta-analysis. Diabetes Care 2010 Feb;33(2):421-7. – Simpson TC, Needleman I, Wild SH, Moles DR, Mills EJ. Treatment of periodontal disease for glycaemic control in people with diabetes. Cochrane Database Syst Rev 2010 May 12;(5). – Sun WL, Chen LL, Zhang SZ, Ren YZ, Qin GM. Changes of adiponectin and inflammatory cytokines after periodontal intervention in type 2 diabetes patients with periodontitis. Arch Oral Biol 2010 Dec;55(12):970-4. – Engebretson SP, Hey-Hadavi J. Sub-antimicrobial doxycycline for periodontitis reduces hemoglobin A1c in subjects with type 2 diabetes: a pilot study. Pharmacol Res 2011 Dec;64(6):624-9. – Khader YS, Al Habashneh R, Al Malalheh M, Bataineh A. The effect of full-mouth tooth extraction on glycemic control among patients with type 2 diabetes requiring extraction of all remaining teeth: a randomized clinical trial. J Periodontal Res 2010 Dec;45(6):741-7. – Lee HK, Choi SH, Won KC, Merchant AT, Song KB, Jeong SH, Lee SK, Choi YH. The effect of intensive oral hygiene care on gingivitis and periodontal destruction in type 2 diabetic patients. Yonsei Med J 2009 Aug 31;50(4):529-36. – Madden TE, Herriges B, Boyd LD, Laughlin G, Chiodo G, Rosenstein D. Alterations in HbA1c following minimal or enhanced non-surgical, non-antibiotic treatment of gingivitis or mild periodontitis in type 2 diabetic patients: a pilot trial. J Contemp Dent Pract 2008;9(5):9-16. – Yun F, Firkova EI, Jun-Qi L, Xun H. Effect of non-surgical periodontal therapy on patients with type 2 diabetes mellitus. Folia Med (Plovdiv) 2007;49(1-2):32-6. Kiran M, Arpak N, Unsal E, Erdogan MF. The effect of improved periodontal health on metabolic control in type 2 diabetesmellitus. J Clin Periodontol 2005 Mar;32(3):266-72. – Koromantzos PA, Makrilakis K, Dereka X, Katsilambros N, Vrotsos IA, Madianos PN. A randomized, controlled trial on the effect of non-surgical periodontal therapy in patients with type 2 diabetes. Part I: effect on periodontal status and glycaemic control. J Clin Periodontol 2011 Feb;38(2):142-7. – Matsumoto S, Ogawa H, Soda S, Hirayama S, Amarasena N, Aizawa Y, Miyazaki H. Effect of antimicrobial periodontal treatment and maintenance on serum adiponectin in type 2 diabetes mellitus. J Clin Periodontol 2009 Feb;36(2):142-8. – Santos VR, Lima JA, De Mendonça AC, Braz Maximo MB, Faveri M, Duarte PM. Effectiveness of full-mouth and partial-mouth scaling and root planing in treating chronic periodontitis in subjects with type 2 diabetes. J Periodontol 2009 Aug;80(8):1237-45. – Rodrigues DC, Taba MJ, Novaes AB, Souza SL, Grisi MF. Effect of non-surgical periodontal therapy on glycemic control in patients with type 2 diabetes mellitus. J Periodontol 2003 Sep;74(9):1361-7. – Al-Zahrani MS, Bamshmous SO, Alhassani AA, Al-Sherbini MM. Short-term effects of photodynamic therapy on periodontal status and glycemic control of patients with diabetes. J Periodontol 2009 Oct;80(10):1568-73. – Sun WL, Chen LL, Zhang SZ, Wu YM, Ren YZ, Qin GM. Inflammatory cytokines, adiponectin, insulin resistance and metabolic control after periodontal intervention in patients with type 2 diabetes and chronic periodontitis. Intern Med 2011;50(15):1569-74. – Martorelli de Lima AF, Cury CC, Palioto DB, Duro AM, da Silva RC, Wolff LF. Therapy with adjunctive doxycycline local delivery in patients with type 1 diabetes mellitus and periodontitis. J Clin Periodontol 2004 Aug;31(8):648-53. – Skaleric U, Schara R, Medvescek M, Hanlon A, Doherty F, Lessem J. Periodontal treatment by Arestin and its effects on glycemic control in type 1 diabetes patients. J Int Acad Periodontol 2004 Oct;6(4 Suppl):160-5. – Llambés F, Silvestre FJ, Hernández-Mijares A, Guiha R, Caffesse R. Effect of non-surgical periodontal treatment with or without doxycycline on the periodontium of type 1 diabetic patients. J Clin Periodontol 2005 Aug;32(8):915-20. – Llambés F, Silvestre FJ, Hernández-Mijares A, Guiha R, Caffesse R. The effect of periodontal treatment on metabolic control of type 1 diabetes mellitus. Clin Oral Investig 2008 Dec;12(4):337-43. – Jones JA, Miller DR, Wehler CJ, Rich SE, Krall-Kaye EA, McCoy LC, Christiansen CL, Rothendler JA, Garcia RI. Does periodontal care improve glycemic control? The Department of Veterans Affairs Dental Diabetes Study. J Clin Periodontol 2007 Jan;34(1):46-52.