I materiali dentali bioattivi utilizzati per la remineralizzazione del tessuto dentinale dovrebbero essere in grado di indurre la formazione di idrossiapatite. Lo scopo di questo studio è quello di presentare una serie di esperimenti condotti per valutare la capacità dei Bioglass di remineralizzare il tessuto dentinale demineralizzato. Trentasei dischi (36) di dentina ottenuti da molari recentemente estratti per motivi parodontali e chirurgici sono stati totalmente demineralizzati mediante immersione in una soluzione di acido citrico per 72 ore sotto costante agitazione. I campioni sono stati abbondantemente risciacquati con acqua deionizzata e immediatamente trattati con polveri di Bioglass o allumina (controllo) e immersi in una soluzione salina (PBS) per 72 ore a una temperatura di 37 °C. I test per la valutazione della remineralizzazione sono stati effettuati tramite l’ausilio di uno spettroscopio confocale micro-Raman, microscopio laser confocale e SEM equipaggiato con un dispositivo analitico che sfrutta l’emissione di raggi X generati da un fascio elettronico accelerato incidente sul campione (EDX). I risultati di questo studio hanno mostrato come le superfici dentinali sottoposte a demineralizzione totale fossero caratterizzate da tubuli dentinali esposti e bassissima presenza di composti di calcio e fosfati. Al contrario, i dischi di dentina demineralizzati trattati con Bioglass e immersi in soluzione salina mostravano la ricomparsa di calcio-fosfati e idrossiapatite (HCA) sulla superficie dentinale. In conclusione, è possibile affermare che l’uso del Bioglass favorisce la remineralizzazione della dentina e potrebbe essere il punto di partenza per un’odontoiatria conservativa basata sul principio della riparazione e remineralizzazione dei tessuti duri dentali.
Parole chiave: calcio/sodio fosfo-fillosilicati (Bioglass 45S5), remineralizzazione dentinale, micro-Raman, SEM-EDX, CLSM
I materiali dentali bioattivi utilizzati per la remineralizzazione del tessuto dentinale dovrebbero essere in grado di indurre la formazione di idrossiapatite (HA) all’interno del network di collagene dentinale demineralizzato e nei tubuli dentinali1,2. I processi di mineralizzazione possono verificarsi in seguito all’interazione tra materiali bioattivi, saliva o/e fluido dentinale intratubulare. Quest’ultimo risulta molto importante perché simile ai liquidi extracellulari e, in collaborazione con gli odontoblasti, contribuisce ai processi di mineralizzazione dentinale3-5. Attualmente, esiste una scarsa evidenza scientifica sul concetto di remineralizzazione dentinale in relazione alle procedure di odontoiatria conservativa. In realtà questo concetto si potrebbe applicare alla pratica clinica se materiali altamente bioattivi, con spiccate caratteristiche di induzione alla remineralizzazione dei tessuti duri, venissero presi in maggior considerazione durante le procedure operative. I Bioglass 45S5 sono dei vetri bioattivi costituiti principalmente da calcio-sodio fosfo-fillosilicati in grado di reagire con i fluidi corporei e favorire la formazione di idrossiapatite6-9. Questi vetri bioattivi (Bioglass) possono essere utilizzati in odontoiatria come sostituti alle polveri di allumina nei sistemi di “air-cutting”, in alternativa alle tradizionali turbine, nella rimozione dei tessuti duri dentali. I sistemi di air-cutting utilizzano un getto di aria ad alta pressione (3-5 bar) che permette alle polveri abrasive di rimuovere smalto, dentina e preparare cavità per i materiali da restauro. L’uso clinico dei Bioglass e dei sistemi di air-cutting presenta molti vantaggi tra cui l’assenza di dolore nei pazienti durante le procedure cliniche applicative, la rimozione selettiva di dentina cariata e la possibilità di preparare cavità più arrotondate che riducono al minimo gli stress da contrazione dei compositi10,11. Lo scopo di questo studio è quello di presentare una serie di esperimenti condotti per valutare la capacità dei Bioglass di remineralizzare il tessuto dentinale demineralizzato. L’ipotesi nulla di questo studio è che le polveri per sistemi di air-cutting utilizzate sono ugualmente in grado di remineralizzare il tessuto dentinale dopo immersione in soluzione salina (PBS).
MATERIALI E METODI
Spettroscopia Raman confocale
Trentasei (36) dischi di dentina (0,5±0,1 mm) ottenuti da molari recentemente estratti per motivi parodontali e chirurgici sono stati totalmente demineralizzati mediante immersione in una soluzione di acido citrico [0.02M – pH 3.5] per 72 ore sotto costante agitazione (120 rpm/s) a ~22 °C. I campioni sono stati abbondantemente risciacquati con acqua deionizzata. Dal momento che l’intento di questo studio era esclusivamente la valutazione della remineralizzazione della dentina e vista la natura estremamente delicata di quella demineralizza, le polveri utilizzate sono state applicate sui campioni con un pennello a pelo di cammello per circa 1 minuto. I campioni sono stati, infine, delicatamente puliti con garze sterili al fine di garantire la rimozione del prodotto in eccesso. Un terzo dei campioni (N=12) è stato conservato in acqua deionizzata, mentre gli altri campioni dentinali destinati alla remineralizzazione sono stati trattati con Bioglass 45S5 (SYLC, OSspray Ltd, London, UK) (n=12), o allumina (JET-Fresh, DENTSPLY Corp., London, UK) (n=12) e immersi in una soluzione salina (PBS) per 72 ore a una temperature di 37 °C. La composizione della soluzione salina (in g/l) utilizzata in questo studio era: CaCl2 (0,103), MgCl2. 6h20 (0,019), KH2PO4 (0,544), KCl (30) ed HEPES pH 7,4. Successivamente ai periodi di remineralizzazione, i campioni sono stati sottoposti a spettroscopia micro-Raman confocale (Renishaw INVIA, Renishaw, Gloucheshire, UK) equipaggiato con microscopio ottico Leica DM/LM con obiettivo da 20x (NA 0,4), rivelatore CCD e spettrografo modulare. Un laser monocromatico di dimensione ≤ 1μm e lunghezza d’onda vicino allo spettro infrarosso (785 nm) è stato utilizzato per indurre l’effetto scattering Raman. L’intera area del campione è stata valutata con intervalli di 20μm sull’asse [X] e 50μm sull’asse [Y]. Cinque spettri Raman sono stati ottenuti da ciascun campione, in seguito a elaborazione computerizzata delle singole aree di scansione.
Valutazione al microscopio confocale laser a scansione (CLSM)
Successivamente alla spettroscopia Raman, i campioni sono stati reidratati in acqua deionizzata per 1 ora e analizzati con microscopio confocale (Leica SP2 CLSM, Heidelberg, Germania) dotato di una lente a immersione in olio 63x/1.4NA e Laser argon/elio con lunghezza d’onda di 514 nm. Lo studio è stato eseguito utilizzando luce riflessa rilevata da un tubo fotomoltiplicatore utilizzando specifici filtri di riflessione. Le scansioni sull’asse [Z] sono state effettuate con step di 1 µm fino a una profondità massima di 30 µm sotto la superficie esterna del campione dentinale. Le scansioni delle superfici di dentina sono state convertite in immagini topografiche pseudo-colorate in 3D tramite l’utilizzo di un software Leica SP2 per elaborazione di scansioni laser confocale (Leica, Heidelberg, Germania). La configurazione del sistema è stata ottimizzata e standardizzata per l’intera durata dell’esperimento. Ogni campione dentinale è stato scansionato fino a ottenere 5 immagini topografiche che rappresentassero le caratteristiche più significative delle superfici studiate.
Valutazione al SEM-EDX
Data la natura non distruttiva dei sistemi di analisi di spettroscopia Raman e di microscopia confocale laser (CLSM), i campioni sono stati riutilizzati e analizzati al microscopio elettronico a scansione (SEM) equipaggiato con uno dispositivo analitico che sfrutta l’emissione di raggi X generati da un fascio elettronico accelerato incidente sul campione (EDX). Dopo immersione in acqua deionizzata per 1 ora, i campioni sono stati disidratati, montati su supporti di alluminio e rivestiti con carbonio. La morfologia e la microstruttura chimica dei campioni sono state analizzate tramite un microscopio elettronico a scansione (Hitachi S3500, Hitachi High Technologies, Maidenhead, UK) dotato di un sistema di microanalisi a raggi X (EDX) operante a 8 kV di tensione.
RISULTATI
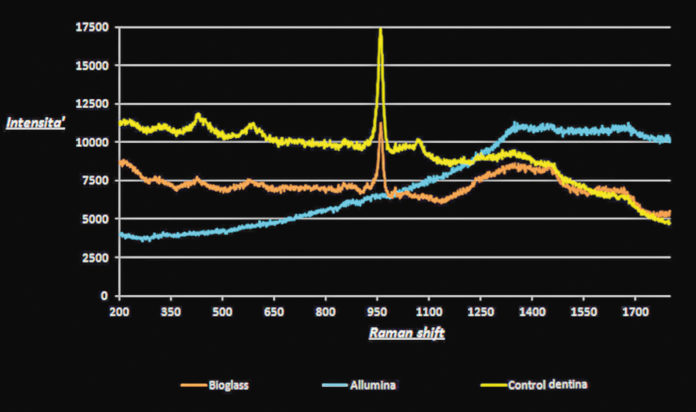
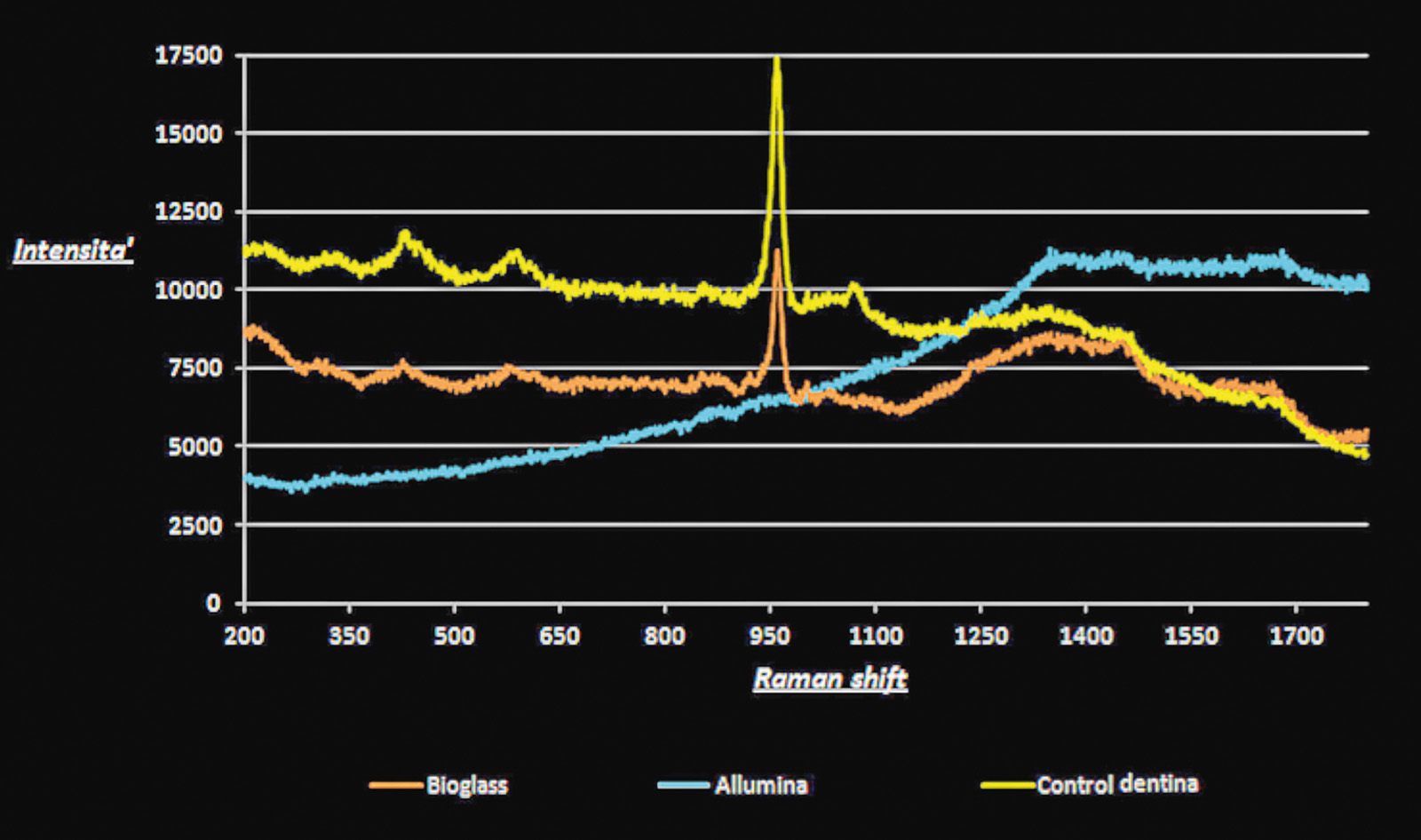
I risultati di questo studio hanno mostrato come le superfici dentinali sottoposte a demineralizzione totale fossero caratterizzate da una morfologia relativamente levigata e dalla presenza di tubuli dentinali esposti (figure 2A, 3C). La metodica analitica EDX ha confermato la bassissima presenza di calcio e fosfati (figura 3C) dovuta all’azione demineralizzante e chelante dell’acido citrico. Al contrario, la dentina mineralizzata presentava all’analisi micro-Raman la presenza di picchi (Raman shift) a 432, a 584 cm-1 e un picco ad alta intensità a 960 cm-1 (HCA: idrossiapatite) indicativi della componente minerale (figura 1). Quando si sono analizzati i campioni di dentina demineralizzata trattati con allumina e immersi in soluzione salina (PBSS) per 72 ore è stato possibile notare uno spettro Raman simile a quello della dentina totalmente demineralizzata. Gli spettri Raman erano infatti caratterizzati da un’intensità continua di auto fluorescenza che andava da 1200 a 3000 cm-1 indicativi della componente organica del collagene dentinale (figura 1).
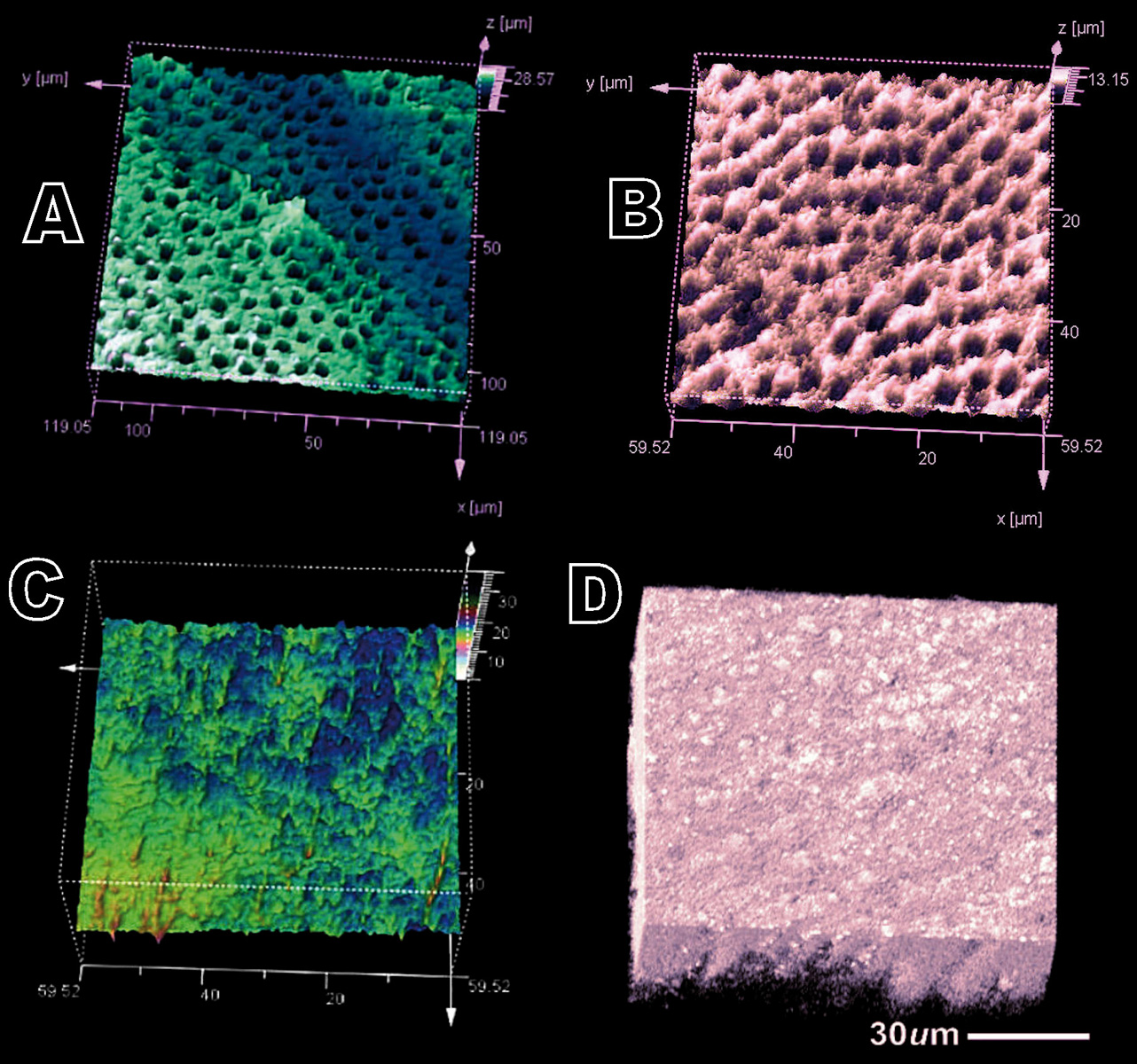
Il SEM-EDX e la microscopia confocale laser hanno confermato questi risultati mostrando tubuli dentinali totalmente esposti all’ambiente esterno (figura 2B) e uno spettro EDX che mostrava un’alta presenza di alluminio e scarsa quantità di calcio e fosfati (figura 3B). I campioni di dentina demineralizzata trattati con Bioglass e immersi in soluzione RSS presentavano uno spettro micro-Raman caratterizzato da picchi a 432, 584 cm-1 e da un picco più alto a 960 cm-1, tipici della presenza di calcio-fosfati e idrossiapatite (HCA) (figura 1). Il microscopio confocale e il SEM hanno confermato i risultati del Raman mostrando una superficie dentinale ricoperta di idrossiapatite (figure 2C, 2D, 3A). L’analisi EDX mostrava picchi di calcio e fosfati relativamente alti e comparabili alla dentina mineralizzata (figura 3A).
DISCUSSIONE
La filosofia contemporanea dell’odontoiatria conservativa si basa sull’applicazione clinica di trattamenti a minima invasività seguiti da tecniche di restauro atraumatiche che bloccano il processo carioso tramite remineralizzazione dei tessuti duri dentali12-14. La gestione e stabilizzazione della lesione cariosa e la creazione di un ambiente ottimale per la riparazione/guarigione dei tessuti duri dentali demineralizzati sono l’obiettivo primario di numerosi studi15-16. I Bioglass comprendono una vasta gamma di materiali bioattivi, alcuni attualmente utilizzati in parodontologia come sostituti ossei, come protesi vertebrali portanti o come agenti di desensibilizzazione della dentina utilizzati nelle procedure di “air-polishing”9,10. I Bioglass hanno modulo di Young di 35 GPa e la durezza Vickers è di 458±9.4 VHN, valori entrambi nettamente inferiori a quelle dell’allumina [380 GPa e VHN 2300, rispettivamente] ma molto simili a quelli della dentina mineralizzata, motivo per cui possono essere utilizzati in odontoiatria conservativa in sostituzione all’allumina per la rimozione selettiva del tessuto carioso10-11. In questo studio si è voluta dimostrare la capacità dei Bioglass di indurre la remineralizzazione della dentina demineralizzata. Gli esperimenti in vitro eseguiti hanno dimostrato che solo i Bioglass applicati su dentina demineralizzata possono favorire un aumento significativo del contenuto di idrossiapatite (figure 1, 3).
La “null hypothesis” che le polveri per sistemi di air-cutting utilizzate in questo studio fossero ugualmente in grado di remineralizzare il tessuto dentinale dopo immersione in soluzione salina (PBS) deve essere necessariamente rigettata. I nostri risultati dimostrano che i Bioglass potrebbero avere la potenzialità di promuovere la remineralizzazione della dentina cariata e dello strato ibrido resina-dentina. Quest’ultima ipotesi sembrerebbe essere già un dato di fatto; infatti, un recente studio16 ha mostrato che le superfici dentinali trattate con Bioglass modificati con acido poliacrilico e successivamente restaurate con adesivi “self-etching” contenenti monomeri idrofilici acidi (acidi carbossilici) presentavano, dopo 3 mesi di conservazione in soluzione fisiologica, una forza di micro-trazione simile a quella ossevata in campioni testati subito dopo l’esecuzione del restauro. I meccanismi di remineralizzazione indotti dai Bioglass sono stati ampiamente spiegati in letteratura e si basano su principi chimici ben precisi. I Bioglass, infatti, reagiscono in ambienti acquosi e con la saliva rilasciando ioni sodio (Na+) i quali vengono immediatamente scambiati con cationi idrogeno (H+) e (H3O+) entro 1 minuto dalla loro immersione. Questo rapido scambio consente il rilascio di ioni calcio (Ca2+) e fosfato (PO43-) dalla struttura delle particelle di Bioglass e un modesto aumento transitorio del pH che facilita la reazione del calcio e dei fosfati con i fluidi biologici e la precipitazione dei composti di fosfato di calcio (Ca-P) sulle superfici dentali. Con il procedere della deposizione dei composti di Ca-P questo strato si cristallizza in idrossicarbonato-apatite, che è chimicamente e strutturalmente simile all’apatite biologica, anche a livello interfibrillare17-19. La teoria più accreditata per la remineralizzazione dentinale si basa su un fenomeno chimico-fisico conosciuto con il nome di epitassia o crescita epitessiale (dal greco epi, che significa “sopra” e taxis, “ordinamento”).
Si tratta di un processo che favorisce la crescita di nuclei di cristallizazione per deposizione di materiali simili (omoepitassi) o di diversa natura (eteroepitassi) rispetto al nucleo di cristallizzazione. Questo fenomeno si manifesta in numerosi processi di bio-remineralizzazione naturali con ordini di grandezza che vanno da pochi nanometri fino a dimensioni nell’ordine dei micron. La presenza dei fosfati di calcio come precursori di nucleazione è un evento chiave nei processi di remineralizzazione dentinali, i quali possono prendere origine all’interno del network collagenico in prossimità delle componenti organiche non collageniche (glicosamminoglicani e proteoglicani) perché ricchi di acqua. Questi nuclei di cristallizzazione possono poi accrescersi per aggregazione, con conseguente perdita localizzata di solvente (acqua) e trasformarsi in strutture cristalline amorfe oppure subire trasformazioni di fase che danno origine a una struttura termodinamicamente stabile20,21. La remineralizzazione dello strato ibrido a livello delle interfacce resina-dentina rappresenta invece uno scenario molto particolare. Il legame resina-dentina è, infatti, una forma unica di ingegneria tissutale in cui la dentina demineralizzata viene infiltrata e supportata da resine creando un’impalcatura strutturale ibrida denominata “strato ibrido”22 il cui principale limite è la limitata longevità23; questo problema è causato in parte dall’assorbimento di acqua e idrolisi della componente idrofilica dell’adesivo24,25, e in parte dalla degenerazione delle fibrille di collagene attraverso metalloproteinasi della matrice dentinale (MMP) derivati dalla dentina demineralizzata26,27. Anche se la degradazione del collagene a livello dello strato ibrido può essere rinviata mediante l’applicazione di clorexidina come inibitore delle MMP28, una considerevole zona di dentina demineralizzata resta inavvertitamente e potenzialmente suscettibile ai carichi ciclici di masticazione29.
La clorexidina risulta inoltre avere un tempo di attività relativamente breve che non consente di conservare in modo permanente la matrice di collagene esposta all’interno dello strato ibrido30. La remineralizzazione delle fibrille di collagene all’interno dello strato ibrido sembra essere invece una strategia alternativa per preservare il legame resina-dentina31. Il punto chiave della remineralizzazione dello strato ibrido si basa anche in questo caso su processi di disidratazione localizzata, quindi perdita locale di solvente (acqua), dei glicosamminoglicani (GAG) e proteoglicani indotti dai materiali bioattivi remineralizzanti. I GAG e proteoglicani, essendo intimamente ricchi di acqua, risultano difficili da infiltrare con resine adesive dimostrandosi il punto debole dello strato ibrido in cui si innescano i processi di degradazione idrolitica/enzimatica che portano alla compromissione dell’integrità dello strato ibrido nel medio e lungo termine, potenzialmente alla riduzione della longevità del restauro. L’eventuale remineralizzazione di questi punti critici porterebbe alla chiusura delle nanoporosità dello strato ibrido e all’incapacità delle metallo-proteinasi (MMP) di degradare le fibre collagene perché dipendenti dalla presenza di acqua e di proteine32. Infine, è possibile affermare che l’uso dei Bioglass potrebbe essere il punto di partenza per un’odontoiatria conservativa basata sul principio della riparazione e remineralizzazione dei tessuti duri dentali che aprirebbe nuovi orizzonti verso la creazione di restauri diretti e indiretti più longevi.
Corrispondenza
Salvatore Sauro
Biomaterials, Biomimetics & Biophotonics
King’s College London Dental Institute at Guy’s
King’s College and St. Thomas’ Hospitals
Guy’s Hospital, London, UK
salvatore.sauro@kcl.ac.uk
Bibliografia
1. Litkowski LJ, Hack GD, Sheaffer HB, Greenspan DC. Occlusion of dentin tubules by 45S5 Bioglass. Bioceramics Vol. 10 – Proceedings of the 10th International Symposium on Ceramics in Medicine. Elsevier Scientific 1997;411-414.
2. Forsback AP, Areva S, Salonen JI. Mineralization of dentin induced by treatment with bioactive glass S53P4 in vitro. Acta Odontologica Scandinavica 2004;62:14-20.
3. Vollenweider M, Brunner TJ, Knecht S, Grass RN, Zehnder M, Imfeld T, Stark WJ. Remineralization of human dentin using ultrafine bioactive glass particles. Acta Biomaterials 2007;3:936-43.
4. Sauro S, Watson TF, Mannocci F, Tay FR, Pashley DH. Prevention of water contamination of ethanol-saturated dentin and hydrophobic hybrid layers. J Adhesive Dentistry 2009; 11:271-8.
5. Pashley DH. Dynamics of the pulpo-dentin complex. Critical Reviews in Oral Biology and Medicine 1996;7:104-133.
6. Andersson OH, Kangasniemi I. Calcium phosphate formation at the surface of bioactive glass in vitro. Journal Biomedical Materials Research 1991;25:1019-1030.
7. Hench LL, Andersson Ö. Bioactive glasses. Introduction to bioceramics. Hench LL, Wilson J Editors. World Scientific, Singapore 1993;45-47.
8. Cerruti MG, Greenspan D, Powers K. An analytical model for the dissolution of different particle size samples of Bioglass in TRIS buffered solution. Biomaterials 2005;26:4903-4911.
9. Sauro S, Watson TF, Thompson I. Dentine desensitization induced by prophylactic and air-polishing procedures: an in vitro dentine permeability and confocal microscopy study. Journal of Dentistry 2010;38:411-422.
10. Banerjee A, Paolinelis G, Socker M, McDonald F, Watson TF. An in vitro investigation of the effectiveness of bioactive glass air-abrasion in the “selective” removal of orthodontic resin adhesive. Eur J Oral Sci 2008;116:488-92.
11. Paolinelis G, Watson TF, Banerjee A. Microhardness as a predictor of sound and carious dentine removal using alumina air abrasion. Caries Res 2006;40:292-5.
12. Peters MC, McLean ME. Minimally invasive operative care. I. Minimal intervention and concepts for minimally invasive cavity preparations. Journal of Adhesive Dentistry 2001;3:7-16.
13. Peters MC, McLean ME. Minimally invasive operative care. II. Contemporary techniques and materials: an overview. Journal of Adhesive Dentistry 2001;3:17-31.
14. Peters MC, Bresciani E, Barata TJ, Fagundes TC, Navarro RL, Navarro MF, et al. In vivo dentin remineralization by calcium-phosphate cement. Journal of Dental Research 2010; 89:286-291.
15. Tay FR, Pashley DH. Biomimetic Remineralization of Resin-bonded Acid-etched dentin. Journal of Dental Research 2009;88:719-724.
16. Albadri Y, Sauro S, Banerjee A, Foxton R, Thompson I, Watson TF. (3557) Influence on dentinal adhesion of air-abrasion and modified bioactive glass/PAA. Journal of Dental Research (special Issue) 2010, 17 July , IADR Barcellona, Spain.
17. Andersson OH, Kangasniemi I. Calcium phosphate formation at the surface of bioactive glass in vitro Journal Biomedical Materials Research 1991;25:1019-1030.
18. Hench LL, Andersson Ö. Bioactive glasses. Introduction to bioceramics. Hench LL, Wilson J Editors. World Scientific, Singapore 1993;45-47.
19. Cerruti MG, Greenspan D, Powers K. An analytical model for the dissolution of different particle size samples of Bioglass in TRIS buffered solution. Biomaterials 2005;26:4903-4911.
20. Onuma K, Ito A. Cluster growth model for hydroxyapatite. Chemistry Materials 1998;10:3346-3351.
21. Wang L, Nancollas GH. Pathways to biomineralization and biodemineralization of calcium phosphates: the thermodynamic and kinetic controls. Dalton Transaction 2009;15:2665-72.
22. Tay FR, Pashley DH. Dental adhesives of the future. Journal of Adhesive Dentistry 2002; 4:91-103.
23. De Munck J, Van Landuyt K, Peumans M, Poitevin A, Lambrechts P, Braem M, et al. A critical review of the durability of adhesion to tooth tissue: methods and results. Journal of Dental Research 2005;84:118-132.
24. Ito S, Hashimoto M, Wadgaonkar B, Svizero N, Carvalho RM, Yiu C, et al. Effects of resin hydrophilicity on water sorption and changes in modulus of elasticity. Biomaterials 2005;26:6449-6459.
25. Sauro S, Pashley DH, Mannocci F, Tay FR, Pilecki P, Sherriff M, Watson TF. Micropermeability of current self-etching and etch-and-rinse adhesives bonded to deep dentine: a comparison study using a double-staining/confocal microscopy technique. European Journal of Oral Science 2008;116:184-93.
26. Pashley DH, Tay FR, Yiu C, Hashimoto M, Breschi L, Carvalho RM, et al. Collagen degradation by host-derived enzymes during aging. Journal of Dental Research 2004;83:216-221.
27. Mazzoni A, Pashley DH, Nishitani Y, Breschi L, Mannello F, Tjäderhane L, Toledano M, Pashley EL, Tay FR. Reactivation of inactivated endogenous proteolytic activities in phosphoric acid-etched dentine by etch-and-rinse adhesives. Biomaterials 2006;27:4470-4476.
28. Carrilho MR, Geraldeli S, Tay F, de Goes MF, Carvalho RM, Tjäderhane L, et al. In vivo preservation of the hybrid layer by chlorhexidine. Journal of Dental Research 2007;86:529-533.
29. Wang XT, Ker RF. Creep rupture of wallaby tail tendons. The Journal of Experimental Biology 1995;198:831-845.
30. Rosenthal S, Spångberg L, Safavi K. Chlorhexidine substantivity in root canal dentin. Oral Surg, Oral Med, Oral Path, Oral Rad, and Endodont 2004;98:488-492.
31. Tay FR, Pashley DH. Guided tissue remineralisation of partially demineralised human dentine. Biomaterials 2008;29:1127-37.
32. Kim YK, Gu LS, Bryan TE, Kim JR, Chen L, Liu Y, Yoon JC, Breschi L, Pashley DH, Tay FR. Mineralisation of reconstituted collagen using polyvinylphosphonic acid/polyacrylic acid templating matrix protein analogues in the presence of calcium, phosphate and hydroxyl ions. Biomaterials 2010;31:6618-6627.




