• Roberto Micolani
• Luigi Tagliatesta
• Matteo Doto
• Giuseppe Di Martino
• Matteo Chiapasco
Università degli Studi di Milano – Dipartimento
di Scienze della Salute, Unità di Chirurgia Orale (Direttore: Prof. M. Chiapasco)
Riassunto
L’obiettivo di questo studio è stato quello di valutare l’efficacia del concentrato di fibrina ricca di piastrine (PRF) posizionato nell’alveolo post-estrattivo di terzi molari inferiori nella guarigione parodontale dei secondi molari e sul controllo del dolore post-operatorio. Utilizzando una metodica split-mouth sono stati estratti 20 terzi molari inferiori in un campione di 10 pazienti. In seguito alle avulsioni è stato posizionato il coagulo di PRF in un alveolo (gruppo studio) mentre nel secondo alveolo non è stato inserito alcun materiale (gruppo controllo). Prima delle avulsioni e tre mesi dopo l’intervento chirurgico sono stati registrati i valori di sondaggio distale dei secondi molari di entrambi i gruppi, l’indice di placca e di sanguinamento. È stato eseguito il test dei ranghi con segno di Wilcoxon per verificare differenze statisticamente significative tra i 2 gruppi. Le misurazioni pre-operatorie di sondaggio parodontale, BOP e indice di placca sono risultate simili in entrambi i gruppi. A tre mesi le misurazioni hanno rilevato una diminuzione del sondaggio parodontale nel gruppo PRF (prima dell’intervento: 2,95 mm; dopo l’intervento: 2,21 mm) rispetto al gruppo senza PRF (prima dell’intervento: 2,18 mm; dopo l’intervento: 2,16 mm). Gli indici di placca e di sanguinamento sono risultati simili in entrambi i gruppi. Non è stato rilevato alcun miglioramento del dolore significativo nel gruppo PRF: la valutazione del dolore post-operatorio con scala analogico-visiva è risultata essere in media 6,1 per il gruppo studio e 6,3 per il gruppo controllo. Le differenze tra i 2 gruppi non sono risultate statisticamente significative (livello di significatività α=0,05) né sulla percezione del dolore (p=0,4872), né per i sondaggi post-chirurgici (p=0,1278). I risultati di questo studio sembrerebbero dimostrare un piccolo miglioramento nella guarigione dei tessuti molli dopo avulsione di terzi molari mandibolari, sebbene le differenze tra i due gruppi non siano risultate statisticamente significative. Non sono stati evidenziati miglioramenti sul controllo del dolore post-operatorio.
Summary
Platelet Rich Fibrin (PRF) info fresh extraction sockets: a comparative study on soft tissues healing
The aim of this study was to evaluate the healing properties and pain assessment of autologous platelet-rich fibrin (PRF) in mandibular third molar extraction sockets as far as mandibular second molar periodontal healing is concerned. Using a split-mouth design, 20 mandibular third molars in 10 patients were extracted either with (study group) or without PRF (control group) in the post-extractive site. Measurements of pocket depths, BOP, and plaque index were made prior to and 3 months after surgery. All data were analyzed with the Wilcoxon signed-rank test. Pre-operative pocket depths, BOP, and plaque index were similar for the two groups. Post-surgical measurements revealed a reduction in pocket depth in the PRF group (before surgery: 2.95 mm; after surgery 2.21 mm) when compared with the PRF-free group (before surgery: 2.18 mm; after surgery 2.16 mm). BOP and plaque index were similar for the two groups. The PRF group presented with no significantly pain reduction: post-operative pain evaluated with the VAS scale was 6.1 in the study group, and 6.3 in the control group, respectively. Statistical analysis indicated no significant periodontal (p=0.1278) or pain (p=0.4872) improvements at the α=0.05 significance level. The results of this study seem to demonstrate that PRF can slightly improve soft tissue healing after lower impacted third molars removal, showing capabilities in reducing pocket depth, improving clinical attachment levels and promoting defect fill, but no statistical differences were found. Also no significant differences were found between the two groups as far as post-operative pain is concerned.
L’estrazione dei terzi molari è una delle procedure più comuni in chirurgia orale. Le indicazioni all’avulsione dei terzi molari sono numerose: pericoronite, danni parodontali all’elemento adiacente, carie, dolore miofasciale, cisti e tumori odontogeni1.
Tralasciando i danni iatrogeni di tipo neurovascolare che esulano dagli obiettivi di questo lavoro, l’estrazione dei terzi molari non è tuttavia esente da esiti, in particolare di natura parodontale. Sono infatti riportate in letteratura numerose complicanze parodontali a livello della radice distale del secondo molare2-5.
L’obiettivo di questo lavoro è quello di valutare in uno studio split mouth randomizzato l’influenza dell’uso del concentrato di fibrina ricca di piastrine (PRF) sulla guarigione dei tessuti molli su un campione di 10 pazienti, per un totale di 20 terzi molari estratti. Il PRF è un concentrato di fibrina ricco di piastrine messo a punto da Joseph Choukroun per essere utilizzato in chirurgia orale e maxillo-facciale6.
La realizzazione di questo preparato non richiede l’utilizzo di anticoagulanti né di trombina di origine bovina (o qualunque altro agente gelificante) come avviene per altri fattori di crescita piastrinici come il plasma ricco di piastrine (PRP) e il plasma ricco di fattori di crescita (PRGF).
Nella fase di polimerizzazione del PRF, la trombina presente in concentrazioni fisiologiche permette la formazione di una matrice di fibrina in maniera lenta e naturale; le congiunzioni che si determinano portano a una struttura molecolare tridimensionale flessibile tale da intrappolare numerose citochine e promuovere così la migrazione cellulare e accelerare il processo di guarigione. La medesima matrice intrappola glicosamminoglicani come eparina e acido ialuronico che hanno la capacità di supportare la migrazione cellulare e la guarigione dei tessuti. Studi effettuati da Dohan e coll. dimostrano la presenza delle citochine PDGF-BB e TGF-A1 incorporate nel polimero di fibrina. Altri studi effettuati da Dohan e coll. dimostrano il ruolo del PRF nella regolazione immunitaria con capacità di retrocontrollo dell’infiammazione a causa dell’inclusione leucocitaria e dell’aumentata degranulazione indotta. È stato infine dimostrato come la matrice di fibrina risulti funzionare da supporto per le proteine morfogenetiche BMP da cui derivano le proprietà angiotrofiche, emostatiche e osteoconduttive. Si dimostra quindi come il PRF sia in grado di stimolare la neoangiogenesi e di fornire un’impalcatura di fibrina idonea alla migrazione cellulare, aspetto fondamentale per il processo di apposizione ossea. Il PRF appartiene a una nuova generazione di concentrati di piastrine che permettono una preparazione semplificata senza manipolazione biochimica del sangue. Proprio questo aspetto risulta un primo punto di forza di questo materiale rispetto ad altri derivati, poiché non pone problematiche medico-legali riguardo alla manipolazione di sangue7-10.
Materiali e metodi
Questo lavoro è stato concepito come studio caso-controllo slipt mouth.
Tra settembre 2011 e giugno 2012, presso l’Unità di Chirurgia Orale dell’ospedale San Paolo di Milano, sono stati selezionati 10 pazienti, 6 femmine e 4 maschi di età compresa tra i 22 e 35 anni.
Tutti i pazienti selezionati presentavano i terzi molari inferiori in disodontiasi bilaterale.
Ogni paziente è stato trattato con 2 diversi approcci terapeutici, ottenendo così 2 diversi gruppi, uno controllo e uno studio, ciascuno composto da 10 casi. Nel gruppo studio la cavità alveolare è stata riempita con PRF, mentre nel gruppo controllo non è stato inserito alcun biomateriale all’interno dell’alveolo post-estrattivo. I criteri di esclusione sono stati i seguenti: abuso di alcool o tabacco, patologie renali o epatiche gravi, storia di radioterapia nel distretto cervico-facciale, chemioterapia antiblastica in corso nel momento del trattamento, diabete non compensato, malattia parodontale a carico della dentatura residua, patologie a carico delle mucose (per esempio, lichen planus) nelle zone da trattare, igiene orale insufficiente e scarsa collaborazione da parte del paziente. Tutti i soggetti hanno firmato un consenso informato prima di partecipare allo studio, specifico sia per l’atto chirurgico sia per il prelievo ematico.
Protocollo di preparazione del PRF
Da ciascun paziente sono stati prelevati 40 ml di sangue venoso e raccolti in 4 provette sterili prive di anticoagulante. Il sangue prelevato, circa 10 ml per ogni provetta, è stato immediatamente centrifugato a 2700 rpm per 12 minuti. L’assenza di anticoagulante permette l’attivazione della cascata fisiologica della coagulazione. Il fibrinogeno, che si concentra nella parte superiore della provetta, viene progressivamente trasformato in fibrina dalla trombina circolante, mentre le piastrine rimangono comprese tra le maglie di fibrina.
Dopo la centrifugazione il coagulo risulta formato da tre strati:
1. plasma cellulare nella parte superiore;
2. coagulo di fibrina nella parte centrale;
3. parte corpuscolare sul fondo.
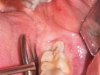
Il preparato è stato estratto dalla provetta, separando il concentrato di fibrina dalla componente corpuscolare mediante utilizzo di forbici sterili. Il PRF così ottenuto viene compresso tra due piastre forate per eliminare la componente plasmatica e poter ottenere una membrana di consistenza elastica, facilmente modellabile su una superficie o all’interno di una cavità e resistente alla trazione di un’eventuale sutura (Figure 1-6).
Misurazioni pre-operatorie
Tutti i pazienti sono stati sottoposti pre-operatoriamente a esame radiografico mediante ortopantomografia e radiografia endorale utilizzando la tecnica del cono lungo a raggi paralleli e un centratore di Rinn. È stato valutato l’indice di sanguinamento e l’indice di placca immediatamente prima dell’intervento chirurgico (T0) e a 3 mesi (T1). Le misurazioni parodontali sono state eseguite con sonda parodontale WHO sul versante distale per tutti i secondi molari mandibolari a T0 e T1.
Procedura chirurgica
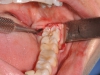
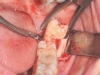
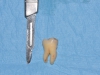
Dopo infiltrazione loco-regionale (mepivacaina 2% con vasocostrittore) si è proceduto all’allestimento di un lembo mucoperiostale a tutto spessore. L’incisione è stata estesa distalmente a livello del trigono retro-molare partendo dalla cuspide disto-linguale del secondo molare e mesialmente intrasulculare al secondo molare con scollamento della papilla tra primo e secondo molare. È stata eseguita quindi un’ostectomia iniziale con fresa a rosetta montata su manipolo dritto (40.000 rpm) munito di irrigazione esterna di fisiologica sterile e, quando necessario, odontotomia dell’elemento con fresa a fessura. Dopo l’estrazione dell’elemento la cavità residua è stata adeguatamente curettata e sottoposta a lavaggi con fisiologica sterile per detergere il più possibile l’alveolo. Nei siti appartenenti al gruppo studio è stata inserita all’interno dell’alveolo la membrana precedentemente ottenuta di PRF. Sono stati, infine, applicati punti di sutura singoli con seta 4/0 che sono stati poi rimossi a 7 giorni dall’intervento. A tutti i pazienti è stata somministrata una copertura antibiotica dopo l’intervento (Amoxicillina 1g + acido clavulanico ogni 12 ore per i 6 giorni successivi). Tutti i pazienti hanno seguito lo stesso protocollo antisettico (sciacqui di collutorio a base di clorexidina allo 0,12% – 3 volte al dì per 10 giorni) e antidolorifico (Ketoprofene sali di lisina in bustine da 80 mg) (Figure 7-12).
Controllo post-chirurgico
A 7 giorni dall’intervento si è proceduto alla rimozione dei punti di sutura e alla compilazione di un questionario per valutare il discomfort post-operatorio del paziente. Sono stati valutati i seguenti parametri: gonfiore e dolore di entrambi i siti trattati con le due diverse tecniche chirurgiche e quindi confrontati tra loro utilizzando la scala VAS (con valori da 1 a 10, dove 1=ottimo e 10=pessimo). Successivamente, a tre mesi dall’intervento chirurgico (T1), tutti i pazienti sono stati sottoposti a un nuovo controllo radiografico endorale dei siti operati per valutare la guarigione del sito chirurgico.
In questa occasione sono stati registrati nuovamente i valori di sondaggio relativi al secondo molare mandibolare e confrontati con quelli iniziali.
Analisi statistica
Il confronto statistico è stato eseguito tra i dati ottenuti dalle misurazioni sugli elementi 37 e 47 nei 10 pazienti prima dell’estrazione del terzo molare con i dati registrati 3 mesi dopo l’intervento chirurgico. Date le dimensioni ridotte del campione si è deciso di utilizzare un test non parametrico, il test di Wilcoxon, per il confronto tra due campioni appaiati; si tratta dell’analogo non parametrico del test t di Student per campioni appaiati.
Tale test risulta il più adeguato per questo tipo di analisi, poiché adattabile sia per dati su scala ordinale (scala VAS), rilevati cioè su una scala di punteggi fissa (per es., con
valori che vanno da 0 a 10), sia per dati su scala intervallare (profondità di sondaggio rilevate in millimetri). Il livello di significatività è stato posto pari al 5% (α=0,05).
Risultati
Sia nel gruppo studio che nel gruppo controllo non è stata registrata alcuna complicanza post-chirurgica. Alla rimozione della sutura, a 7 giorni dall’intervento chirurgico, la cavità dell’alveolo post-estrattivo era completamente richiusa in 4 casi su 10 nel gruppo studio e in 2 casi su 10 nel gruppo controllo. Il sondaggio parodontale pre-operatorio medio relativo al secondo molare inferiore è stato di 2,95 mm nel gruppo studio e 2,18 mm nel gruppo controllo.
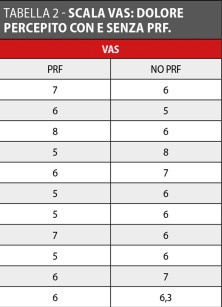
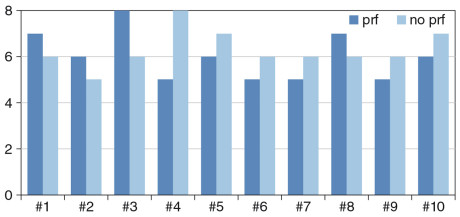
Tre mesi dopo l’intervento chirurgico il sondaggio parodontale medio del gruppo studio è stato 2,21 mm mentre nel gruppo controllo è stato di 2,16 mm (Tabella 1). Per ciò che concerne il discomfort post-operatorio valutato mediante scala VAS, tenendo in considerazione gonfiore e dolore post-chirurgico in una scala da 1 a 10 (dove 1=ottimo, 10= pessimo) è risultato essere in media 6,3 per il gruppo controllo e 6 per il gruppo studio (min: 5; max: 8) (Tabella 2, Grafico 1).
 Per tutti i pazienti è disponibile un follow-up clinico e radiografico a 3 mesi. Tutti gli alveoli, sia quelli trattati con PRF che quelli con tecnica tradizionale, sono guariti senza complicanze post-chirurgiche e in nessun caso si è verificata una sovra-infezione del sito operatorio. Dolore, gonfiore ed edema sono stati controllati nel periodo post-operatorio con il protocollo farmacologico prestabilito.
Per tutti i pazienti è disponibile un follow-up clinico e radiografico a 3 mesi. Tutti gli alveoli, sia quelli trattati con PRF che quelli con tecnica tradizionale, sono guariti senza complicanze post-chirurgiche e in nessun caso si è verificata una sovra-infezione del sito operatorio. Dolore, gonfiore ed edema sono stati controllati nel periodo post-operatorio con il protocollo farmacologico prestabilito.
A 3 mesi (T1), la diminuzione della profondità di sondaggio in corrispondenza della superficie distale del secondo molare nel gruppo studio è stato 0,74±0,05 mm mentre nel gruppo controllo 0,02±0,04 mm. Indice di placca (PlI – Plaque Index) e indice di sanguinamento (BOP – Bleeding on probing) sono stati rispettivamente prima dell’intervento (T0) e a 3 mesi (T1): 2 con sanguinamento al sondaggio e 0 senza sanguinamento al sondaggio in entrambi i gruppi.
Discussione
In letteratura sono presenti studi clinici che hanno indagato le complicanze parodontali sulla radice distale del secondo molare mandibolare in seguito ad avulsione del terzo molare adiacente. In particolare, queste complicanze sono state valutate in relazione all’età del paziente, alla profondità e al grado di angolazione dell’inclusione dentaria del terzo molare1-5. L’uso del PRF è stato dimostrato essere un utile strumento per aiutare la rigenerazione parodontale e ossea in vivo, a causa del contenuto elevato di fattori di crescita7-11. Nell’ultimo decennio sono state presentate diverse tecniche per migliorare la guarigione dell’alveolo post-estrattivo, la maggior parte delle quali includono l’uso di un materiale di innesto che viene inserito all’interno dell’alveolo12. Il PRF è considerato una seconda generazione di concentrati di piastrine e il suo utilizzo è stato proposto in varie procedure chirurgiche nel tentativo di migliorare la guarigione delle ferite. Si ottiene dal sangue del paziente eliminando così la possibilità di trasmissione di malattie o reazioni da corpo estraneo. La tecnica di preparazione del PRF è semplice e non richiede particolari attrezzature. La rete di fibrina può quindi essere facilmente manipolata in una membrana che può essere trasferita in qualsiasi sito chirurgico.
Recentemente, è stato dimostrato l’uso del PRF per stimolare la crescita di osteoblasti e cellule del legamento parodontale, entrambi significativi per la rigenerazione di difetti parodontali13-15. A causa dell’efficacia in vitro del PRF, sono stati condotti diversi studi clinici per determinare il suo potenziale clinico16. Attualmente, il PRF è stato testato con successo in diverse procedure, compresa la chirurgia maxillo-facciale, la chirurgia parodontale e l’implantologia17-25. In letteratura sono riportati utilizzi anche in chirurgia plastica ricostruttiva26 e in medicina veterinaria27. Mazor et al. hanno usato con successo il PRF come unico materiale da innesto in una serie di procedure di rialzo del seno mascellare13, dimostrando che il PRF potrebbe stimolare la formazione di nuovo tessuto osseo nelle zone carenti della quantità di osso necessaria per il posizionamento dell’impianto. In uno studio simile con 6 anni di follow-up, Simonpieri et al. sono riusciti a dimostrare che l’uso del PRF come unico agente da innesto è una valida opzione a lungo termine in procedure di rialzo del seno14.
Il PRF è stato anche utilizzato con successo per il trattamento di difetti parodontali. Studi in vitro hanno confermato che il PRF stimola selettivamente la crescita di osteoblasti e cellule gengivali28. In una serie di studi clinici condotti da Pradeep e Sharma è stato dimostrato che il PRF potrebbe essere utilizzato nei difetti parodontali mediante tecniche di guided-tissue-regeneration (GTR) e nelle lesioni di II grado delle forcazioni15,18. Del Corso et al. hanno pubblicato diversi case report che mostrano il successo nell’uso di membrane di PRF nella gestione di entrambi i difetti di singole e multiple recessione gengivali17. I risultati clinici sono stati mantenuti con successo per almeno un anno. Anilkumar et al. hanno confermato questa osservazione e hanno dimostrato che il PRF potrebbe essere utilizzato per le procedure di copertura della radice29. La principale implicazione clinica dei risultati ottenuti sembrerebbe un miglioramento nella guarigione dei tessuti molli, anche se le differenze tra il gruppo studio e quello controllo non risultano statisticamente significative. Per quanto concerne il controllo del dolore post-chirurgico, i dati non dimostrano un miglioramento nel gruppo studio rispetto a quello controllo. È da sottolineare però che il campione in studio è piuttosto ridotto.
Conclusioni
Questo studio clinico prospettico sembra confermare il PRF come buon coadiuvante nella guarigione dei tessuti molli in seguito ad avulsione di terzi molari: si assiste, infatti, a una migliore guarigione a livello parodontale, con diminuzione del sondaggio distale al secondo molare. Sarebbero però necessari ulteriori studi con follow-up più lunghi e con un campione di pazienti più numeroso per avere la conferma di un reale beneficio del PRF sulla guarigione dell’alveolo post-estrattivo. Non sono inoltre stati evidenziati dei miglioramenti sul dolore post-operatorio.
Corrispondenza
Matteo Doto, matteo.doto@fastwebnet.it
Bibliografia
1. Chiapasco M, De Cicco L, Marrone G. Side effects and complications associated with third molar surgery. Oral surgery, oral medicine, and oral pathology 1993;76(4):412-20.
2. Szmyd L, Hester WR. Crevicular depth of the second molar in impacted third molar surgery. Journal of oral surgery, anesthesia, and hospital dental service 1963;21:185-9.
3. Kugelberg CF. Periodontal healing two and four years after impacted lower third molar surgery. A comparative retrospective study. Int J Oral Maxillofac Surg 1990;19(6):341-5.
4. Kugelberg CF, Ahlstrom U, Ericson S, Hugoson A, Kvint S. Periodontal healing after impacted lower third molar surgery in adolescents and adults. A prospective study. Int J Oral Maxillofac Surg 1991;20(1):18-24.
5. Kugelberg CF, Ahlstrom U, Ericson S, Hugoson A, Thilander H. The influence of anatomical, pathophysiological and other factors on periodontal healing after impacted lower third molar surgery. A multiple regression analysis. Journal of clinical periodontology 1991;18(1):37-43.
6. Dohan DM, Choukroun J, Diss A, Dohan SL, Dohan AJ, Mouhyi J, et al. Platelet-rich fibrin (PRF): a second-generation platelet concentrate. Part I: technological concepts and evolution. Oral surgery, oral medicine, oral pathology, oral radiology, and endodontics 2006;101(3):e37-44.
7. Kang YH, Jeon SH, Park JY, Chung JH, Choung YH, Choung HW, et al. Platelet-rich fibrin is a Bioscaffold and reservoir of growth factors for tissue regeneration. Tissue engineering. Part A 2011;17(3-4):349-59.
8. Gassling VL, Acil Y, Springer IN, Hubert N, Wiltfang J. Platelet-rich plasma and platelet-rich fibrin in human cell culture. Oral surgery, oral medicine, oral pathology, oral radiology, and endodontics 2009;108(1):48-55.
9. Darby I, Chen ST, Buser D. Ridge preservation techniques for implant therapy. Int J Oral Maxillofac Implants 2009;24 Suppl:260-71.
10. Dohan DM, Choukroun J, Diss A, Dohan SL, Dohan AJ, Mouhyi J, et al. Platelet-rich fibrin (PRF): a second-generation platelet concentrate. Part II: platelet-related biologic features. Oral surgery, oral medicine, oral pathology, oral radiology, and endodontics 2006;101(3):e45-50.
11. Dohan Ehrenfest DM, de Peppo GM, Doglioli P, Sammartino G. Slow release of growth factors and thrombospondin-1 in Choukroun’s platelet-rich fibrin (PRF): a gold standard to achieve for all surgical platelet concentrates technologies. Growth Factors 2009;27(1):63-9.
12. Dohan Ehrenfest DM, Del Corso M, Diss A, Mouhyi J, Charrier JB. Three-dimensional architecture and cell composition of a Choukroun’s platelet-rich fibrin clot and membrane. Journal of Periodontology 2010;81(4):546-55.
13. Mazor Z, Horowitz RA, Del Corso M, Prasad HS, Rohrer MD, Dohan Ehrenfest DM. Sinus floor augmentation with simultaneous implant placement using Choukroun’s platelet-rich fibrin as the sole grafting material: a radiologic and histologic study at 6 months. Journal of Periodontology 2009;80(12):2056-64.
14. Simonpieri A, Choukroun J, Del Corso M, Sammartino G, Dohan Ehrenfest DM. Simultaneous sinus-lift and implantation using microthreaded implants and leukocyte- and platelet-rich fibrin as sole grafting material: a six-year experience. Implant dentistry 2011;20(1):2-12.
15. Sharma A, Pradeep AR. Treatment of 3-wall intrabony defects in patients with chronic periodontitis with autologous platelet-rich fibrin: a randomized controlled clinical trial. Journal of Periodontology 2011;82(12):1705-12.
16. Choukroun J, Diss A, Simonpieri A, Girard MO, Schoeffler C, Dohan SL, et al. Platelet-rich fibrin (PRF): a second-generation platelet concentrate. Part IV: clinical effects on tissue healing. Oral surgery, oral medicine, oral pathology, oral radiology, and endodontics 2006;101(3):e56-60.
17. Del Corso M, Sammartino G, Dohan Ehrenfest DM. Re: Clinical evaluation of a modified coronally advanced flap alone or in combination with a platelet-rich fibrin membrane for the treatment of adjacent multiple gingival recessions: a 6-month study. Journal of Periodontology 2009;80(11):1694-7; author reply 1697-9.
18. Sharma A, Pradeep AR. Autologous platelet-rich fibrin in the treatment of mandibular degree II furcation defects: a randomized clinical trial. Journal of Periodontology 2011;82(10):1396-403.
19. Zhang Y, Tangl S, Huber CD, Lin Y, Qiu L, Rausch-Fan X. Effects of Choukroun’s platelet-rich fibrin on bone regeneration in combination with deproteinized bovine bone mineral in maxillary sinus augmentation: a histological and histomorphometric study. Journal of cranio-maxillo-facial surgery: official publication of the European Association for Cranio-Maxillo-Facial Surgery 2012;40(4):321-8.
20. Kumar RV, Shubhashini N. Platelet rich fibrin: a new paradigm in periodontal regeneration. Cell and tissue banking 2013 Sep;14(3):453-63.
21. Thorat M, Pradeep AR, Pallavi B. Clinical effect of autologous platelet-rich fibrin in the treatment of intra-bony defects: a controlled clinical trial. Journal of Clinical Periodontology 2011;38(10):925-32.
22. Keyhan SO, Hemmat S, Badri AA, Abdeshahzadeh A, Khiabani K. Use of platelet-rich fibrin and platelet-rich plasma in combination with fat graft: which is more effective during facial lipostructure? Journal of oral and maxillofacial surgery: official journal of the American Association of Oral and Maxillofacial Surgeons 2012.
23. Simonpieri A, Del Corso M, Vervelle A, Jimbo R, Inchingolo F, Sammartino G, et al. Current knowledge and perspectives for the use of platelet-rich plasma (PRP) and platelet-rich fibrin (PRF) in oral and maxillofacial surgery part 2: Bone graft, implant and reconstructive surgery. Current pharmaceutical biotechnology 2012;13(7):1231-56.
24. Charrier JB, Monteil JP, Albert S, Collon S, Bobin S, Dohan Ehrenfest DM. Relevance of Choukroun’s Platelet-Rich Fibrin (PRF) and SMAS flap in primary reconstruction after superficial or subtotal parotidectomy in patients with focal pleiomorphic adenoma: a new technique. Revue de laryngologie – otologie – rhinologie 2008;129(4-5):313-8.
25. Chang YC, Zhao JH. Effects of platelet-rich fibrin on human periodontal ligament fibroblasts and application for periodontal infrabony defects. Australian dental journal 2011;56(4):365-71.
26. Sclafani AP, Saman M. Platelet-rich fibrin matrix for facial plastic surgery. Facial plastic surgery clinics of North America 2012;20(2):177-86, vi.
27. Visser LC, Arnoczky SP, Caballero O, Gardner KL. Evaluation of the use of an autologous platelet-rich fibrin membrane to enhance tendon healing in dogs. American journal of veterinary research 2011;72(5):699-705.
28. Clipet F, Tricot S, Alno N, Massot M, Solhi H, Cathelineau G, et al. In vitro effects of Choukroun’s platelet-rich fibrin conditioned medium on 3 different cell lines implicated in dental implantology. Implant dentistry 2012;21(1):51-6.
29. Anilkumar K, Geetha A, Umasudhakar, Ramakrishnan T, Vijayalakshmi R, Pameela E. Platelet-rich-fibrin: a novel root coverage approach. Journal of Indian Society of Periodontology 2009;13(1):50-4.