Si riporta il caso di una paziente affetta da lesioni simil-lichenoidi persistenti in cui il trattamento con olio ozonizzato si è mostrato estremamente utile, favorendo una drastica riduzione del dolore e delle dimensioni delle lesioni.
Il lichen planus orale (OLP) è un disturbo muco-cutaneo a carattere infiammatorio cronico autoimmune (1, 2). Benché possa colpire altre aree corporee cutanee e mucose, il cavo orale è generalmente il primo luogo di manifestazione dell’OLP e, in alcuni casi, l’unico (3). L’incidenza globale dell’OLP è stimata tra l’1.01%4, 5 e il 3.6%1 con una più alta incidenza in EU (4). Sebbene possa colpire tutte le fasce di età ed entrambi i sessi, il lichen planus presenta una maggior incidenza tra la quarta e la settima decade di vita e una frequenza maggiore nelle donne (3, 4), con una predilezione che va dal 61 all’80% (6, 1).
Alessia Sicignano – Virginia Fenu – Germano Orrù – Cinzia Casu
Dipartimento di scienze chirurgiche, Oral Biotechnology Laboratory (OBL), Università di Cagliari
Nonostante l’eziologia non sia completamente nota, ci sono molteplici evidenze in letteratura che supportano la teoria di un processo immunologico sostenuto dalle cellule T citotossiche CD8+ che si attivano nei confronti di un antigene sconosciuto portando ad apoptosi le cellule della membrana basale dell’epitelio orale (3, 7). Inoltre, numerosi fattori possono influenzare la comparsa di queste lesioni, come diabete, farmaci, stress, ansia, disordini intestinali, disturbi autoimmuni, materiali dentali, predisposizione genetica e neoplasie (3).
Il lichen è una lesione che esordisce improvvisamente e bruscamente con papule biancastre che si addensano in modo progressivo. Istologicamente e clinicamente le lesioni dell’OLP si classificano in lesioni bianche e lesioni rosse che si manifestano in maniera simmetrica e multifocale in mucosa geniena, lingua, mucosa gengivale e molto raramente sulle labbra (0.51-8.9%8) (6, 7). Secondo la letteratura, il lichen può presentarsi in sei forme classiche (9, 3):
- forme papulari, reticolari e a placca, per quanto riguarda le lesioni bianche;
- atrofiche, erosive e, più raramente, bollose, per quanto riguarda le lesioni rosse (6).
Queste forme diverse possono manifestarsi contemporaneamente (60% dei casi) o possono variare nel tempo passando dall’una all’altra nello stesso paziente (6).
Il pattern più comune è quello reticolare, che si presenta come una lesione asintomatica con strie note come strie di Wickham con decorso bilaterale sulla mucosa buccale, linguale e meno comunemente gengivale e labiale (3, 6).
La forma a placca colpisce tipicamente il dorso della lingua e la mucosa buccale con manifestazioni multifocali asintomatiche in placche lisce che possono essere piane o rilevate. La forma papulare è rara e si presenta con piccole papule bianche con fini striature sulla superficie. Quella eritematosa colpisce maggiormente la gengiva, con una distribuzione irregolare, spesso in quattro quadranti, con un quadro simile alla gengivite desquamativa. Infine, la forma bollosa è la forma meno comune, che si manifesta quando lo scollamento epiteliale della forma erosiva è talmente grave che si formano vere e proprie bolle superficiali, dolorose e che si abradono facilmente (3).
La manifestazione del lichen è caratterizzata da periodi di esacerbazione, con dolore acuto e sensazione urente, e di remissione, in cui i sintomi si alleviano (7, 10). I sintomi si manifestano nel 40-95% dei casi e sono prettamente associati alle forme di lichen rosso, che sembrano colpire più frequentemente le donne rispetto agli uomini. Queste forme acute, inoltre, hanno una maggior tendenza all’evoluzione maligna (6, 9). In generale, il rischio di trasformazione maligna dell’OLP varia tra lo 0.04%11 e il 2.28%4 e questa aumenta nelle forme ulcerative ed erosive e in concomitanza con altri fattori quali stress, fumo, alcol, HCV (3, 7, 12). Inoltre, alcuni studi dimostrano che nelle forme più erosive ed estese, soprattutto nelle donne, il lichen può coinvolgere anche l’esofago (50% dei casi) con decorso subclinico e in quest’area, così come quando presente sulla lingua, laringe e vulva, il tasso di trasformazione maligna è decisamente più alto (2).
Lesioni lichenoidi
Le lesioni lichenoidi orali (OLL) sono lesioni di ipersensibilità T-mediate tipicamente in risposta a materiali di restauro come l’amalgama (6, 14).
In realtà distinguiamo tre forme di OLL (14):
- associate a materiali di restauro. sono stati individuati più di 130 materiali dentali associati a reazioni di ipersensibilità, tra cui nickel solfato, cloruro di palladio, tiosolfato di sodio, perossido di benzoile, amalgama (3-5% casi)14;
- farmaco-indotte. In particolare, i farmaci coinvolti sono ACE-inibitori, ipoglicemizzanti orali, penicillamine, dapsone;
- insorte a seguito di trapianti di midollo. Sono state riscontrate lesioni lichenoidi anche in associazione a cibi o a patologie sistemiche a carico del fegato (7, 14).
L’aspetto clinico delle lesioni lichenoidi è piuttosto simile a quello dell’OLP, con lesioni che si manifestano soprattutto a livello della mucosa labiale, della lingua (specialmente dorso e bordi) e meno comunemente della mucosa gengivale (6). Tuttavia, mentre le OLP si manifestano in forma simmetrica, bilaterale e con lesioni bianche o rosse, le lesioni lichenoidi sono generalmente isolate, singole, rosse e associate a materiali di restauro (2, 11). Considerando il più alto tasso di malignità delle OLL rispetto alle OLP (OLP fino al 2.28; OLL fino al 3.1%) (14) e considerata la differente patogenesi, è importante distinguere le due lesioni.
La diagnosi delle OLL comprende: diagnosi clinica con osservazione di lesioni isolate tipicamente in prossimità di restauri dentali ed anamnesi farmacologica; diagnosi istologica con epitelio atrofico, assenza di infiltrato linfocitario a bande (tipico dell’OLP) e maggior presenza di eosinofili, mastociti, capillari, COX2, granulociti e plasmacellule nel tessuto; patch test allergico cutaneo; test di immunofluorescenza diretta e indiretta (6, 7, 11, 13, 14).
Trattamento delle lesioni lichenoidi
Per via della natura recalcitrante e idiopatica dell’OLP non è stata attualmente individuata una terapia definitiva e completamente risolutiva. Lo scopo dei trattamenti terapeutici attuali è quello di ridurre il più possibile la sensazione dolorosa (9), l’entità delle lesioni e il rischio di cancerizzazione (7). Ovviamente, oltre ai trattamenti farmacologici, una serie di atteggiamenti e abitudini possono modificare la ricorrenza delle lesioni: corretta igiene orale, ridotto consumo di cibi caldi, piccanti, speziati, acidi, controllo dello stress e ridotto consumo di fumo e alcol (3, 7).
Prima di iniziare qualsiasi trattamento è importante eseguire un esame clinico completo in modo da eliminare possibili fattori irritanti o fattori locali aggravanti presenti nel cavo orale come restauri appuntiti, denti fratturati e abitudini viziate pericolose (3).
Il trattamento del lichen planus varia in base alla sua manifestazione. Le lesioni bianche generalmente non hanno sintomatologia dolorosa e non richiedono trattamento (6); al più, in questo caso occorre informare il paziente circa la natura cronica della lesione e sull’importanza di monitorarla nel tempo.
Nelle forme rosse, atrofiche o erosive, il trattamento di prima scelta tradizionalmente ricade sui glucocorticoidi topici (triamcinolone acetonide 0.1% o il clobetasolo topico 0.05%) (1, 3, 5, 7, 15) somministrati con paste adesive (come idrossietilcellulosa) per via della loro scarsa adesività alle mucose (2, 3, 6, 8, 16) o corticosteroidi sistemici (prednisone sistemico) a bassi dosaggi nelle forme di OLP più esacerbate e resistenti (1, 2, 3, 7, 8).
Tuttavia, questi farmaci hanno mostrato numerosi effetti avversi sulle mucose, tra cui atrofia con assottigliamento delle mucose, sovra infezione con candidosi secondaria, alterazione del gusto, sensazione urente (5,10) e altre complicanze sistemiche quali soppressione adreno-corticale, ipertensione, iperglicemia, aumento di peso, insonnia, alterazioni dell’umore, irritazioni gastro-intestinali, osteoporosi (7). Per prevenire le sovrainfezioni da Candida durante il trattamento con corticosteroidi, alcuni studi suggeriscono l’utilizzo di clorexidina e miconazolo gel; tuttavia, la clorexidina sembra avere effetti dannosi nella rigenerazione dei tessuti (5, 7).
Altri trattamenti farmacologici di prima linea sono gli inibitori della calcineurina (tacrolimus 0.1% o pimecrolimus 1%) (1, 3, 7). Questi immunosoppressori, andando a inibire la calcineurina, portano ad una riduzione dell’attività del sistema immunitario e quindi una riduzione in numero dei linfociti T e di citochine infiammatorie, che è significativo nelle patologie autoimmuni come l’OLP (3).
Dati gli effetti avversi dei corticosteroidi e data l’impossibilità di somministrazione in pazienti con condizioni di salute particolari come stato di gravidanza, condizioni sistemiche complicate, allattamento, glaucoma, infezioni erpetiche, tubercolosi, diabete mellito, HIV, ipertensione (7, 10) si è valutato nel tempo un trattamento del lichen planus orale non strettamente farmacologico. In letteratura sono riportati numerosi studi di terapie erboristiche con aloe vera, curcuma (10) ed henna (5) che hanno dimostrato significative proprietà antinfiammatorie, antimicrobiche, anti-carcinogeniche, antifungine, immunomodulanti, antiossidanti e cicatriziali, efficaci nel trattamento del lichen planus mucoso (5, 10, 16, 17). L’aloe vera rappresenta il trattamento più sicuro ed efficace: ha dimostrato un’efficacia pari o anche superiore ai corticosteroidi topici, senza alcun effetto collaterale (16). Altri trattamenti non farmacologici che hanno riportato significativi risultati nel trattamento delle lesioni da lichen planus sono la fotochemioterapia, la terapia laser con lunghezze d’onda di 660 nm (1, 7, 18), la terapia fotodinamica con acido α-aminolevulenico e, più recentemente, l’ozono terapia (3).
Ozono terapia
L’ozono è una molecola gassosa triatomica che consiste in tre atomi di ossigeno e che ha mostrato un’importante efficacia nel trattamento di varie patologie mediche e odontoiatriche, andando via via acquisendo sempre più rilevanza. Recentemente la terapia con ozono è stata indicata come trattamento di 260 patologie differenti (19). L’ozono utilizzato in ambito sanitario per il trattamento delle ferite è una mistura di gas comprendente 95-99.95% di ossigeno e 0.05-5% di ozono puro (19). Le formulazioni disponibili sono in forma di olio, acqua e gas (20) e attualmente ci sono nove possibili metodi di applicazione della terapia: intra-arterioso ed intra-venoso, insufflazioni rettali, iniezioni intramuscolo, autoemoterapia, acqua ozonizzata, iniezioni intra-articolari, ozone bagging, olio ozonizzato e inalazione dell’ozono (19).
Rispetto alla forma gassosa, che presenta un importante rischio di inalazione dell’ozono, le formulazioni in acqua e in olio, che consentono l’applicazione topica, risultano molto più sicure e semplici da manipolare. Tuttavia, grande limite dell’acqua ozonizzata è che non può essere conservata, ma va ripreparata a ogni necessità (20). Da questo punto di vista, la formulazione dell’ozono in olio risulta essere più vantaggiosa (21), in quanto l’ozonizzazione degli oli vegetali genera la formazione di composti più stabili (20, 22) garantendo una migliore e più prolungata conservazione. Ai numerosi effetti analgesici e terapeutici dell’ozono si aggiunge l’effetto cheratoplastico dell’olio (23), che coadiuva la protezione delle ulcere, piaghe e lesioni cutanee stimolando i processi di cheratinizzazione dell’epidermide.
L’impiego dell’ozono nelle terapie mediche è iniziato con il trattamento della tubercolosi, seguita dalla clinica odontoiatrica e dal trattamento della gangrena (22). L’interesse crescente per questa terapia in campo medico-dentistico è giustificato dalle sue vaste proprietà fisiochimiche, che si esplicano a vari livelli.
Una delle principali proprietà dell’ozono è l’elevata capacità antimicrobica contro batteri, virus, miceti, parassiti e biofilm. L’ozono, infatti, uccide tutti i tipi di batteri, funghi e protozoi (23) e ha un effetto antifungino anche contro le candidosi3. Per questo, l’ozono si è dimostrato utile nella gestione delle ferite settiche e delle sovra infezioni da Candida (22). L’ozono presenta un’importante azione antiossidante, anti-ipossica, immunostimolante e antiinfiammatoria (21,23). Agisce come bio-regolatore rilasciando fattori cellulari endoteliali e normalizza l’equilibrio redox cellulare quando entra in contatto con i fluidi biologici (22). L’ozono, infatti, a livello vascolare, è in grado di migliorare le proprietà reologiche del sangue potenziando il microcircolo (23), aumenta la pressione parziale dell’ossigeno nei tessuti, secerne vasodilatatori (ossido nitrico) inducendo vasodilatazione arteriosa e venosa (18, 24). Tutto questo si traduce in un benefico effetto di rigenerazione delle ferite e minor danneggiamento dei tessuti, impedendo e riducendo il rischio di ischemia tissutale.
L’azione antinfiammatoria e immunostimolante dell’ozono è svolta sia con l’induzione della sintesi di interleuchine, prostaglandine e leucotrieni (20), che riducono l’infiammazione, sia tramite la normalizzazione dei livelli di citochine quali IL-8, TNF-α, TGF-β e Interferone-C (19, 22).
Inoltre, a basse concentrazioni, l’ozono aumenta la mobilità e l’adesione dei polimorfonucleati nel sangue periferico (19) e induce una blanda attivazione di percorsi antiossidanti protettivi, come la via del fattore eritroide nucleare Nrf-2 (9) che ristabilisce la sintesi infiammatoria delle citochine.
Considerando le sue spiccate capacità di riduzione dell’infezione microbica, effetto di debridment, modulazione della fase infiammatoria, stimolazione dell’angiogenesi e induzione di reazioni enzimatiche che favoriscono il metabolismo dell’ossigeno, l’ozono è stato empiricamente utilizzato come agente terapeutico per fistole e ferite post-chirurgiche, ulcere croniche, ulcere ischemiche, ferite da diabete, psoriasi, piede d’atleta (22). La sicurezza dell’ozono è confermata da molteplici studi presenti in letteratura che hanno valutato l’assenza di effetti avversi con trial clinici anche in pazienti immunosoppressi, diabetici e con comorbidità che aggravano la prognosi di una lesione preesistente. L’ozono, infatti, riesce ad attivare e sintetizzare interleuchine, leucotrieni e prostaglandine che placano significativamente l’infiammazione nei soggetti immunosoppressi; inoltre, migliora il controllo glicemico nei soggetti diabetici favorendo la guarigione delle lesioni e riducendo drasticamente il numero di amputazioni chirurgiche dovute a lesioni gangrenose (22).
L’ozono è considerato uno dei più potenti antiossidanti in natura (19). Lo squilibrio tra sostanze ossidanti e agenti antiossidanti favorisce accumulo di ROS e aumento dello stress ossidativo e questo gioca un ruolo importante nei pazienti con lichen planus. Inoltre, l’ozono riduce la sensazione dolorosa eliminando i mediatori infiammatori (3) e favorisce una risposta rapida nei processi di riparazione quando viene applicato sulle ferite sia a livello dei tessuti molli, ad esempio dopo radioterapia, sia a livello osseo, ad esempio in caso di osteonecrosi dei mascellari da bifosfonati (18, 20). Per tutte queste proprietà, l’ozono è stato introdotto come opzione di trattamento per la gestione del lichen planus orale (21). A tal proposito, uno degli studi più recenti e significativi è quello di Tarun Kumar e colleghi (19). che hanno condotto uno studio longitudinale sull’efficacia dell’olio ozonizzato nel trattamento di varie lesioni e condizioni orali al fine di stabilire la frequenza e la durata dell’applicazione richiesta dell’olio ozonizzato per la gestione dei casi. Un totale di 50 pazienti con candidosi orali, cheiliti angolari, afte ricorrenti, lichen planus orale e herpes labiale sono stati inseriti nello studio e seguiti per un anno con follow-up a sei mesi. Il protocollo prevedeva sciacqui con acqua distillata e applicazione topica di olio ozonizzato sulla lesione isolata con massaggio per un minuto due volte al giorno. A ogni richiamo, tutti i segni e sintomi dei pazienti come bruciore e dimensione delle lesioni venivano valutati, registrati e comparati. Tutti i pazienti con candidosi, cheilite angolare, ulcere aftose ed herpes labiale hanno mostrato il 100% di guarigione con durata variabile di trattamento. Tutti i cinque pazienti con lichen planus orale hanno dimostrato significativi miglioramenti in segni e sintomi con una drastica riduzione nella sensazione urente in 4-6 giorni circa19.
Clorexidina
La clorexidina è una sostanza di sintesi ad azione disinfettante appartenente alla classe dei bisbiguanidi cationici. Essa rappresenta l’antibatterico più efficace presentando un ampio spettro d’azione che comprende GRAM+, GRAM-, lieviti, dermatofiti e alcuni virus lipofili (25, 26). La proprietà principale della clorexidina è la sostantività, ossia la capacità di legarsi ed essere assorbita dai tessuti, consentendo una durata d’azione fino a cinque ore e una permanenza nel cavo orale fino alle 12 ore (25). Nel dettaglio, essa agisce andando ad alterare la membrana cellulare batterica, provocandone una modificazione della permeabilità e la rottura, con conseguente perdita di materiale cellulare e morte del microorganismo. La clorexidina, quindi, a seconda delle dosi, è capace di esercitare un’azione batteriostatica e battericida.
In ambito odontoiatrico la clorexidina è utilizzata sia a scopi terapeutici che preventivi ed esiste in varie formulazioni come gel gengivali e dentali, dentifrici, collutori. In questi prodotti, la clorexidina si trova in forma di gluconato o di digluconato in concentrazioni che possono variare dallo 0,12% allo 0,2%, ma vi sono prodotti che ne possono contenere concentrazioni inferiori o superiori (0,5%). Per questi scopi i dosaggi ideali vanno dai 18 ai 20 mg per applicazione, che massimizzano l’efficacia diminuendo gli effetti avversi (27). I trattamenti in cui è indicato l’utilizzo della clorexidina sono vari. È utilizzata principalmente per la cura dell’igiene orale nei soggetti con gravi disturbi mentali o in aggiunta allo scaling e root planing e a seguito di interventi parodontali, soprattutto in pazienti defedati (25). Alle concentrazioni 0.1-0.2 % dimostra un efficace effetto antiplacca e antinfiammatorio, utile nella cura e prevenzione delle gengiviti e delle carie. È consigliata per irrigazioni sottogengivali, alitosi, stomatiti, ipersensibilità e mantenimento degli impianti (25, 26).
Grazie alle elevate proprietà antimicrobiche, la clorexidina rappresenta il gold standard nella prevenzione dei disturbi parodontali.
Essa, infatti, nella formulazione di collutorio, è in grado di neutralizzare i principali patogeni parodontali Staphylococcus aureus, Porphyromonas gingivalis e Prevotella intermedia (25, 27).
Inoltre, data la capacità di agire contro alcune specie di Candida, secondo alcuni studi la clorexidina rappresenterebbe un trattamento indicato per le lesioni erosive orali che possono andare incontro a sovra infezione batterica e fungina, come nel caso di lichen planus orale. In questo caso, la clorexidina viene somministrata soprattutto in associazione con corticosteroidi, farmaci di prima linea nel trattamento del lichen planus orale, che hanno come principale effetto avverso la candidosi secondaria (5, 6).
Tuttavia, è importante considerare che la clorexidina è associata a effetti avversi legati soprattutto a un suo utilizzo prolungato. Tra questi ci sono alterazioni cromatiche estrinseche dei denti e delle mucose, alterazioni del gusto, allergie e ipersensibilità di tipo IV25, ma anche desquamazione delle mucose, dolore, aumento della formazione di tartaro (28), bocca urente e secchezza orale che possono indurre colonizzazione batterica e infezioni nel cavo orale.
Un altro serio problema emergente è lo sviluppo di resistenza antimicrobica. Bassi livelli di esposizione alla clorexidina possono provocare cross-resistenza agli antibiotici, in particolare questo si manifesta in alcuni microrganismi quali Enterococcus faecium, Staphylococcus aureus, Enterobacter spp. che possono formare biofilm farmaco-resistenti capaci di dare patologie dentali (27).
Recenti studi in vitro dimostrano che l’effetto della clorexidina nel controllo del biofilm orale è temporaneo; inoltre, trattandosi di un antisettico ad ampio spettro, può colpire e alterare il microbiota endogeno orale aumentando il rischio di disbiosi microbiche con conseguenti disturbi orali (28).
Fin dal 1970, numerosi studi hanno riportato la presenza di ripercussioni citotossiche e genotossiche su vari gruppi cellulari quali fibroblasti, osteoblasti, macrofagi e leucociti che si traducono in un rallentamento della guarigione delle mucose. L’effetto induce significativi cambiamenti morfologici nei fibroblasti gengivali, compromettendo la normale riparazione dei tessuti (26, 28).
Andrea Pilloni e colleghi hanno eseguito uno studio pilota in vivo su tre pazienti per supportare questi studi in vitro. Le loro analisi biomolecolari su biopsie mostrano che l’utilizzo di clorexidina induce aumento dell’espressione del gene pro-apoptotico BAX, dei marker d’espressione fibrotica e differenziazione dei miofibroblasti.
Inoltre, emerge che anche solo dopo due sciacqui con clorexidina 0.12% 24 ore dopo la lesione, il normale processo di riparazione viene alterato portando a una guarigione di tipo cicatriziale (28). Per questo motivo l’utilizzo della clorexidina non sembra essere adeguato nel trattamento delle ulcere.
Case report
A supporto degli studi sopra riportati sull’efficacia del trattamento delle lesioni erosive con olio ozonizzato e degli effetti avversi della clorexidina sulla rigenerazione dei tessuti, riportiamo il caso di una paziente donna di 38 anni con lesioni simil lichenoidi persistenti da circa 20 giorni.
A una prima anamnesi la paziente riferiva di non avere particolari condizioni patologiche. Solamente alla seconda anamnesi, più approfondita, si apprendeva che da alcuni mesi la stessa fosse sottoposta a forti terapie ormonali per problemi ginecologici.
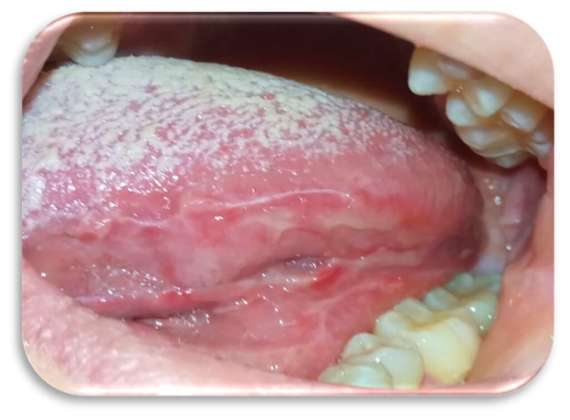
Inizialmente la paziente era stata trattata con collutorio a base di clorexidina 0,2% per circa 12 giorni senza alcun beneficio. Le lesioni si presentavano molto dolenti, erosive ed eritematose bilateralmente e simmetricamente sul ventre linguale (Figure 1 e 2) e sulla mucosa geniena, compatibili con un sospetto quadro clinico di lichen planus orale erosivo.
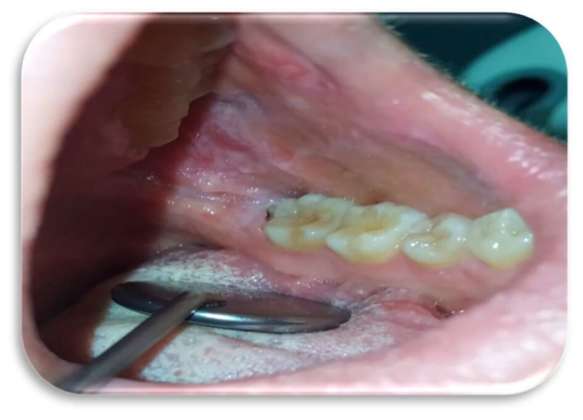
Sia sui margini linguali che sulle mucose geniene erano presenti, inoltre, segni di morsicatio buccarum e linea alba (Figure 3 e 4).
Giunta alla nostra osservazione, alla paziente era stato sospeso l’uso della clorexidina e si era programmata una biopsia incisionale a una settimana di distanza, per valutazione istologica. Nel frattempo, come lenitivo era stato prescritto l’uso di gel a base di olio di oliva ozonizzato (Ialozon gel orale, Gemavip, Cagliari, Italy) da applicare due volte al giorno fino all’intervento bioptico.
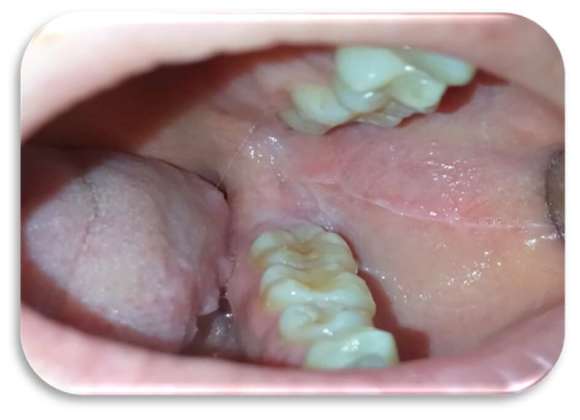
Al quarto giorno di applicazione, la paziente riportava un notevole miglioramento sintomatologico. A sette giorni c’era stata una regressione completa delle lesioni (Figure 5-6), con mucosa integra e normocromatica dove residuava linea alba a livello genieno e linguale (Figure 7-8), per la quale era stato consigliato alla paziente l’uso di un bite inferiore in resina morbida per evitare ulteriori traumi ai tessuti molli.
Il follow-up a un mese confermava la totale assenza di lesioni. Non avendo avuto la possibilità di fare un accertamento e un’indagine istologica, non possiamo validare del tutto la nostra ipotesi diagnostica di lesione da lichen planus o da lichenoide. Tuttavia, la paziente era stata avvertita di ricontattarci nel caso in cui fossero ricomparse le lesioni.
Discussione
Il lichen planus orale è un disturbo muco-cutaneo infiammatorio cronico a carattere autoimmune (1, 2) ampiamente diffuso a livello globale con un’incidenza stimata tra l’1.01% (4, 5) e il 3.6% (1).
Sebbene possa colpire tutte le fasce di età ed entrambi i sessi, il lichen planus presenta una maggiore incidenza tra la quarta e la settima decade di vita e una frequenza maggiore nelle donne, con una predilezione che va dal 61 all’80% (1, 6).
Sebbene l’eziologia non sia completamente nota (3,7), una serie di fattori è stata identificata come predisponente per la sua comparsa, tra cui virus HCV, diabete, materiali di restauro, farmaci, predisposizione genetica e disordini psicologici come stress, ansia e depressione, che possono alterare i meccanismi fisiologici peggiorando il quadro delle patologie autoimmuni (3).
Anche alterazioni ormonali sembrano apportare importanti cambiamenti a livello delle mucose. In particolare, nelle donne, che vanno fisiologicamente incontro a continui cambiamenti nei livelli ormonali nelle varie fasi della vita, si possono vedere alterazioni strutturali della mucosa orale. Quest’ultima, infatti, è un eccellente indicatore dello stato di salute del paziente in quanto la mucosa cheratinizzata e non cheratinizzata è sotto l’influenza trofica di vari ormoni, soprattutto di quelli sessuali (29). I disordini più di frequente associati a queste variazioni sono le ulcere aftose.
Dallo studio di Balan Usha e colleghi emerge che il 30% su un campione di 40 pazienti donne con ciclo mestruale regolare riportava ulcere a livello delle mucose orali. La correlazione tra afte ulcerose e mestruazioni viene confermata da molti altri studi e sembra essere spiegata dai cambiamenti dei livelli di progesterone e all’abbassamento delle difese immunitarie (29). Il trattamento di prima scelta per il lichen planus orale ricade tradizionalmente sui glucocorticoidi topici per le forme rosse, atrofiche o erosive (1,7,15) o sistemici per le forme più esacerbate e resistenti (1, 2, 3, 7, 8).
È fortemente consigliata, con questi farmaci, l’associazione di preparazioni antifungine di clorexidina, poiché tra gli effetti avversi più frequenti, conseguenti alla loro somministrazione, vi è la candidosi secondaria.
Per quanto riguarda i corticosteroidi topici e sistemici, tra gli effetti avversi troviamo atrofia con assottigliamento delle mucose, sovra infezione con candidosi secondaria, alterazione del gusto, sensazione urente (5, 10) e complicanze sistemiche quali soppressione adreno-corticale, ipertensione, iperglicemia, aumento di peso, insonnia, alterazioni dell’umore, irritazioni gastro-intestinali, osteoporosi (7).
Anche la clorexidina, classicamente somministrata insieme con i corticosteroidi per prevenire le sovrainfezioni da candida, sembra avere effetti dannosi nella rigenerazione dei tessuti, se utilizzata in maniera continuativa per lunghi periodi (5, 7). Questi includono bocca urente e secchezza orale, ma soprattutto, come dimostrato da vari studi in vitro, il suo effetto citotossico e genotossico ha ripercussioni anche sui fibroblasti e osteoblasti, andando a rallentare la guarigione delle mucose (26). Questo lo renderebbe inadeguato nel trattamento delle lesioni ulcerose.
Sebbene i farmaci tradizionali si siano sempre mostrati efficaci nel trattamento delle lesioni simil lichenoidi, la frequenza degli effetti avversi e l’impossibilità di utilizzarli nel trattamento di pazienti con condizioni di salute particolari come stato di gravidanza, condizioni sistemiche complicate, allattamento, glaucoma, infezioni erpetiche, tubercolosi, diabete mellito, HIV, ipertensione (7,10) ha spinto la letteratura a cercare soluzioni terapeutiche diverse e più sicure (3, 5, 10, 16).
Per cui, al contrario dei protocolli farmacologici classici, attualmente sta prendendo sempre più spazio il trattamento alternativo con ozono, specialmente nella formulazione in olio ozonizzato (23). Tra i numerosi effetti terapeutici mostrati da questo trattamento, vi sono elevata capacità antibatterica ad ampio spettro (23), un’importante azione antiossidante9, anti-ipossica, immunostimolante e antiinfiammatoria (21, 23) nonché azione di biosintesi (21), bio-regolazione (22).
Inizialmente l’efficacia dell’ozono nel trattamento delle lesioni erosive simil-lichenoidi è stata valutata in combinazione con i corticosteroidi (3). Lo studio prospettico randomizzato in doppio cieco di Budakoti e colleghi del 2022 ha valutato l’efficacia della somministrazione di olio ozonizzato in associazione con steroidi sistemici nel trattamento del lichen orale erosivo (21) su un campione di 80 pazienti: la combinazione delle due terapie è risultata più efficace nella riduzione della dimensione delle lesioni e nel miglioramento della sensazione di dolore e bruciore rispetto all’utilizzo dei soli corticosteroidi (21). Inoltre, l’associazione con l’ozono ha il vantaggio di offrire lo stesso effetto antifungino della clorexidina senza, però, il rischio degli effetti avversi ad essa associati.
Studi in vitro mettono a confronto l’efficacia dell’ozono e della clorexidina e dimostrano che l’ozono ha una maggiore efficacia antimicrobica, specialmente contro i ceppi batterici dello Staphylococco aureo e il Porphyromonas gingivalis, azione antinfiammatoria e assenza di effetti avversi. Si può attestare che l’ozono possieda proprietà antimicrobiche e antinfiammatorie tali da poter essere considerato, secondo le linee guida dell’Associazione Dentale Americana, un chemioterapico adatto per il trattamento delle gengiviti al pari della clorexidina (20). Successivamente, in numerosi studi è stata valutata l’efficacia del trattamento delle lesioni da lichen planus con il solo olio ozonizzato. Da questi articoli emerge che con la nuova terapia non farmacologica si ottiene lo stesso effetto analgesico e rigenerativo delle lesioni, ma in più si ha il vantaggio di non avere effetti avversi e di garantire una guarigione migliore dei tessuti (20). L’olio ozonizzato, infatti, non ha effetti distruttivi o irritativi sui tessuti (23) anzi, dimostra di garantire un migliore stato di salute delle mucose.
La sicurezza dell’ozono è confermata da molteplici studi presenti in letteratura che hanno valutato l’assenza di effetti avversi con trial clinici anche in pazienti immunosoppressi, diabetici e con comorbidità che aggravano la prognosi di una lesione preesistente (22).
Oltre ai numerosi meccanismi d’azione terapeutici dell’olio ozonizzato sopra citati, è importante anche sottolineare che non invasività e sicurezza della terapia con ozono consentono di ridurre ansia e stress nei pazienti e questo favorisce una maggiore risposta al trattamento (3, 7). Difatti, a conferma della teoria di Koray e colleghi secondo cui lo stress sarebbe la principale causa di comparsa di lesioni lichenoidi erosive, pazienti con alti livelli di stress non mostrano significative risposte alle terapie (18).
Non conosciamo per certo la natura del disturbo della paziente del caso da noi trattato. Sappiamo che vi era una correlazione temporale e una manifestazione tipica lichenoide. Possiamo tuttavia confermare che l’ozono può essere usato in totale sicurezza anche per il trattamento di erosioni dove la causa non sia necessariamente di carattere immunologico.
Conclusioni
L’ozono, soprattutto in forma di olio ozonizzato, ha dimostrato spiccate proprietà benefiche sulla salute e sulla rigenerazione dei tessuti lesi, agendo a vari livelli come antinfiammatorio, analgesico, anti-ipossico e antimicrobico ad ampio spettro.
La sua grande efficacia e l’assenza di effetti avversi lo rendono un ottimo sostituto dei corticosteroidi e delle tradizionali terapie farmacologiche nel trattamento delle lesioni erosive simil lichenoidi. Inoltre, l’ozono ha effetti antimicotici e antibatterici simili, e in certi casi maggiori, alla clorexidina, per cui il suo utilizzo può essere esteso a più campi di applicazione.
Abstract
Treatment-of-oral-bilateral-erosive-lesions-lichenoid-like-with-ozonized-oil
Oral Lichen Planus (OLP) is a chronic inflammatory autoimmune mucocutaneous disorder. Its manifestation is characterized by the presence of white or red papules which progressively thicken with periods of exacerbation, with acute and burning pain, and of remission, in which the symptoms are relieved. OLP’s treatment varies according to its manifestation. Due to the idiopathic nature of the OLP, no definitive and completely resolving therapy has currently been identified. Oral Lichenoid Lesions (OLL), on the other hand, are T-mediated hypersensitivity lesions in response to restorative materials such as amalgam. Before starting any treatment it is essential to perform a complete clinical examination in order to correct any possible irritating factors. Ozone is a gaseous molecule composed of three oxygen atoms that has shown an important efficacy in the treatment of various medical and dental pathologies and, as it has a relevant antioxidant, anti-hypoxic, immunostimulant and anti-inflammatory action, it is gradually acquiring more and more clinical relevance. Chlorhexidine is a disinfectant substance belonging to the class of cationic bisbiguanides. It represents the most effective antiseptic as it has a broad spectrum of action which includes bacteria GRAM + and Gram-, yeasts and some viruses. However, its prolonged use over time, especially at higher concentrations, is associated with a slowdown in the healing of the mucous membranes. We report the case of a patient with persistent lichenoid-like lesions, supporting the previous cited studies on the effectiveness of the treatment of erosive lesions with ozonated oil and the adverse effects of chlorhexidine on tissue regeneration. Our case report reflects the results of studies in the literature: the treatment with ozonated oil has proved extremely useful in the treatment of lichenoid-like lesions of the patient, leading to a drastic reduction in pain and injury size. The use of ozonated oil should be more promoted in the treatment of erosive disorders of the oral cavity.
1. García-Pola MJ, González-Álvarez L, Garcia-Martin JM. Treatment of oral lichen planus. Systematic review and therapeutic guide. Med Clin (Barc). 2017 Oct 23;149(8):351-362. English, Spanish.
2. Solimani F, Forchhammer S, Schloegl A, Ghoreschi K, Meier K. Lichen planus – a clinical guide. J Dtsch Dermatol Ges. 2021 Jun;19(6):864-882.
3. Lima MR, Hoffmann SMS, Studzinski MS, Passoni GNS. Oral lichen planus from diagnosis to treatment. Craniofacial Research Connection Journal. 2022;2(33-40)
4. De Porras-Carrique T, Ramos-García P, Aguilar-Diosdado M, Warnakulasuriya S, González-Moles MÁ. Autoimmune disorders in oral lichen planus: A systematic review and meta-analysis. Oral Dis. 2023 May;29(4):1382-1394.
5. Kakoei S, Karbasi N, Raeiszadeh M, Tajadini H, Nekouei AH. The efficacy of henna (Lawsonia inermis L.) mouthwash versus chlorhexidine gluconate 0.2% mouthwash as adjuvant therapy of oral lichen planus: A randomized double-blind clinical trial. J Ethnopharmacol. 2022 May 23;290:115037.
6. Netto JNS, Pires FR, Costa KHA, Fischer RG. Clinical features of oral lichen planus and oral lichenoid lesions: an oral pathologist’s perspective. Braz Dent J. 2022 May-Jun;33(3):67-73.
7. Rotaru D, Chisnoiu R, Picos AM, Picos A, Chisnoiu A. Treatment trends in oral lichen planus and oral lichenoid lesions (Review). Exp Ther Med. 2020 Dec;20(6):198.
8. Garma M, Hasni W, Annabi B, et al. Isolated lichen planus of the lips: Cases reports and literature review. 2020 Journal of Oral Medicine and Oral Surgery 26(2):14
9. Veneri F, Bardellini E, Amadori F, Conti G, Majorana A. Efficacy of ozonized water for the treatment of erosive oral lichen planus: a randomized controlled study. Med Oral Patol Oral Cir Bucal. 2020 Sep 1;25(5):e675-e682.
10. Kalaskar AR, Bhowate RR, Kalaskar RR, Walde SR, Ramteke RD, Banode PP. Efficacy of Herbal Interventions in Oral Lichen Planus: A Systematic Review. Contemp Clin Dent. 2020 Oct-Dec;11(4):311-319.
11. Müller S. Oral manifestations of dermatologic disease: a focus on lichenoid lesions. Head Neck Pathol. 2011 Mar;5(1):36-40.
12. Offen E, Allison JR. What is the malignant transformation potential of oral lichen planus? Evid Based Dent. 2022 Mar;23(1): 36-37.
13. Rotim Z, Bolanca Z, Rogulj AA, Andabak M, Boras VV, Vrdoljak DV. ORAL LICHEN PLANUS AND ORAL LICHENOID REACTION–AN UPDATE. Acta Clin Croat. 2015 Dec;54(4): 516-20.
14. Klaisiri A, Iamaroon A, Neff A, Pitak-Arnnop P. Oral lichenoid lesion related to dental amalgam: A case report. J Stomatol Oral Maxillofac Surg. 2019 Dec;120(6):591-594.
15. Oberti L, Alberta L, Massimo P, Francesco C, Dorina L. Clinical Management of Oral Lichen Planus: A Systematic Review. Mini Rev Med Chem. 2019;19(13):1049-1059.
16. Sridharan K, Sivaramakrishnan G. Interventions for oral lichen planus: A systematic review and network meta-analysis of randomized clinical trials. Aust Dent J. 2021 Sep;66(3):295-303.
17. Łukaszewska-Kuska M, Ślebioda Z, Dorocka-Bobkowska B. The effectiveness of topical forms of dexamethasone in the treatment of oral lichen planus- A systematic review. Oral Dis. 2022 Nov;28(8):2063-2071.
18. Kazancioglu HO, Erisen M. Comparison of Low-Level Laser Therapy versus Ozone Therapy in the Treatment of Oral Lichen Planus. Ann Dermatol. 2015 Oct;27(5):485-91.
19. Kumar T, Arora N, Puri G, Aravinda K, Dixit A, Jatti D. Efficacy of ozonized olive oil in the management of oral lesions and conditions: A clinical trial. Contemp Clin Dent. 2016 Jan-Mar;7(1):51-4.
20. Bulani MB, Shetiya SH, Agarwal D. Efficacy of ozone oil compared with chlorhexidine gluconate gel (1% w/w) for the treatment of gingivitis: Randomized controlled trial. J Indian Assoc Public Health Dent 2022;20:95-9
21. Budakoti A, Choudhary A, Puri N, Gaur A, More CB, Khanna KS. Assessment of effectiveness of Ozonated olive oil fused with corticosteroids for the management of oral erosive lichen planus: A novel approach. Int J Health Sci 2022 6(S1), 1285-1296. https://doi.org/10.53730/ijhs.v6nS1.4879
22. Anzolin AP, da Silveira-Kaross NL, Bertol CD. Ozonated oil in wound healing: what has already been proven? Med Gas Res. 2020 Jan-Mar;10(1):54-59.
23. Alexandrina E, Poroyskiy S, Makedonova Y, Veremeenko S. Efficacy of ozone therapy in treatment of erosive and ulcerative lesions of oral mucosa. Archiv Euromedica 2020 vol. 10 (2), 67-69. http://dx.doi.org/10.35630/2199-885X/2020/10/2.20
24. Sen S, Sen S. Ozone therapy a new vista in dentistry: integrated review. Med Gas Res. 2020 Oct-Dec;10(4):189-192.
25. Thangavelu A, Kaspar SS, Kathirvelu RP, Srinivasan B, Srinivasan S, Sundram R. Chlorhexidine: An Elixir for Periodontics. J Pharm Bioallied Sci. 2020 Aug;12(Suppl 1):S57-S59.
26. Da Silveira Teixeira D, de Figueiredo MAZ, Cherubini K, de Oliveira SD, Salum FG. The topical effect of chlorhexidine and povidone-iodine in the repair of oral wounds. A review. Stomatologija. 2019;21(2):35-41.
27. Poppolo Deus F, Ouanounou A. Chlorhexidine in Dentistry: Pharmacology, Uses, and Adverse Effects. International Dental Journal, 72(3), 269-277. https://doi.org/10.1016/j.identj.2022.01.005
28. Pilloni, A.; Ceccarelli, S.; Bosco, D.; Gerini, G.; Marchese, C.; Marini, L.; Rojas, M.A. Effect of Chlorhexidine Digluconate in Early Wound Healing of Human Gingival Tissues. A Histological, Immunohistochemical and Biomolecular Analysis. Antibiotics (Basel) 2021 Oct 1;10(10):1192
29. Balan U, Gonsalves N, Jose M, Girish KL. Symptomatic changes of oral mucosa during normal hormonal turnover in healthy young menstruating women. J Contemp Dent Pract. 2012 Mar 1;13(2):178-81.