Molti motivi spingono i ricercatori ad approfondire l’applicazione del laser nelle procedure di chirurgia orale e implantologia. Nello specifico, si avverte la necessità di realizzare protocolli ampiamente validati che prevedono l’uso del laser per la decontaminazioni di siti infetti finalizzata al posizionamento di impianti di tipo 1. In questo aggiornamento monografico, dopo una revisione della letteratura viene presentato uno studio clinico controllato che dimostra come il posizionamento immediato di un impianto in un sito post-estrattivo infetto o infiammato, dopo la decontaminazione laser, non sembra aumentare il rischio di fallimento
Sabrina De Michele
Odontoiatra presso l’Istituto Stomatologico Italiano, Milano
Riccardo Aiuto
Odontoiatra presso l’Istituto Stomatologico Italiano, Milano. Dottore di ricerca, Università di Valencia, Spagna
María Peñarrocha-Diago
Professore di Chirurgia orale presso l’Università di Valencia, Spagna
Miguel Peñarrocha-Diago
Cattedratico di Chirurgia Orale presso l’Università di Valencia (Spagna)
Francesca Angiero
Professore ordinario di Malattie odontostomatologiche, Università degli Studi di Genova
Rolando Crippa
Direttore dal 1994 al 2021 del Reparto di Patologia orale e Laserterapia dell’Istituto Stomatologico Italiano e Professore a c. presso l’Università degli Studi di Genova
Corrispondenza: riccardo.aiuto@unimi.it
Il posizionamento immediato di un impianto in un sito post-estrattivo, denominato impianto di tipo 1 secondo la classificazione di Hämmerle del 2004, rappresenta al giorno d’oggi una procedura chirurgica comune, nonché una scelta terapeutica valida per riabilitare quei pazienti in cui vi sia la necessità di sostituire elementi dentari compromessi. La metodica può essere, quindi, presa in considerazione nei casi in cui vi sia una franca indicazione all’estrazione dentaria, come nel caso di frattura verticale di radice, oppure quando nessun approccio conservativo, compresa la chirurgia periapicale, abbia portato al successo clinico desiderato. Diversi studi hanno dimostrato come questa tecnica abbia un alto tasso di successo e presenti numerosi vantaggi, come la riduzione della perdita ossea alveolare e delle modifiche morfologiche della cresta ossea, la diminuzione dei tempi di trattamento e dei costi, oltre che un minore discomfort da parte del paziente e buoni risultati estetici [Carlsson et al. 1967].
Oggi, infatti, a pazienti che presentano osso alveolare di una certa quantità e qualità, tale da garantire stabilità primaria, possiamo applicare il protocollo implantare post-estrattivo senza dover attendere la completa guarigione del tessuto osseo. Diversi studi clinici sugli esseri umani hanno dimostrato alti livelli di successo per impianti inseriti in alveoli post- estrattivi [Corbella et al. 2013]. In alcuni casi, è stato proposto anche il carico immediato degli impianti post-estrattivi, riportando risultati positivi e molto incoraggianti, come la riduzione dei tempi di trattamento, il ripristino della funzione fonetica e dell’estetica, un miglior adattamento dei tessuti molli all’impianto e l’assenza di manipolazione dell’abutment durante la fase di guarigione [Werbitt et al. 1992; Al Sawai et al. 2016]. Tradizionalmente diversi autori raccomandano di non posizionare impianti in alveoli post-estrattivi che mostrino segni di infezione [Barzilay I 1993]. Numerosi studi, tuttavia, riportano un’elevata percentuale di successo anche per impianti post- estrattivi inseriti in siti infetti o infiammati, con e senza carico immediato.
Un crescente numero di autori ha iniziato infatti a proporre diversi protocolli, alcuni dei quali prevedono l’impiego del laser, per la decontaminazione dei siti infetti finalizzata al posizionamento di impianti di tipo 1. Sebbene la tecnica di posizionamento dell’impianto post-estrattivo sia stata ampiamente convalidata, poco è stato riportato in relazione alle applicazioni della decontaminazione laser nei siti infetti per il posizionamento immediato dell’impianto.
È bene notare come ci si trovi sempre più spesso a estrarre denti con infezioni persistenti, quando anche i migliori trattamenti conservativi falliscono. Se il dente è da estrarre, allora la contaminazione batterica sarà quasi sempre presente. Questo giustifica il trend della ricerca verso la realizzazione di protocolli ampiamente validati per il posizionamento di impianti di tipo 1 in siti infetti.
Revisione della letteratura
Impianti dentali in siti infetti
Tra i vari studi che indagano la possibilità di inserire gli impianti in siti post-estrattivi con infezione, va citato il lavoro di Corbella et al. condotto con l’obiettivo di valutare e discutere l’esito clinico degli impianti di tipo 1 in alveoli infetti: la ricerca ha mostrato come, anche in siti con parodontite apicale di origine endodontica, l’inserimento immediato di un impianto, dopo l’estrazione del dente e un attento sbrigliamento dell’alveolo, possa avere un successo clinico paragonabile a quello degli impianti posizionati in siti senza segni di infezione.
Le conclusioni incoraggiano l’uso di impianti di tipo 1 in siti infetti nonostante la presenza dell’infezione, sia essa di origine parodontale o endodontica.
Una revisione sistematica della letteratura condotta da Chen et al. nel 2018 (Tabella 1) aveva come obiettivo quello di analizzare i risultati del posizionamento immediato di impianti in alveoli post-estrattivi con o senza infezione parodontale o periapicale in zona estetica per capire se l’inserimento in un sito infetto comportasse un rischio maggiore di fallimento, e anche quello di indagare protocolli di trattamento basati su studi attuali per migliorare la prognosi. Sono state tratte le seguenti conclusioni: rispetto ai controlli sani, gli impianti immediati in siti infetti avevano tassi di sopravvivenza simili, rivelando una uguale integrazione dei tessuti duri e molli intorno agli impianti.
| Tabella 1 – Caratteristiche e valutazioni di qualità degli studi inclusi | |||||||||
| NOS Score | |||||||||
| Study | Patients, n | Age range, mean, y | Follow-up, mo | Implant type | No. Of implants | Selection | Comparability | Exposure/Outcome | Total Score |
| Crespi et al. 2010 | 30 | 51.2 (34-71) | 24 | Seven, Sweden-Martina | 30 | 3 | 1 | 3 | 7 |
| Crespi et al. 2010 | 37 | 52.5 (32-71) | 48 | Titanium plasma spray, Sweden-Martina | 275 | 3 | 1 | 3 | 7 |
| Bell et al. 2011 | 655 | I: 58.4N: 60.1 | 19.75 (3-93) | Straumann tissue or bone-level SLA implants | 922 | 2 | 1 | 2 | 5 |
| Fugazzotto et al. 2012 | 64 | 46 (21-71) | I: 64 (24-117)N: 62 (24-120) | NM | 128 | 2 | 2 | 3 | 7 |
| Jung et al. 2013 | 27 | I: 53 (31-87)N: 60 (28-82) | 60 | Straumann AG, Basel, Standard plus or tapered effect | 27 | 3 | 1 | 2 | 6 |
| Montoya-Salazar et al. 2014 | 18 | 18-50 | 36 | Titanium C1 implants, MI5 Ibérica | 36 | 3 | 2 | 3 | 8 |
| Hita-Iglesias et al. 2015 | 60 | 48.4 (18-72) | 12 | Zimmer Dental SwissPlus | 168 | 3 | 2 | 3 | 8 |
| Blus et al 2015 | 86 | 26-77 | 12 | Leader, Bioner | 168 | 3 | 0 | 2 | 5 |
| Zuffetti et al. 2017 | 369 | 54.5 (22.8-81.9) | I: 50.1 (1.6-146.1)N: 53.2 (0.9-158.3 | Biomet 31 (Warsaw); BioHorizons (Birmingham); Nobel Biocare (Gotheborg); Astra Tech (Dentsplay Sirona); Megagen (Englewood Cliffs); Neoss (Harrogate) | 527 | 2 | 1 | 2 | 5 |
| I, infected group; N, noninfected group; NM, not mentioned; NOS: Newcastle-Ottawa scale | |||||||||
Dati estrapolati da Chen et al. Immediate placement of dental implants into infected versus noninfected sites in the esthetic zone: A systematic review and meta-analysis . J Prosthet Dent. 2018 120(5):658-667. Rispetto ai controlli sani, gli impianti immediati in siti infetti avevano tassi di sopravvivenza simili, rivelando un uguale integrazione dei tessuti duri e molli intorno agli impianti
Una ricerca condotta dagli autori di questo aggiornamento monografico, attraverso gli studi pubblicati in letteratura, ha prodotto solo cinque articoli clinici che combinavano il trattamento laser alla terapia implantare immediata (Tabella 2).
Tabella 2 - Articoli sul trattamento laser e impianti post-estrattivi
| Author | Study design | Infected sites | Laser | Implants (no.) | Follow-up | Survival rate |
| Kusek | Case series | Yes | Er,Cr:YSGG | 10 | 1 year | 10/10 |
| Montoya- Salazar et al. | Prospective | Yes | Er,Cr:YSGG | 18 | 3 years | 17/18 |
| Crippa et al. | Case series | Yes | Er,Cr:YSGG | 94 | 6 months/4 years | 89/94 |
| Choi et al. | Case series | No | Nd:YAG | 6 | 9 months | 6/6 |
| Kakar et al. | Case series | Yes | Er,Cr:YSGG | 110 | 4 months/5 years | 105/110 |
I laser Er,Cr:YSGG e Nd:YAG sono tra i più utilizzati nel debridement del sito post estrattivo: l’effetto fotoacustico prodotto riduce la presenza di batteri e decontamina il sito post-estrattivo, dimostrando superiorità in efficacia rispetto al trattamento chimico.
Kusek è stato uno dei primi autori ad approfondire l’argomento e ha presentato 10 casi di impianti post-estrattivi sottoposti alla terapia di disinfezione laser Er,Cr:YSGG, affermando che questi casi avrebbero impiegato tre volte di più a guarire se trattati con metodi tradizionali.
Questa tecnica consentirebbe, quindi, sia al paziente che all’odontoiatra di beneficiare di un ridotto tempo di trattamento [Kusek et al. 2011; Crippa et al. 2020].
I laser principalmente utilizzati in implantologia
L’invenzione del laser si deve a Maimann che per primo nel 1960 ha messo a punto un laser a rubino pulsato che emetteva a 694nm. Le prime applicazioni del laser in campo odontoiatrico risalgono agli inizi degli anni Sessanta con l’uso del laser a rubino, che sfortunatamente produceva dannosi effetti termici. A quel tempo mancava ancora una precisa conoscenza dei bersagli d’azione e delle curve di assorbimento delle lunghezze d’onda dei vari laser [Maggioni et al. 2021].
L’introduzione della tecnologia laser nella chirurgia dei tessuti molli è dovuta alla collaborazione tra chirurghi orali e maxillo-facciali e otorinolaringoiatri. Nel 1987 la FDA diede il permesso di impiegare la tecnologia laser in chirurgia orale.
Alla fine degli anni Ottanta ci fu una rivoluzione epocale con lo sviluppo dei laser Er:Yag che, per la loro affinità elettiva con l’acqua, consentivano un’enorme capacità di utilizzo in odontoiatria e in dermatologia [Keller et. al. 1997].
La lunghezza d’onda è il parametro più importante di un laser. I laser in ambito medico coprono praticamente l’intero spettro di radiazioni elettromagnetiche, mentre in odontoiatria i più utilizzati rientrano nello spettro del visibile e nel vicino e medio infrarosso (Tabella 3).
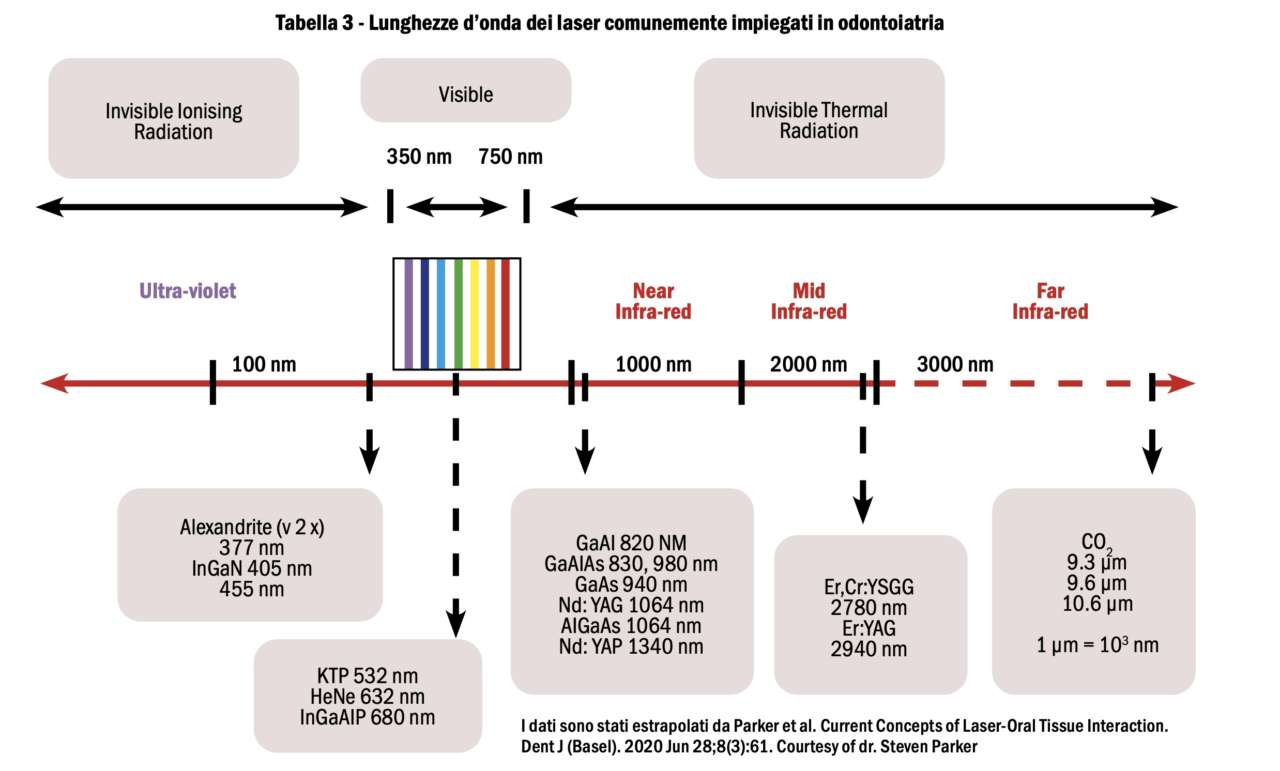
I laser principalmente utilizzati in implantologia sono laser a diodi a semiconduttore, laser a stato solido Nd:YAG, Nd:YAP, Er:YAG, Er,Cr:YSGG e laser a gas, come i laser a CO2. I laser che possono essere utilizzati sui tessuti molli con eccellenti proprietà di coagulazione sono laser a diodi, a CO2 e laser Nd:YAG e Nd:YAP; Er:YAG e Er,Cr:YSGG sono laser maggiormente impiegati sui tessuti duri a causa dell’elevato assorbimento da parte dell’idrossiapatite [Romanos et al. 2013].
Decontaminazione laser dei siti infetti post-estrattivi per l’implantologia immediata
I vantaggi proposti dall’uso del laser in implantologia includono una migliore emostasi, un più preciso margine di incisione, un danno minimo ai tessuti circostanti e un ridotto edema postoperatorio. L’effetto del laser, inoltre, viene utilizzato per la decontaminazione batterica. Numerosi studi, infatti, hanno dimostrato l’efficacia del laser contro diversi tipi di batteri e per il trattamento della parodontite e perimplantite [Romanos et al 2013] (Tabella 4).
Tabella 4. Effetti del Laser in Implantologia
| Study | Laser wavelength | Type of study | Effects |
| Kato et al. | CO2 | In vitro | Bacterial reduction |
| Bach et al. | Diode (810 nm) | Clinical | Pocket reduction |
| Romanos et al. | Nd:YAG | In vitro | Significant melting |
| Romanos et al. | CO2 | Clinical | Peri-implantitis therapy |
| Arnabat-Dominguez et al. | Er:YAG | In vivo | Second stage surgery |
| Schwarz et al. | Er:YAG | In vitro | Reduction in bleeding on probing |
| El Montaser et al. | Er:YAG | In vivo | No thermal damage |
| Kelser et al. | Er:YAG | In vivo | Better osseointegration |
| Lewandowski et al. | Er:YAG | In vivo | Better healing than the drill |
| Pourzarandarian et al. | Er:YAG | In vivo | Initial faster bone healing |
| Schwarz et al. | Er:YAG | In vivo | Safe (but not better) healing compared with the control |
| Romanos et al. | CO2; Er,Cr:YSGG | In vitro | Attachment of osteoblasts |
| Deppe et al. | CO2 | Clinical | Peri-implantitis therapy |
| Dorbtbudak et al. | Photodynamic therapy | In vitro | Bacteria reduction |
Dati estrapolati da Romanos GE, Gupta B, Yunker M, Romanos EB, Malmstrom H. Lasers use in dental implantology. ImplantDent. 2013 Jun;22(3):282-8.
Un altro importante vantaggio del laser è chiamato “terapia laser a basso livello” (LLLT), noto anche come soft laser o biostimolazione. Questo fenomeno è un effetto fotochimico causato dall’azione del rosso visibile (633-635 nm) o del vicino infrarosso (810-830 nm) sulla catena di trasporto degli elettroni nei mitocondri, che attiva la NADPH ossidasi e altri enzimi nella membrana mitocondriale interna e provoca un’ampia attivazione delle normali funzioni cellulari. Molti studi clinici, inclusi studi randomizzati controllati, hanno dimostrato che la biostimolazione permette di migliorare la guarigione dei tessuti molli, accelerando i processi di rimarginazione, ma anche dei tessuti duri, accelerando il turnover osseo in termini di integrazione e rigenerazione attorno agli impianti [Walsh 2003].
Esistono applicazioni per i laser in implantologia, come la seconda fase chirurgica, la rimozione dei tessuti molli perimplantari e la decontaminazione degli impianti falliti [Romanos 2015]. Diverse revisioni della letteratura di studi clinici controllati hanno verificato l’efficacia del laser nel trattamento della perimplantite. In particolare, una meta-analisi molto recente cita il laser ad erbio come uno tra i più efficaci nel trattamento delle perimplantiti [Hu et al. 2021].
Questo risultato era già stato dimostrato nella cura della malattia parodontale, ove sono stati riscontrati migliori risultati a breve termine rispetto alla terapia tradizionale [Lin et al. 2018]; anche in endodonzia il laser viene utilizzato con successo per la disinfezione dei canali radicolari [Bordea et al 2020].
È interessante notare come, dopo l’irradiazione, clinicamente non vi siano stati segni di carbonizzazione o melting sulla superficie ossea irradiata.
L’osservazione istologica dell’osso alveolare adiacente non ha rilevato alcun segno di eventuali effetti termici collaterali, come carbonizzazione, melting o cracking.
Ci sono molteplici vantaggi nell’applicazione della terapia laser a basso livello come parte di interventi chirurgici e terapia postoperatoria, quali la soppressione dei processi infiammatori, il controllo del dolore e la promozione della guarigione delle ferite e la rigenerazione tissutale [Aoki et al. 2015]. In ambito medico, una meta-analisi ha riportato che la terapia laser a basso livello è uno strumento efficace nel promuovere la riparazione delle ferite [Woodruff et al 2004].
Il miglioramento delle fasi chirurgiche e del decorso post-operatorio, la stimolazione dei tessuti alla guarigione, la decontaminazione batterica e altri vantaggi sono tra i motivi che spingono i ricercatori ad approfondire l’applicazione del laser nelle procedure di chirurgia orale e nell’implantologia.
Insieme con i vantaggi degli impianti post-estrattivi, il laser rappresenta un valido alleato nella pratica clinica quotidiana. Il primo studio clinico controllato riguardante gli impianti post-estrattivi in siti infetti e l’uso del laser per la decontaminazione è stato recentemente pubblicato dagli autori di questo aggiornamento monografico [Crippa et al. 2023].
Studio clinico controllato
Materiali e metodi
È stato condotto uno studio retrospettivo controllato con lo scopo di confrontare l’utilizzo di impianti post-estrattivi inseriti in siti infetti decontaminati con Er;Cr:YSGG laser (gruppo test) e l’utilizzo di impianti tradizionali in siti edentuli (gruppo controllo) in un campione di pazienti trattati.
In particolare, l’obiettivo dello studio era quello di mettere a confronto le differenze nei livelli di osso marginale (MBL) al momento del baseline (posizionamento dell’impianto) e del follow-up e confrontare le variabili outcome, compreso il fallimento dell’impianto e le complicanze, come mucosite e perimplantite.
La coorte di pazienti selezionata, trattata tra il 2014 e il 2019, aveva un follow-up minimo di un anno fino a un massimo di quattro anni (il calcolo della dimensione del campione non era necessario in quanto, trattandosi di uno studio retrospettivo, tutti i pazienti erano stati inclusi nel periodo indicato).
Lo studio è stato condotto presso il Dipartimento di Chirurgia orale dell’Università di Valencia (Spagna) in collaborazione con l’Istituto Stomatologico Italiano di Milano.
I pazienti trattati sono stati resi edotti e hanno firmato un consenso informato, accettando che i loro dati sarebbero stati utilizzati per scopi educativi o per la ricerca scientifica.
Il gruppo test includeva pazienti con impianti di tipo 1 inseriti in siti infetti trattati con laser.
I criteri di inclusione erano:
- età ≥ di 18 anni;
- condizioni mediche non rilevanti;
- valori di indice di placca e sanguinamento al sondaggio ≤ 25% per l’intera bocca;
- follow up minimo di un anno dopo la chirurgia implantare;
- pazienti che avevano eseguito riabilitazione implantare immediata in siti infetti (presenza di carie subgengivale, malattia parodontale, lesioni endodontiche o fratture) decontaminati con laser.
Criteri di esclusione:
- pazienti con importante malattia sistemica;
- storia di radioterapia;
- terapia steroidea in corso;
- disabilità neurologica o psichiatrica;
- stato di immunosoppressione;
- storia di trattamento con bifosfonati;
- donne in gravidanza o allattamento;
- severo bruxismo;
- pazienti con scarsa igiene orale e non collaboranti;
- fumo (+ di 15 sigarette al giorno), abuso di alcol o droghe.
Il gruppo controllo includeva pazienti con impianti di tipo 4 in siti non infetti. I criteri di inclusione erano:
- età maggiore di 18 anni;
- condizioni mediche non rilevanti;
- valori di indice di placca e sanguinamento al sondaggio ≤ 25% per l’intera bocca;
- follow up minimo di un anno dopo la chirurgia implantare;
- pazienti che avevano eseguito impianti di tipo 4 per edentulia.
Criteri di esclusione erano gli stessi del gruppo test, ovvero:
- pazienti con importante malattia sistemica;
- storia di radioterapia;
- terapia steroidea in corso;
- disabilità neurologica o psichiatrica;
- stato di immunosoppressione;
- storia di trattamento con bifosfonati;
- donne in gravidanza o allattamento;
- severo bruxismo;
- pazienti con scarsa igiene orale e non collaboranti;
- fumo (+ di 15 sigarette al giorno), abuso di alcol o droghe.
La prima fase dello studio prevedeva la selezione delle radiografie (radiografie endorali periapicali eseguite con centratore di Rinn e tecnica dei raggi paralleli) e della storia clinica dei pazienti arruolati, a completare il protocollo redatto.
Si trattava di pazienti che avevano ricevuto impianti immediati posizionati in siti infetti decontaminati con laser o pazienti che avevano ricevuto impianti con tecnica tradizionale. Tutti i pazienti hanno acconsentito a un piano di trattamento che prevedeva l’avulsione dei denti compromessi, la decontaminazione del sito post-estrattivo utilizzando il laser Er,Cr:YSGG, e il posizionamento di un impianto nella medesima seduta clinica (gruppo test). Il piano di trattamento è stato concordato dopo un’attenta analisi che escludesse la presenza di controindicazioni; i pazienti hanno prestato il loro consenso per il processamento dei dati.
Caso clinico
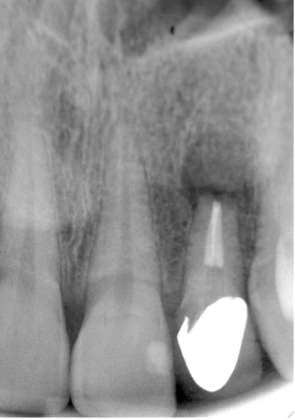
La fase chirurgica prevedeva l’impiego di terapia antibiotica (amoxicillina, 1g x 2v/dì x 6gg), a partire dalla sera prima della chirurgia. L’anestetico locale utilizzato era Optocain® (Mepivacaina 1:100.000). Le seguenti immagini mostrano le fasi salienti del protocollo chirurgico per impianti post-estrattivi inseriti in siti infetti decontaminati con laser Er,Cr:YSGG attraverso un caso clinico esemplificativo. Si tratta di una paziente donna di 40 anni con un incisivo laterale superiore di sinistra compromesso, con segni clinici e radiografici di parodontite apicale (Figure 1a-b).
Il dente era stato sottoposto senza alcun successo a endodonzia chirurgica. La paziente era in buono stato di salute generale, presentava una buona igiene orale ed era motivata a iniziare una riabilitazione implantare post estrattiva nel sito infetto decontaminato con laser.
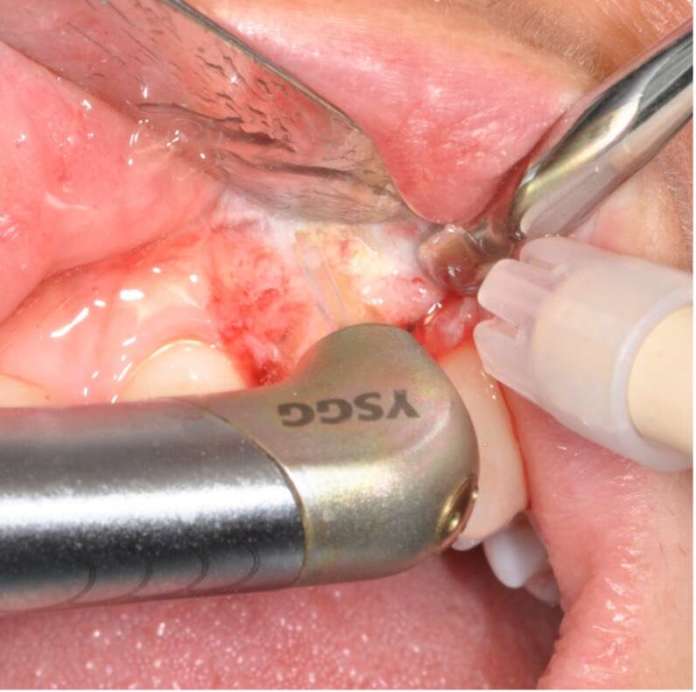
In primis, è stato allestito un lembo a spessore totale con incisione in cresta e rilasci verticali (Figura 1c), utilizzando il laser Er,Cr:YSGG 2780nm device WaterlaseiPlus® (Biolase), con le seguenti impostazioni: configurazione per la modalità tessuti molli (S mode), che includeva la tip in zaffiro MC-3 di lunghezza 9 mm, aria 20% e acqua 80%, potenza di 3.5 W e frequenza di 50 Hz.
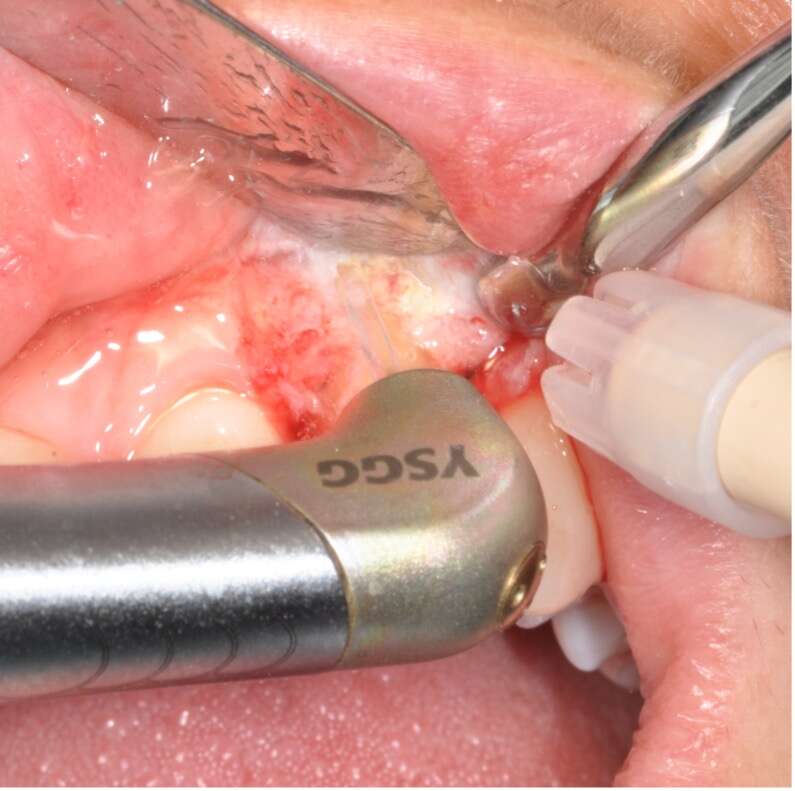
Per il tessuto osseo l’impostazione del settaggio era: configurazione tessuti duri (H mode), tip in zaffiro MZ-8, lunghezza 6 mm, aria 40% e acqua 60%, potenza 4.0 W con frequenza di 20 Hz. Il dente è stato estratto nel modo più atraumatico possibile al fine di preservare i tessuti circostanti.
Una volta completata l’estrazione, è iniziata la fase di decontaminazione del sito infetto: è stato utilizzato lo stesso dispositivo laser, ma con un’altra impostazione: configurazione tessuti duri (hard mode), potenza 2,0 W e frequenza di 20 Hz, 20% di aria e 80% di acqua, utilizzo di tip MZ-6 (9 mm di lunghezza).
Il tempo di debridement è dipeso dalla quantità di tessuto patologico e dal volume osseo, mentre la decontaminazione ha avuto una durata dai 60 ai 90 secondi per sito, garantendo l’assenza di contatto fisico tra la punta e i tessuti, con un volume d’acqua di circa 100 ml al minuto (wash-out massimo).
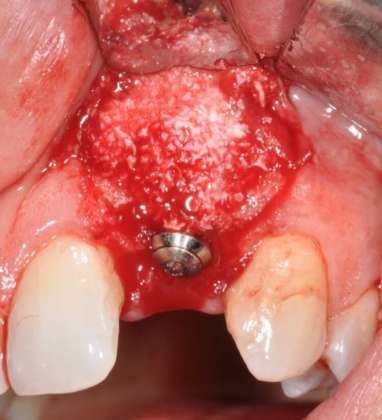
L’impianto (1 T.E. ø3.3mm RN, SLA®; 10mm, Roxolid®) è stato inserito con un torque minimo di 35N e 1mm al di sotto del picco osseo più apicale. È stato, inoltre, necessario ricorrere all’utilizzo di alcuni biomateriali per colmare il difetto residuo causato dall’infezione: Bio-Oss®e una membrana riassorbibile (Collprotect®, Straumann) sono stati utilizzati per migliorare la guarigione dei tessuti (Figure 1d-e).
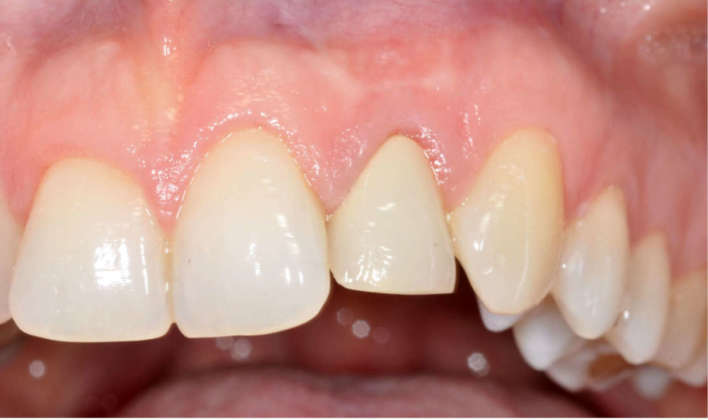
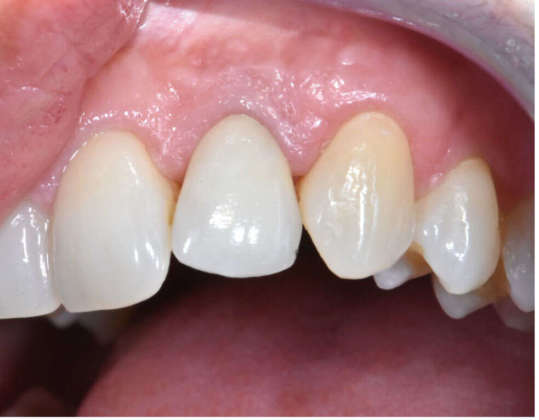
Le suture (PTFE Omnia 3/0, 19mm 3/8) sono state posizionate con particolare cura per ottenere un buon riposizionamento del lembo ed è stata eseguita una rx endorale finale. La fase protesica provvisoria prima del carico è stata gestita con un ponte di Maryland in resina. Contestualmente è stato prescritto gel di clorexidina gluconato allo 0,2% due volte al giorno, per 15-20 giorni, e sono state fornite alla paziente istruzioni post-operatorie. Sono stati programmati controlli clinici e radiografici periodici a uno, quattro, otto e 12 mesi per il primo anno e l’impianto è stato caricato dopo quattro mesi. Un controllo clinico a due anni dimostra un risultato estetico soddisfacente (Figure 1f-g).
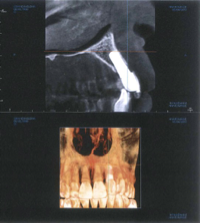
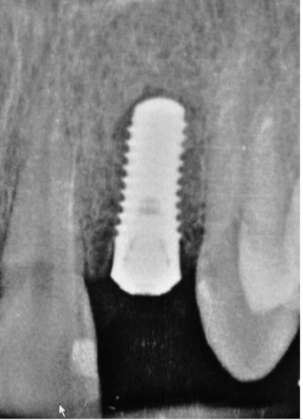
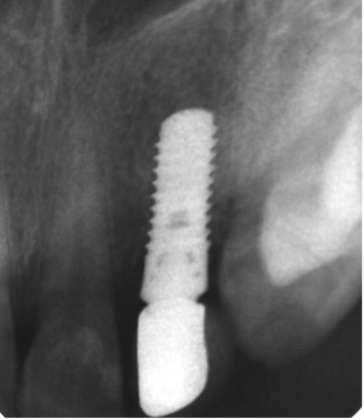
Dalla CBCT di controllo a cinque anni è possibile osservare l’assenza di lesioni perimplantari e la stabilità del tessuto osseo dopo il carico (Figura 2).
Analisi radiografica
La seconda fase dello studio prevedeva la misurazione delle radiografie digitali da un operatore “cieco” (R.A.) con uno specifico software (Image J, National Insitute of Health, Bethesda, Rockville, MA, USA). Sono stati usati i seguenti parametri per le radiografie: 65-90 kV, 7.5-10 mA and 0.22-0,25 s. Prima della misurazione, ogni radiografia è stata calibrata utilizzando il diametro e la lunghezza dell’impianto come misura di riferimento per correggere eventuali distorsioni. Le radiografie sono state misurate su uno schermo medico con una risoluzione di 1920x1080 e con ingrandimento 7x.
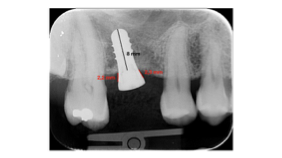
Il livello osseo marginale (MBL) era misurato per il baseline e il follow-up secondo Linkevicious et al. calcolando la distanza tra il collo dell’impianto e il primo contatto osso-impianto [Linkevicius et al. 2009] e prendendo in considerazione sia l’aspetto mesiale che distale di ogni impianto (Figura 3).
Per l’analisi radiografica è stato effettuato un accordo intra-valutatore. Un campione indipendente a priori di 20 superfici implantari misurate è stato misurato due volte a distanza di due settimane. Il coefficiente di correlazione bidirezionale intraclasse per l’analisi radiografica della concordanza intra-valutatore era 0,97 (IC 95% da 0,95 a 0,99).
Analisi statistica
Come statistiche descrittive sono stati utilizzati media e deviazioni standard per le variabili quantitative e frequenza e percentuali per le variabili qualitative. L’unità di analisi è stata l’impianto, tenendo comunque conto del fatto che spesso più impianti erano utilizzati per ogni paziente. Per la variabile outcome differenza in MBL è stato utilizzato un modello statistico a effetti misti (mixed model), utilizzando il paziente come effetto random (random effect). La covariata era costituita dal MBL al baseline e il gruppo (impianto test o controllo) era la variabile esplicativa (fixed effect).
Al fine di confrontare la differenza al baseline tra i due gruppi (impianti test vs impianti controllo) sono stati utilizzati modelli a effetti misti per le variabili quantitative età, lunghezza impianto, diametro impianto, MBL al baseline.
Un modello a effetti misti è stato utilizzato anche per comparare la durata del follow-up tra i due gruppi. Il paziente era l’effetto random (random effect) e il gruppo (impianto test o controllo) era la variabile esplicativa (fixed effect).
Sono stati utilizzati dei modelli multilevel per le variabili qualitative: genere, fumo, arcata (superiore o inferiore), zona (frontali –incisivi o canini- vs posteriori –premolari o molari-), motivi di estrazione (frattura vs altro), presenza di ascesso o fistola, presenza di lesione, impianti con narrow neck, carico immediato, utilizzo di membrana, utilizzo di collagene, utilizzo di osso sintetico. I modelli erano a due livelli (paziente e impianto) e il gruppo (impianto test o controllo) era la variabile esplicativa.
La soglia di significatività è stata impostata a 0.05. La statistica è stata effettuata con il software JMP v. 13.0 e con MLwin v. 3.05.
Risultati
Complessivamente, sono stati trattati 98 pazienti con un’età media di 58,0 ± 14,6 anni (da 21 a 88 anni), 52 femmine (53%) e 46 maschi (47%); i fumatori nel campione erano complessivamente 22 (22%); sono stati inseriti 149 impianti, 90 (60%) erano di tipo test e 59 (40%) di controllo. Gli impianti test sono stati inseriti in 53 pazienti (un impianto in 35 pazienti, due impianti in 10 pazienti, tre impianti in quattro pazienti, quattro impianti in tre pazienti e cinque impianti in un paziente). Gli impianti controllo sono stati inseriti in 39 pazienti (un impianto in 29 pazienti, due impianti in sette pazienti, tre impianti in tre pazienti). Entrambi gli impianti di test e di controllo sono stati inseriti in sei pazienti (un impianto test e un impianto di controllo in cinque pazienti, un impianto test e due impianti di controllo in un paziente). Le variabili relative al paziente al baseline sono riportate nella Tabella 5, che mostra sesso, età e abitudine al fumo nei diversi gruppi. La tabella fa riferimento ai pazienti che avevano almeno un impianto del tipo considerato.
Tabella 5 - Variabili relative al paziente al baseline
| Variable | Test group | Control group | P-value |
| N=59 | N=45 | ||
| Gender (female) (%) | 29 (49%) | 25 (56%) | 0.764* |
| Gender (male) (%) | 30 (51%) | 20 (44%) | 0.764* |
| Age (years) (sd) | 59.3 (14.5) | 57.5 (14.5) | 0.977** |
| Smoker (%) | 13 (22%) | 9 (20%) | 0.913* |
sd: standard deviation. * Multilevel model; ** Mixed model.
Le variabili relative al sito sono riportate nella Tabella 6, che comprende diverse caratteristiche riferite all’impianto: arcata superiore o inferiore, zona (anteriore o posteriore), motivo dell’estrazione (frattura, ascesso o fistola), presenza e dimensione della lesione parodontale, utilizzo di impianto narrow neck, lunghezza dell’impianto, diametro dell’impianto, utilizzo del carico immediato, utilizzo di membrane, collagene osso sintetico, misurazione del MBL al baseline.
Tabella 6 - Caratteristiche al baseline relative all’impianto
| Variable | Test group | Control group | P-value |
| N=90 | N=59 | ||
| Upper arch | 47 (52%) | 25 (42%) | 0.279* |
| Lower arch | 43 (48%) | 34 (58%) | 0.279* |
| Zone (anterior) | 26 (29%) | 9 (15%) | 0.201* |
| Zone (posterior) | 64 (71%) | 50 (85%) | 0.201* |
| Extraction (fracture) | 43 (48%) | 31 (52%) | 0.987* |
| Extraction (no fracture) | 47 (52%) | 28 (48%) | 0.987* |
| Abscess or fistula | 61 (68%) | 42 (72%) | 0.866* |
| Lesion | 20 (22%) | 2 (3%) | 0.007* |
| Narrow neck | 12 (13%) | 10 (17%) | 0.563* |
| Implant length mm (sd) | 9.9 (1.7) | 8.9 (1.7) | 0.001** |
| Implant diameter mm (sd) | 3.9 (0.4) | 4.0 (0.5) | 0.232** |
| Immediate loading | 21 (23%) | 8 (14%) | 0.534* |
| Membrane | 69 (77%) | 30 (51%) | 0.047* |
| Collagen | 21 (23%) | 22 (37%) | 0.324* |
| Synthetic bone | 55 (61%) | 18 (31%) | 0.011* |
| MBL baseline mm (sd) | 2.4 (1.3) | 2.4 (0.8) | 0.912** |
sd: standard deviation. * Multilevel model; ** Mixed model.
Nel gruppo test vi erano più spesso presenti lesioni, la lunghezza implantare era maggiore di circa 1 mm, sono stati più frequentemente utilizzati la membrana e l’osso sintetico. In particolare, i motivi di estrazione nel gruppo test erano:
- carie (sottogengivale e senza possibilità di recupero del dente) 32 (36%);
- lesioni endodontiche 10 (11%);
- frattura per 43 denti (48%);
- problemi parodontali (denti con malattia parodontale e mobilità di II o III grado) 5 (6%).
I motivi dell’estrazione nel gruppo di controllo erano:
- carie (subgengivale e senza possibilità di recuperare il dente) per 20 denti (34%);
- lesione endodontica in un solo caso (2%);
- frattura per 31 denti (52%);
- problemi parodontali (denti con malattia parodontale e mobilità di II o III grado) per 7 denti (12%).
Gli impianti inseriti erano della marca Straumann, ma con caratteristiche diverse per adattarsi a tutte le situazioni cliniche (Figura 4).

Nel gruppo test sono state utilizzate le seguenti tipologie di fixture: 33 impianti TE RNLoxim SLA Roxolid (37%), 37 impianti S RN Loxim SLA Roxolid (41%), 4 impianti SP RN LoximSLA TiZr (4%), 3 impianti SP NNC SLAactiveTiZr (3%), 4 impianti S RN SLAactiveRoxolid(4%), 9 impianti SP NNC Loxim SLA Roxolid (10%).
Nel gruppo di controllo, invece, le fixtures sono state: 6 impianti TE RN Loxim SLA Roxolid (10%), 39 impianti S RN Loxim SLA Roxolid (66%), 4 impianti SP RN Loxim SLA TiZr (7%), 0 impianti SP NNC SLAactiveTiZr (0%), 0 impianti S RNSLAactiveRoxolid (0%), 10 impianti SP NNC Loxim SLA Roxolid (17%).
ll follow-up è stato di 1,7 ± 0,6 anni nel gruppo test e di 1,5 ± 0,5 anni nel gruppo di controllo, con una differenza non statisticamente significativa (P = 0,082; mixed model).
C’è stato un solo fallimento nel gruppo test (1%) e nessun fallimento nel gruppo di controllo. Si è registrata solo una complicanza (mucosite) nel gruppo di controllo (2%) e nessuna complicanza a parte il fallimento nel gruppo test. I risultati di MBL al follow-up sono mostrati nella Tabella 7, che include la misurazione al follow-up e la differenza tra baseline e follow-up. La differenza in MBL tra i due gruppi era a favore del gruppo test che addirittura aveva guadagnato 0.1 mm rispetto al baseline, mentre il gruppo di controllo perdeva 0.1 mm in MBL.
Tabella 7 - Marginal bone level (MBL) al follow-up
| Variable | Group Test | Group Control | Diff | 95%CI | P- value |
| N=89 | N=59 | ||||
| MBL at follow-up mm (sd) | 2.3 (0.9) | 2.5 (0.7) | 0.2 | 0.0; 0.4 | 0.058* |
| MBL difference between baseline and follow-up mm (sd) | 0.1 (1.0) | -0.1 (0.6) | 0.2 | 0.0; 0.4 | 0.058* |
sd: standard deviation. * Mixed model
La differenza tra i due gruppi, tuttavia, era di soltanto 0.2 mm, che non è statisticamente significativo (anche se di poco, P=0.058).
Oltre ai risultati statistici, è stato possibile ottenere numerosi rilievi clinici evidenziati da documentazione radiografica e fotografica della tecnica descritta.
Durante la visita di follow-up non sono state osservate complicanze come perdita dell’impianto, perimplantite o perdita dell’osso perimplantare. Gli impianti hanno raggiunto una buona stabilità primaria (>35 N/cm). La riabilitazione protesica dopo la fase chirurgica ha permesso di ottenere funzionalità ed estetica soddisfacenti. Il successo della terapia implantare è stato evidenziato dai controlli clinici e radiografici.
Discussione
La tecnica richiede una serie di presupposti per essere applicata correttamente e in modo prevedibile:
- il paziente deve essere in buone condizioni di salute generale, possibilmente non fumatore, e non deve avere una parodontite non curata. Il paziente deve essere collaborativo e attenersi alle indicazioni del dentista;
- il caso clinico deve essere attentamente valutato in anticipo: la causa dell’estrazione del dente, l’eventuale presenza di infezioni ricorrenti, il tipo di osso, ecc. Per questo è anche necessaria la valutazione delle radiografie (e della CBCT se necessario);
- la profilassi per la chirurgia prevede la terapia antibiotica e il gel di clorexidina 0,2%;
- l’estrazione deve essere completata in modo atraumatico per preservare l’osso residuo;
- tra i vari tipi di laser, Er,Cr:YSGG è consigliato per la migliore capacità di decontaminazione;
- l’uso di biomateriali è spesso necessario per far fronte ai difetti ossei.
Esistono diversi tipi di laser disponibili sul mercato. Le impostazioni riportate sono per il corretto utilizzo del laser Er,Cr:YSGG in diversi substrati (Tabella 8).
Tabella 8 - Laser setting
| Er,Cr:YSGGLaser | Tip | Lenght | Power | Frequency | Air | Water |
| Soft tissue | MC-3 | 9 mm | 3.5 W | 50 Hz | 20 % | 80 % |
| Hard tissue | MZ-8 | 6 mm | 3.5 W | 20 Hz | 40 % | 60 % |
| Decontamination | MZ-6 | 9 mm | 2.0 W | 50 Hz | 20 % | 80 % |
È importante seguire i programmi del dispositivo per evitare effetti negativi sui tessuti duri e molli. Gli operatori devono rispettare tutte le norme per la propria sicurezza e quella del paziente, come l’uso di speciali occhiali protettivi.
È abbastanza difficile trarre delle conclusioni da questo studio. Trattandosi, infatti, di uno studio non randomizzato, è difficile stabilire quanto le differenze ottenute nei due gruppi siano da ascrivere alla terapia o alla presenza di pazienti, siti e impianti con caratteristiche diverse nei due gruppi. In particolare, nel gruppo test gli impianti erano più lunghi. Inoltre, nel gruppo test sono stati utilizzati più spesso membrana e osso autologo.
Dall’analisi dei risultati possiamo affermare che tra i due gruppi analizzati non vi era differenza in MBL, che addirittura è risultata migliore nel gruppo test, avallando l’applicazione clinica del protocollo appena descritto per il posizionamento di impianti di tipo 1 in siti infetti; il tasso di complicanze o di fallimento è paragonabile tra i due gruppi e quindi non vi è alcun aumento del rischio nel gruppo test.
Pertanto, il fatto che non vi sia differenza in MBL, che è addirittura quasi migliore nel gruppo test, tenendo conto del fatto che la terapia test è più veloce da effettuare, sembra promettente per l’utilizzo di questa metodica.
Conclusioni
Il posizionamento immediato di un impianto in un sito post-estrattivo infetto o infiammato, dopo la decontaminazione laser, non sembra aumentare il rischio di fallimento, come dimostrato da questo studio retrospettivo e da altri reports precedentemente pubblicati. La tecnica offre interessanti vantaggi nel trattare anche le aree estetiche con impianti post-estrattivi. È necessario attenersi a una serie di protocolli e procedure cliniche per prevenire la perimplantite e altre complicanze. Ulteriori studi sono indubbiamente necessari per chiarire appieno l’importanza ed il meccanismo alla base della tecnica.
Il posizionamento immediato di un impianto in un sito post-estrattivo rappresenta al giorno d’oggi una procedura chirurgica comune, nonché una scelta terapeutica valida per riabilitare quei pazienti in cui vi sia la necessità di sostituire elementi dentari compromessi. Diversi studi hanno dimostrato come questa tecnica abbia un alto tasso di successo e presenti numerosi vantaggi. Tradizionalmente, molti autori raccomandano di non posizionare impianti in alveoli post-estrattivi che mostrino segni di infezione; tuttavia, studi recenti riportano un’elevata percentuale di successo anche per impianti post-estrattivi inseriti in siti infetti o infiammati, con e senza carico immediato. Un crescente numero di lavori scientifici ha iniziato, infatti, a proporre diversi protocolli, alcuni dei quali prevedono l’impiego del laser, per la decontaminazione dei siti infetti finalizzata al posizionamento di impianti di tipo 1. Il primo studio clinico controllato riguardante gli impianti postestrattivi in siti infetti e l’uso del laser per la decontaminazione è stato recentemente pubblicato dagli autori di questo aggiornamento monografico.
Post-extraction implants in infected sites decontaminated with laser ER,CR:YSGG: scientific evidence and clinical practice
Nowadays, the immediate placement of an implant in a post-extraction site is a common surgical procedure, as well as a valid therapeutic choice to rehabilitate those patients who need to replace compromised dental elements. Several studies have shown that this technique presents a high success rate and has many advantages. Traditionally, many authors recommend not placing implants in extraction sockets that show signs of infection; however, recent studies report a high success rate even for post-extraction implants placed in infected or inflamed sites, with and without immediate loading. Indeed, a growing number of scientific works has begun to propose various protocols, some of which involve the use of lasers, for the decontamination of infected sites aimed at positioning type 1 implants. The first controlled clinical study concerning post-extraction implants in infected sites and the use of laser for decontamination was recently published by the authors of this monographic update.
1. Al-Sawai AA, Labib H. Success of immediate loading implants compared to conventionally-loaded implants: a literature review. J Investig Clin Dent. 2016 Aug;7(3):217-24.
2. Aoki A, Mizutani K, Schwarz F, et al. Periodontal and peri-implant wound healing following laser therapy. Periodontol 2000. 2015 Jun;68(1):217-69.
3. Barzilay I. Immediate implants: their current status. Int J Prosthodont1993;6:169–175. 4. Bordea IR, Hanna R, Chiniforush N, et al. Evaluation of the outcome of various laser therapy applications in root canal disinfection: A systematic review. PhotodiagnosisPhotodynTher. 2020 Mar;29:101611.
5. Carlsson GE, Persson G. Morphologic changes of the mandible after extraction and wearing of the denture. Odontol Rev 1967;18:27–54.
6. Chen H, Zhang G, Weigl P, Gu X. Immediate placement of dental implants into infected versus noninfected sites in the esthetic zone: A systematic review and meta-analysis. J Prosthet Dent. 2018 Nov;120(5):658-667.
7. Corbella S, Taschieri S, Tsesis I, Del Fabbro M. Postextraction implant in sites with endodontic infection as an alternative to endodontic retreatment: a review of literature. J Oral Implantol. 2013 Jun;39(3):399-405.
8. Crespi R, Cappare P, Gherlone E. Immediate loading of dental implants placed in periodontally infected and noninfected sites: a 4-year follow-up clinical study. J Periodontol2010;81:1140–1146.
9. Crippa R, Aiuto R, Guardincerri M, PeñarrochaDiago M, Angiero F. Effect of Laser Radiation on Infected Sites for the Immediate Placement of Dental Implants. PhotobiomodulPhotomed Laser Surg. 2020 Mar;38(3):186-192.
10. Crippa R, Aiuto R, Dioguardi M, Nieri M, Peñarrocha-Diago M, Peñarrocha-Diago M, Angiero F. Immediate dental implant placement in post-extraction-infected sites decontaminated with Er,Cr:YSGG laser: a retrospective cohort study. Odontology. 2023 Jan;111(1):255-262.
11. Hämmerle CH, Chen ST, Wilson TG Jr. Consensus statements and recommended clinical procedures regarding the placement of implants in extraction sockets. Int J Oral Maxillofac Implants. 2004;19 Suppl:26-8. PMID: 15635943.
12. Hu ML, Zheng G, Lin H, Li N, Zhao PF, Han JM. Network meta-analysis of the treatment efficacy of different lasers for peri-implantitis. Lasers Med Sci. 2021 Apr;36(3):619-629. 13. Keller U, Hibst R. Effects of Er:YAG laser in caries treatment: a clinical pilot study. Lasers Surg Med. 1997;20(1):32-8.
14. Kusek ER. Immediate implant placement into infected sites: bacterial studies of the Hydroacoustic effects of the YSGG laser. J Oral Implantol. 2011 Mar;37 Spec No:205-11.
15. Lin GH, Suárez López Del Amo F, Wang HL. Laser therapy for treatment of peri-implant mucositis and peri-implantitis: An American Academy of Periodontology best evidence review. J Periodontol. 2018 Jul;89(7):766-782.
16. Maggioni M, Scarpelli F, Attanasio T. Il laser in odontoiatria. Piccinnuovalibraria 2021; 41.
17. Romanos G. Current concepts in the use of lasers in periodontal and implant dentistry. J Indian Soc Periodontol. 2015 Sep-Oct;19(5):490-4.
18. Romanos GE, Gupta B, Yunker M, Romanos EB, Malmstrom H. Lasers use in dental implantology. Implant Dent. 2013 Jun;22(3):282-8.
19. Walsh LJ. The current status of laser applications in dentistry. Aust Dent J. 2003 Sep;48(3):146-55; quiz 198.
20. Werbitt MJ, Goldberg PV. The immediate implant: bone preservation and bone regeneration. Int J Periodontics Restorative Dent. 1992;12(3):206-17. PMID: 1305154.
21. Woodruff LD, Bounkeo JM, Brannon WM, Dawes KS, Barham CD, Waddell DL, Enwemeka CS. The efficacy of laser therapy in wound repair: a meta-analysis of the literature. Photomed Laser Surg. 2004 Jun;22(3):241-7.