Riassunto
Introduzione. Bromelina è il nome generalmente dato a una famiglia di enzimi proteolitici estratti dalla pianta Ananas comosus. È considerata una potente sostanza antinfiammatoria e antiedemigena, agendo a vari livelli nei meccanismi della reazione infiammatoria, come i mediatori non prostaglandinici dell’infiammazione, le cellule del sistema immunitario o la via della coagulazione. La chirurgia dei terzi molari inclusi è, nell’ambito ambulatoriale, una tra le più suscettibili di dolore ed edema postoperatorio. Lo scopo di questo studio è quello di valutare l’efficacia della bromelina in termini di riduzione dell’algia, del dolore e dell’edema postoperatori.
Materiali e metodi. Sono stati reclutati nello studio un totale di 80 pazienti afferenti presso l’Unità operativa di Chirurgia maxillo facciale dell’Istituto Stomatologico Italiano, per l’avulsione del terzo molare incluso. I pazienti sono stati operati in regime di day surgery. Il giorno dell’intervento i pazienti hanno iniziato ad assumere una terapia antibiotica e una terapia analgesica. Dal giorno successivo, i pazienti sono stati suddivisi in 2 gruppi. Al gruppo 1 (gruppo studio) è stata prescritta, unitamente al paracetamolo come analgesico al bisogno, una compressa di bromelina ogni 12 ore per 7 giorni. Al gruppo 2 (gruppo controllo) è stato prescritto unicamente paracetamolo come analgesico al bisogno. Durante lo studio sono stati valutati tre parametri: dolore, edema, eritema. Per la valutazione di questi parametri, è stata utilizzata la scala VNS (Visual Numeric Scale). La prima visita di rivalutazione è avvenuta circa 3 ore dopo l’intervento, la seconda 48 ore dopo. La terza e ultima visita di rivalutazione è avvenuta 7 giorni dopo l’intervento. In aggiunta alla valutazione dei parametri predetti, è stata registrata la presenza di eventuali eventi avversi, il consumo totale di farmaco analgesico, il giudizio di tollerabilità da parte del medico e di efficacia da parte del paziente.
Risultati. Il dolore, l’edema e l’eritema postoperatori sono stati significativamente inferiori nel gruppo studio rispetto al gruppo controllo. Il consumo di analgesici, sia in termini di giorni di terapia che di numero di assunzioni, è stato lievemente inferiore nel gruppo studio. L’unico evento avverso registrato nello studio si è verificato in un paziente del gruppo controllo.
Discussione e conclusioni. La bromelina è una sostanza che ha un potente effetto antinfiammatorio e antiedemigeno. Studi hanno evidenziato come questa sostanza agisca a più livelli nei meccanismi patogenetici della reazione infiammatoria acuta. La letteratura riporta studi sulla sua efficacia nella gestione dell’infiammazione postoperatoria. Il nostro studio dimostra come la bromelina abbia un importante effetto antinfiammatorio e antiedemigeno in una tipologia d’intervento che vede, tra le sue complicanze postoperatorie più frequenti, lo sviluppo di edemi anche di notevoli dimensioni nelle regioni del capo e del collo. La minore riduzione del dolore è interpretabile considerando che tale parametro era già controllato da una terapia analgesica dedicata. Concludendo, la bromelina è una sostanza sicura e ben tollerata, che in associazione alla terapia standard nell’estrazione dei terzi molari inclusi porta a un miglioramento del decorso postoperatorio rispetto alla sola terapia standard.
Summary
Therapeutic efficacy of bromelain in impacted third molar surgery: a clinical study
Introduction. Bromelain is a general name given to a family of proteolytic enzymes obtained from Ananas comosus, the pineapple plant. It’s considered a potent anti-inflammatory and anti-edemigen substance, acting on different levels of the inflammatory reaction mechanisms, such on the signaling molecules, on the immune system cells and on the coagulation. Surgery of impacted third molars, the most common procedure in oral surgery, is usually associated with severe postoperative pain and swelling. The aim of this study is to evaluate the effectiveness of bromelain in the postoperative pain and swelling reduction.
Materials and methods. 80 patients were recruited to the study from patients attending the maxillofacial surgery unit of the Istituto Stomatologico Italiano for surgical extraction of lower third molars. Patients were operated in a day-surgery system. On the day of surgery, patients started antibiotic and analgesic therapy. On following day, patients were divided in two groups. Patients of group 1 (study group) were prescribed – in association with on-need analgesic – a therapy with bromelain (g/12 hours, for7 days). Patients of group 2 (control group) were prescribed only analgesic on-need therapy. During the study, 3 parameters were evaluated: pain, swelling, erythema. For the evaluation of these parameters, a VNS scale (Visual Numeric Scale) was used. The first evaluation visit was performed 3 hours after the surgery, the second 48 hours after. The last evaluation visit was performed 7 days after. At this visit adverse reactions, total analgesic consumption, and tolerability level were recorded.
Results. Postoperative edema, pain and erythema values in the study group were significantly lower than in the control group. Analgesic consumption resulted slightly lower in the study group. Only one adverse reaction was found in the control group.
Discussions and conclusions. Bromelain is a substance with a potent anti-inflammatory and anti-edemigen effect. Studies showed how this substance acts on different levels of the pathogenetic mechanisms of the acute inflammatory response. Our study demonstrates how bromelain works mainly as an antinflammatory and anti-edemigen, in a kind of surgery whose most frequent postoperative complication is the development of swellings in the face and neck regions. The lower analgesic efficacy may be due to the concomitant effective analgesic therapy. In conclusion bromelain is a safe and well tolerated substance, which in association with the standard therapies allows a better postoperative course of impacted third molars surgery.
Bromelina è il nome generalmente dato a una famiglia di enzimi proteolitici estratti dalla pianta Ananas comosus. La sua parte funzionale è costituita da una frazione sulfidrilica. Sono presenti anche escarai, perossidasi, fosfatasi acida, inibitori delle proteasi e calcio in forma organicamente legata1-2.
Studi della sua farmacocinetica su modello animale hanno dimostrato un assorbimento del complesso enzimatico per via enterale di circa il 40%, con le più alte concentrazioni ematiche raggiunte dopo un’ora, e una breve emivita3.
È considerata una potente sostanza antinfiammatoria e antiedemigena, agendo a vari livelli nei meccanismi della reazione infiammatoria, come i mediatori non prostaglandinici dell’infiammazione, le cellule del sistema immunitario o la via della coagulazione.
A livello antinfiammatorio, la bromelina può agire inibendo la formazione di bradichinina, all’interno del sistema chinina-callicreina, come anche inibendo la migrazione e adesione leucocitaria tramite un effetto antagonista sui recettori CD1284-7.
A livello immunitario, la bromelina agisce stimolando la produzione di TNF-α, interferone γ, interleuchina 1, 2, 6 e GMCSF (granulocyte-macrophage-colony stimulating factor), limitando l’attivazione dei linfociti T helper CD4+ e riducendo l’espressione dei CD25 e CD448-12, stimola l’espressione della p53 e del Bax e ha effetto inibitorio sulla IκBα, ERK 1 e 2 (extracellular regulated protein kinase), MAPK (p38 mitogen-activated
protein kinase), Akt e NF-kB (nuclear factor-kappa B)13-15.
La bromelina inibisce l’aggregazione piastrinica, sia in vitro che endoteliale16-18. Inoltre, è un efficace agente fibrinolitico, stimolando la conversione del plasminogeno in plasmina19.
A livello clinico, è presente un’ampia letteratura sull’utilizzo della bromelina come agente sinergico delle terapie tradizionali. In particolare, è stata dimostrata l’efficacia della stessa come adiuvante le terapie antibiotiche20-22, come ausilio nella terapia delle infezioni da Escherichia coli, da Vibrio cholerae ed elmintiche23-26, delle patologie croniche infiammatorie come il Morbo di Crohn e la colite ulcerosa27, delle infezioni sinusitiche28-31, delle prostatiti32 e delle infezioni del tratto urinario33.
Inoltre, è stata documentata l’efficacia della stessa per la prevenzione e terapia di patologie cardiovascolari, quali l’angina pectoris, l’ischemia e l’infarto miocardico34-36, e muscolo-scheletriche, quali traumi muscolari37-38, osteoartriti39-42, artrite reumatoide43-44. Infine, studi hanno documentato l’efficacia della sostanza nella riduzione del dolore e dell’edema postoperatori45-47. È stata altresì dimostrata una pressoché totale assenza di effetti collaterali o da sovradosaggio48.
Se le condizioni anatomiche lo permettono, l’ottavo cresce nella zona tra la parete posteriore del settimo e il margine anteriore della branca montante della mandibola. Quando l’ottavo sano riesce a guadagnare una posizione corretta rispetto all’arcata e ad avere corretti rapporti masticatori con il rispettivo superiore, non sussistono indicazioni all’estrazione. La modificazione evolutiva della mandibola umana è caratterizzata da un’involuzione dei suoi diametri traversi49. Questa caratteristica, nella grande maggioranza degli individui, riduce lo spazio di eruzione dell’ottavo che, più tardivo nella comparsa, assai spesso non trova condizioni anatomiche favorevoli alla sua fuoriuscita. In questi casi l’ottavo rimane incluso o semi-incluso all’interno dei tessuti molli e duri del trigono retromolare. L’inclusione porta con sé il rischio di comparsa di patologie di varia natura che ne determinano l’indicazione all’estrazione. Le patologie che più frequentemente sono legate alla presenza di un ottavo incluso sono: pericoronarite, lesioni ossee, danni del secondo molare. In tutti questi casi e in altre situazioni è necessaria l’estrazione dell’ottavo50. La chirurgia dei terzi molari inclusi è, nell’ambito della chirurgia orale e maxillo-facciale ambulatoriale, l’intervento che si esegue più comunemente51. Tra le complicanze postoperatorie più frequentemente riscontrabili sono dolore, edema, trisma52. Una loro corretta gestione permette al paziente un maggior comfort e un recupero delle normali condizioni di salute più veloce. La terapia farmacologia standard consiste nell’utilizzo dell’antibiotico per prevenire infezioni batteriche e di analgesici quali FANS e paracetamolo per ridurre i sintomi dell’infiammazione postoperatoria, i quali – se pur efficaci come analgesici – non hanno azione diretta sull’edema e manifestano numerose reazioni avverse. Lo scopo di questo studio è quello di valutare l’efficacia della bromelina in termini di riduzione dell’edema e dell’algia postoperatorie.
Materiali e metodi
Lo studio è stato effettuato su un campione di 80 pazienti afferenti presso la nostra unità operativa di chirurgia maxillo facciale ed è stato effettuato in un regime di singolo cieco. Sono stati inseriti pazienti affetti da disodontiasi degli elementi 38 o 48. Gli elementi dovevano risultare in una condizione di inclusione ossea parziale o totale. Criteri d’esclusione erano la presenza di patologie cardiocircolatorie, renali, ematiche, oltre al tabagismo e a una scarsa igiene orale. Per evitare variabili, gli interventi sono stati tutti eseguiti con la medesima procedura. Effettuata un’anestesia tronculare del nervo alveolare inferiore con mepivacaina 3% (Mepi Mynol 1,8 ml, Curaden e un’anestesia plessica con mepivacaina 2% + adrenalina 1:100.000 (Mepi Mynol 1,8 ml, Curaden; nel fornice vestibolare, nei pressi della regione del terzo molare, è stato allestito un lembo di tipo trapezoidale. Una volta eseguita la scheletrizzazione del lembo, la fase successiva dell’intervento è consistita nell’ostectomia, effettuata con fresa a rosetta montata su manipolo dritto e sotto abbondante irrigazione con soluzione fisiologica. Successivamente l’odontotomia, eseguita con fresa a fissura sempre montata su manipolo dritto e sotto irrigazione di fisiologica, seguita dalla lussazione e avulsione dei frammenti dell’elemento dentario. Con cucchiaio chirurgico è stata effettuata la toilette dell’alveolo post-estrattivo, che è stato riempito per fini emostatici con della cellulosa fibrillare. Infine, il lembo è stato chiuso per prima intenzione, con una sutura in seta 3-0. Il giorno dell’intervento, tutti i pazienti hanno iniziato ad assumere una terapia antibiotica (amoxicillina 1 grammo ogni 12 ore per 6 giorni) (Augmentin 1 g, GlaxoSmithKline) e una terapia analgesica, costituita da una compressa di paracetamolo da 1000 mg ogni 8 ore (Tachipirina 1000 mg, Angelini). È stata prescritta l’applicazione topica di impacchi di ghiaccio sul volto in corrispondenza dell’area operata per l’intero giorno dell’intervento.
Dal giorno successivo, i pazienti sono stati suddivisi in 2 gruppi, secondo tabelle di randomizzazione. Al gruppo 1 (gruppo AF) è stata prescritta, unitamente al paracetamolo come analgesico al bisogno, una compressa di bromelina ogni 12 ore per 7 giorni (Fortilase 50 mg, Rottapharm Madaus). Al gruppo 2 (C) è stato prescritto unicamente paracetamolo come analgesico al bisogno. Durante lo studio sono stati valutati tre parametri – il dolore, l’edema e l’eritema – indicativi di un quadro di infiammazione acuta. Per la valutazione di questi parametri è stata utilizzata una scala di punteggio semiquantitativo da 0 a 4, dove 0 corrispondeva all’assenza del parametro clinico studiato e 4 alla presenza dello stesso secondo un grado molto grave. La prima visita di rivalutazione è avvenuta circa 3 ore dopo l’intervento (t0), la seconda 48 ore dopo (t1). La terza e ultima visita di rivalutazione è avvenuta 7 giorni dopo l’intervento (t2), e in aggiunta alla valutazione dei parametri predetti, è stata registrazione la presenza di eventuali eventi avversi, il consumo totale di farmaco analgesico, in termini di giorni e di compresse totali, e, infine, il giudizio di tollerabilità da parte del medico e di efficacia da parte del paziente. L’analisi statistica è stata eseguita utilizzando il test di U di Mann-Whitney per dati indipendenti non parametrici per valutare le differenze tra i due gruppi di studio e il test di Wilcoxon per dati appaiati non parametrici, per valutare la differenza dei valori dei parametri tra t0 e t2 (∆t). È stato scelto un livello < di significatività del test dell’1% (p<0.01).
Risultati
I due gruppi sono risultati omogenei per numero, età, peso, altezza e sesso (Tabella 1).
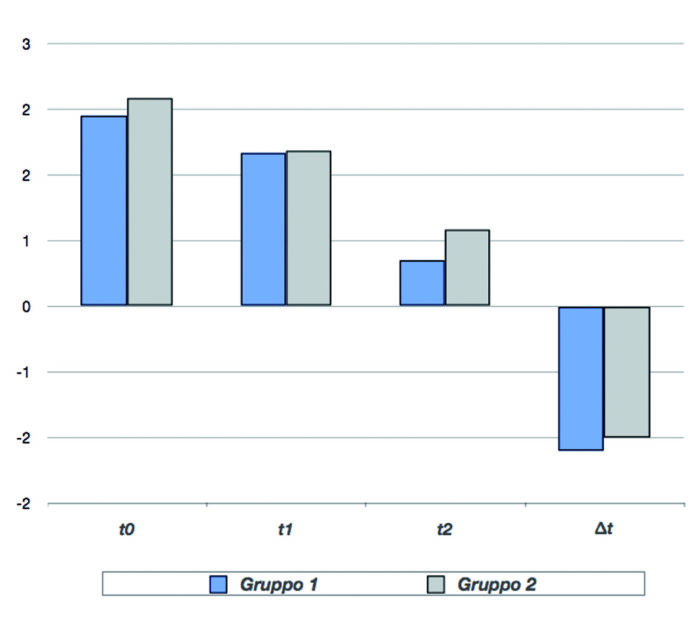
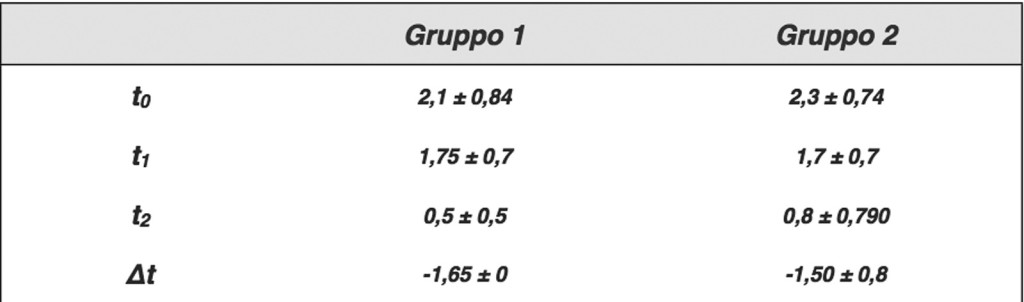
La Tabella e il Grafico 2 mostrano i i valori del parametro dolore ai diversi tempi di visita, nei due gruppi AF e C. Per entrambi i gruppi il punteggio di gravità del dolore è diminuito dopo 2 giorni di trattamento (t1) in modo significativo rispetto al basale (p<0,01); un ulteriore miglioramento si è registrato dopo 7 giorni (t2).
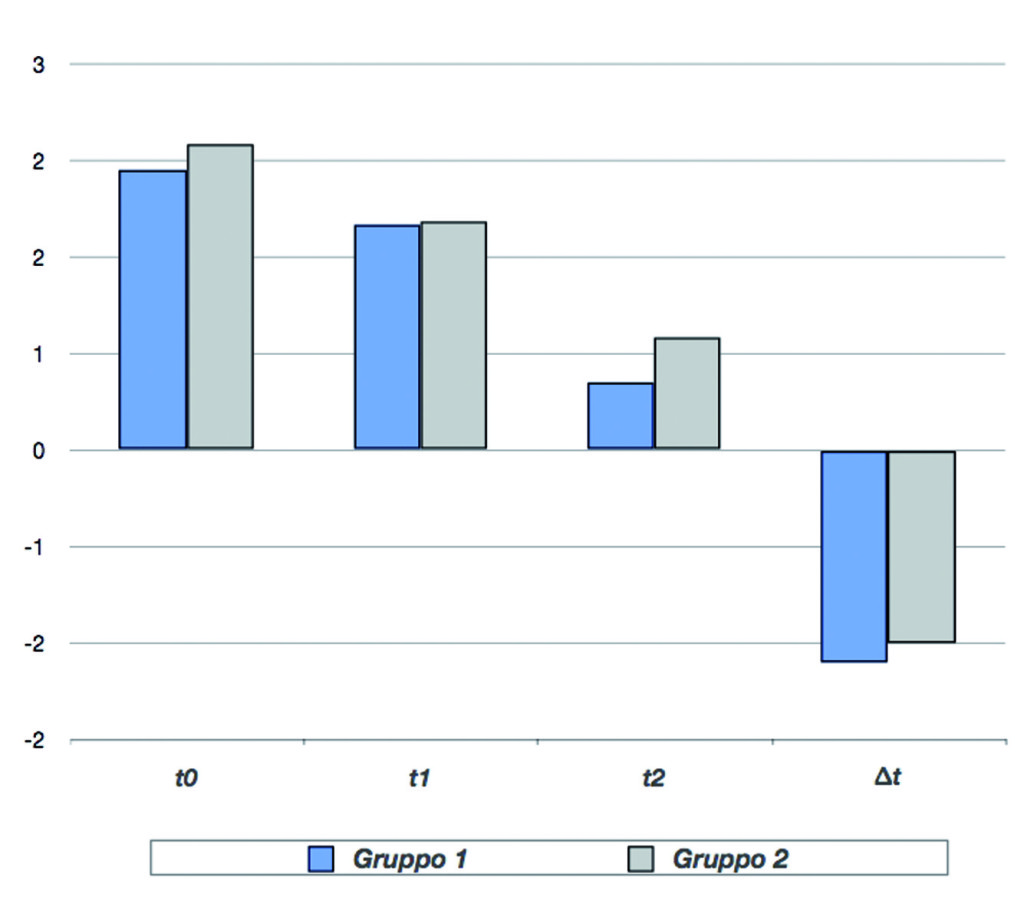
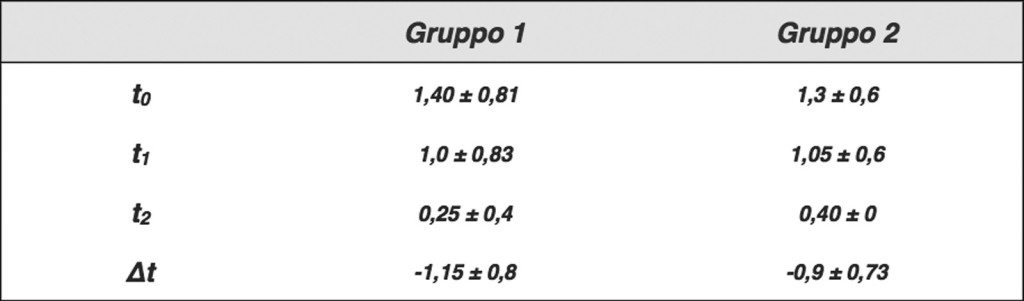
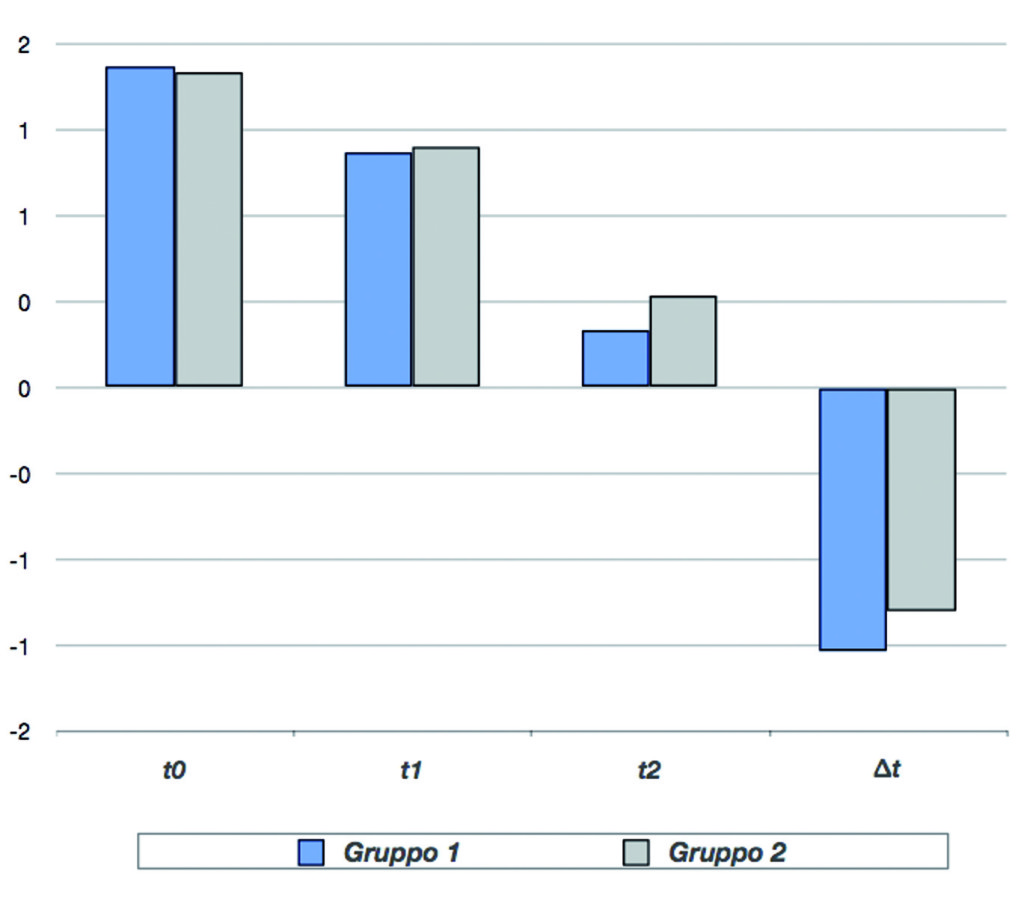
Il gruppo AF, in trattamento con bromelina, ha mostrato una lieve diminuzione del dolore superiore rispetto a quello di controllo. La differenza tra i due gruppi (∆) è risultata statisticamente significativa (p<0,01). Anche per l’eritema il punteggio di gravità è diminuito per entrambi i gruppi dopo 2 giorni di trattamento (t1) in modo significativo rispetto al basale (p<0,01), con un’ulteriore miglioramento dopo 7 giorni (t2).
Il gruppo AF ha mostrato una diminuzione dell’eritema superiore rispetto al gruppo di controllo. La differenza tra i due gruppi (∆) è risultata statisticamente significativa (p<0,01) (Tabella e Grafico 3).
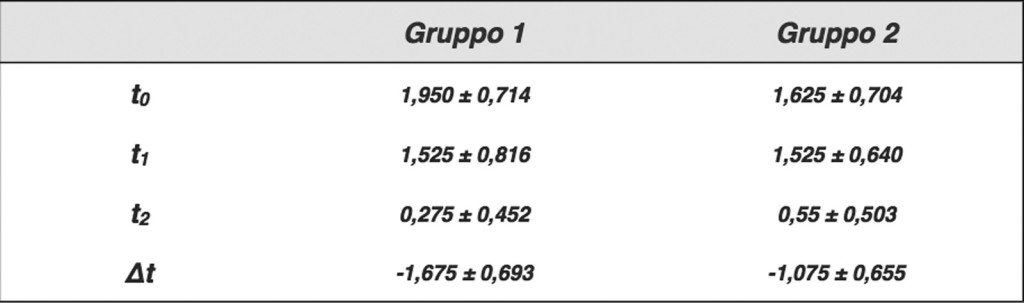
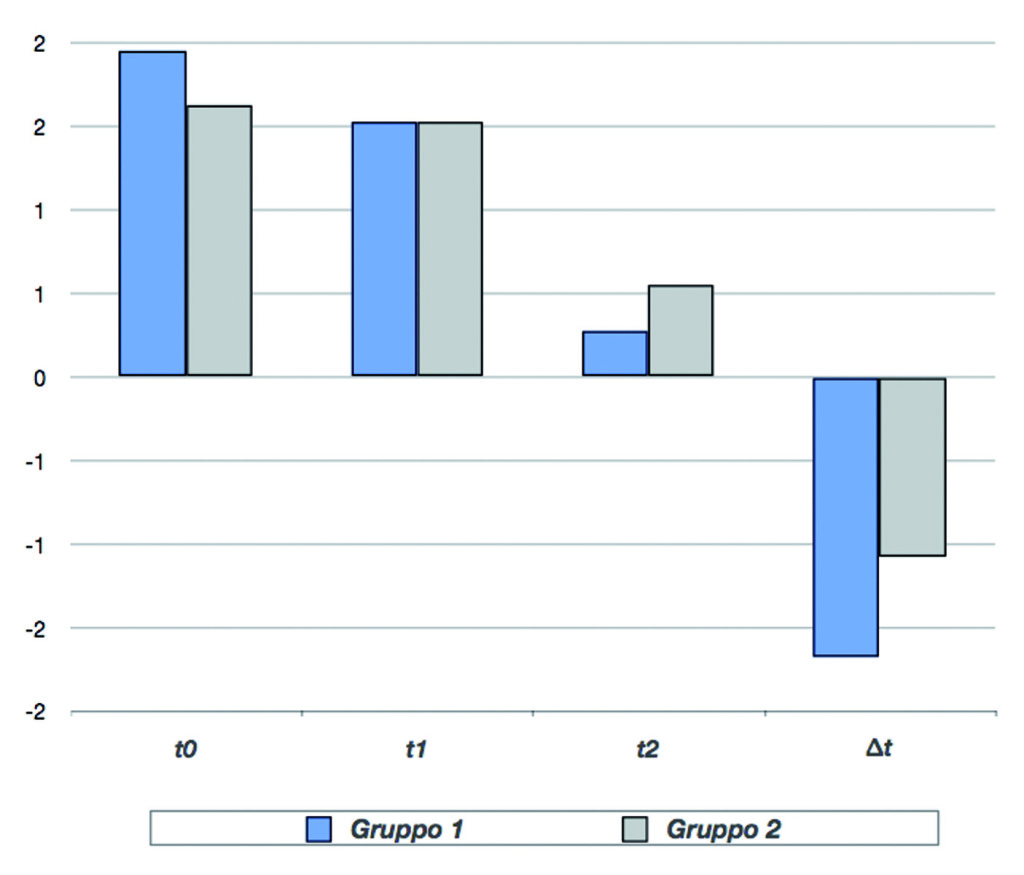
Infine, il parametro edema ha mostrato un miglioramento significativo rispetto al basale per entrambi i gruppi dopo 2 giorni di trattamento (t1) (p<0,01), con un’ulteriore miglioramento dopo 7 giorni (t2). Il gruppo AF ha mostrato un’importante diminuzione dell’edema superiore rispetto a quello di controllo. La differenza tra i due gruppi (∆) è risultata statisticamente significativa (p<0,01) (Tabella e Grafico 4).
Il consumo di analgesici è stato sovrapponibile tra i 2 gruppi, sia in termini di numero di compresse al giorno (2,562 ± 0,609 vs 2,588 ± 0,548) che di giorni di terapia (4,564 ± 1,532 vs 4,815 ± 1,570) (Tabella 5).

È stato registrato un solo evento avverso, di natura emorragica ed emetica, nel gruppo C.
Discussione e conclusioni
La bromelina è una sostanza che ha un potente effetto antinfiammatorio e antiedemigeno. Studi hanno evidenziato come agisca a più livelli nei meccanismi patogenetici della reazione infiammatoria acuta. La sua azione sinergica è stata dimostrata nelle terapie antibiotiche, nella terapia anticoagulante orale, nella terapia delle osteoartriti, degli infortuni muscolo scheletrici, dell’artrite reumatoide. La letteratura riporta anche studi sulla sua efficacia nella gestione dell’infiammazione postoperatoria.
Il nostro studio dimostra come la bromelina nella chirurgia dei terzi molari abbia un effetto prevalentemente antinfiammatorio e antiedemigeno in una tipologia d’intervento che vede, tra le sue complicanze postoperatorie più frequenti, lo sviluppo di edemi anche di notevoli dimensioni nelle regioni del capo e del collo52.
La lieve riduzione del dolore va interpretata considerando che tale parametro era già controllato da una terapia analgesica dedicata53. La riduzione in sè comunque dimostra un’azione sinergica da parte della bromelina con la terapia standard utilizzata in questo tipo di intervento. Il presente studio consolida i risultati precedenti che dimostravano l’efficacia antiedemigena della bromelina nella chirurgia dei terzi molari inferiori. Tali studi valutavano la riduzione dell’edema misurando la distanza trago-pogonion. Nel lavoro più recente, sono stati reclutati pazienti con entrambi i terzi molari inferiori inclusi, in modo tale da poter confrontare all’interno dello stesso paziente sia il gruppo studio che il controllo. Entrambi gli studi hanno confermato un’azione antiedemigena della bromelina nella chirurgia dei terzi molari54-55. La bromelina ha un ottimale profilo di sicurezza terapeutica riferito al dosaggio abituale.
In conclusione, la bromelina è una sostanza sicura e ben tollerata, che in associazione alla terapia standard nell’estrazione dei terzi molari incluso porta a un miglioramento del decorso postoperatorio rispetto alla sola terapia standard.
Paolo Ordesi
paoloroberto.ordesi@me.com
Paolo Ordesi1,2
Luca Grassi2
Paolo Persia2
Alessandro Leonida3
Maurizia Macchi4
Roberto Borloni4
Sandro Siervo4
1Dottorando di ricerca in Parodontologia Sperimentale, Dir. prof. M. Baldoni, Universitò degli Studi Milano-Bicocca
2 Allievo, Programma di formazione post-universitaria, Dir. S. Siervo, Istituto Stomatologico Italiano, Milano
3 Ricercatore non confermato, Università degli Studi di Milano-Bicocca; Responsabile reparto di parodontologia, Clinica Odontoiatrica, Dir. prof. M. Baldoni, ospedale San Gerardo Monza
4 Unità operativa di Chirurgia maxillo facciale, Dir. dottor M. Macchi, Istituto Stomatologico Italiano, Milano
2. Bromelain. Monograph. Altern Med Rev 2010 Dec;15(4):361-8. Review. 3. White RR, Crawley FE, Vellini M, et al. Bioavailability of 125I bromelain after oral administration to rats. Biopharm Drug Dispos 1988;9:397-403. 4. Kumakura S, Yamashita M, Tsurufuji S. Effect of bromelain on kaolin-induced inflammation in rats. Eur J Pharmacol 1988;150:295-301. 5. Uchida Y, Katori M. Independent consumption of high and low molecular weight kininogens in vivo. Adv Exp Med Biol 1986;198:113-118. 6. Taussig SJ, Batkin S. Bromelain, the enzyme complex of pineapple (Ananas comosus) and its clinical application. J Ethnopharmacol 1988;22:191-203. 7. Fitzhugh DJ, Shan S, Dewhirst MW, Hale LP. Bromelain treatment decreases neutrophil migration to sites of inflammation. Clin Immunol 2008;128:66-74. 8. Desser L, Rehberger A, Paukovits W. Proteolytic enzymes and amylase induce cytokine production in human peripheral blood mononuclear cells in vitro. Cancer Biother 1994;9:253-263. 9. Engwerda CR, Andrew D, Murphy M, Mynott TL. Bromelain activates murine macrophages and natural killer cells in vitro. Cell Immunol 2001;210:5-10. 10. Engwerda CR, Andrew D, Ladhams A, Mynott TL. Bromelain modulates T cell and B cell immune responses in vitro and in vivo. Cell Immunol 2001;210:66-75. 11. Barth H, Guseo A, Klein R. In vitro study on the immunological effect of bromelain and trypsin on mononuclear cells from humans. Eur J Med Res 2005;10:325-331. 12. Eckert K, Grabowska E, Stange R, et al. Effects of oral bromelain administration on the impaired immunocytotoxicity of mononuclear cells from mammary tumor patients. Oncol Rep 1999;6:1191-1199. 13. Bhui K, Prasad S, George J, Shukla Y. Bromelain inhibits COX-2 expression by blocking the activation of MAPK regulated NF-kappa B against skin tumor-initiation triggering mitochondrial death pathway. Cancer Lett 2009;282:167-176. 14. Kalra N, Bhui K, Roy P, et al. Regulation of p53, nuclear factor kappaB and cyclooxygenase-2 expression by bromelain through targeting mitogen-activated protein kinase pathway in mouse skin. Toxicol Appl Pharmacol 2008;226:30-37. 15. Mynott TL, Ladhams A, Scarmato P, Engwerda CR. Bromelain, from pineapple stems, proteolytically blocks activation of extracellular regulated kinase-2 in T cells. J Immunol 1999;163:2568-2575. 16. Heinicke RM, Van der Wal M, Yokoyama MM. Effect of bromelain (Ananase) on human platelet aggregation. Experientia 1972;28:844-845. 17. Gläser D, Hilberg T. The influence of bromelain on platelet count and platelet activity in vitro. Platelets 2006;17:37-41. 18. Metzig C, Grabowska E, Eckert K, et al. Bromelain proteases reduce human platelet aggregation in vitro, adhesion to bovine endothelial cells and thrombus formation in rat vessels in vivo. In Vivo 1999;13:7-12. 19. De-Giuli M, Pirotta F. Bromelain: interaction with some protease inhibitors and rabbit specific antiserum. Drugs Exp Clin Res 1978;4:21-23. 20. Tinozzi S, Venegoni A. Effect of bromelain on serum and tissue levels of amoxicillin. Drugs Exp Clin Res 1978;4:39-44. 21. Luerti M, Vignali ML. Influence of bromelain on penetration of antibiotics in uterus, salpinx and ovary. Drugs Exp Clin Res 1978;4:45-48. 22. Renzini G, Varengo M. Absorption of tetracycline in presence of bromelain after oral administration. Arzneimittelforschung 1972;22:410-412. 23. Mynott TL, Guandalini S, Raimondi F, Fasano A. Bromelain prevents secretion caused by Vibrio cholerae and Escherichia coli enterotoxins in rabbit ileum in vitro. Gastroenterology 1997;113:175-184. 24. Chandler DS, Mynott TL. Bromelain protects piglets from diarrhoea caused by oral challenge with K88 positive enterotoxigenic Escherichia coli. Gut 1998;43:196-202. 25. Mynott TL, Luke RK, Chandler DS. Oral administration of protease inhibits enterotoxigenic Escherichia coli receptor activity in piglet small intestine. Gut 1996;38:28-32. 26. Stepek G, Lowe AE, Buttle DJ, et al. In vitro and in vivo anthelmintic efficacy of plant cysteine proteinases against the rodent gastrointestinal nematode, Trichuris muris. Parasitology 2006;132:681-689. 27. Kane S, Goldberg MJ. Use of bromelain for mild ulcerative colitis. Ann Intern Med 2000;132:680 28. Ryan RE. A double-blind clinical evaluation of bromelains in the treatment of acute sinusitis. Headache 1967;7:13-17. 29. Taub SJ. The use of ananase in sinusitis: a study of 60 patients. Eye Ear Nose Throat Mon 1966;45:96,98. 30. Seltzer AP. Adjunctive use of bromelains in sinusitis: a controlled study. Eye Ear Nose Throat Mon 1967;46:1281-1288. 31. Braun JM, Schneider B, Beuth HJ. Therapeutic use, efficiency and safety of the proteolytic pineapple enzyme Bromelain- POS in children with acute sinusitis in Germany. In Vivo 2005;19:417-421. 32. Shoskes DA, Zeitlin SI, Shahed A, Rajfer J. Quercetin in men with category III chronic prostatitis: a preliminary prospective, double-blind, placebo-controlled trial. Urology 1999;54:960-963. 33. Mori S, Ojima Y, Hirose T, et al. The clinical effect of proteolytic enzyme containing bromelain and trypsin on urinary tract infection evaluated by double blind method. Acta Obstet Gynaecol Jpn 1972;19:147-153. 34. Nieper HA. Decrease of the incidence of coronary heart infarct by Mg- and K-orotate and bromelain. Acta Med Empirica 1977;12:614-618. 35. Taussig SJ, Nieper HA. Bromelain: its use in prevention and treatment of cardiovascular disease, present status. J IAPM 1979;6:139-151. 36. Nieper HA. Effect of bromelain on coronary heart disease and angina pectoris. Acta Med Empirica 1978;5:274-278. 37. Blonstein JL. Control of swelling in boxing injuries. Practitioner 1960;185:78. 38. Masson M. Bromelain in blunt injuries of the locomotor system. A study of observed applications in general practice. Fortschr Med 1995;113:303-306. 39. Walker AF, Bundy R, Hicks SM, Middleton RW. Bromelain reduces mild acute knee pain and improves well being in a dose dependant fashion in an open study of otherwise healthy adults. Phytomedicine 2002;9:681-686. 40. Akhtar NM, Naseer R, Farooqi AZ, et al. Oral enzyme combination versus diclofenac in the treatment of osteoarthritis of the knee – a double-blind prospective randomized study. Clin Rheumatol 2004;23:410-415. 41. Klein G, Kullich W, Schnitker J, Schwann H. Efficacy and tolerance of an oral enzyme combination in painful osteoarthritis of the hip. A double-blind, randomised study comparing oral enzymes with non-steroidal anti-inflammatory drugs. Clin Exp Rheumatol 2006;24:25-30. 42. Brien S, Lewith G, Walker AF, et al. Bromelain as an adjunctive treatment for moderate-to-severe osteoarthritis of the knee: a randomized placebo-controlled pilot study. QJM 2006;99:841-850. 43. Klein G, Kullich W. Reducing pain by oral enzyme therapy in rheumatic diseases. Wien Med Wochenschr 1999;149:577-580. 44. Inoue K, Motonaga A, Nishimura T, et al. Mechanism of anti-inflammatory action of etodolac. Arzneimittelforschung 1991;41:235-239. 45. Tassman GC, Zafran JN, Zayon GM. Evaluation of a plant proteolytic enzyme for the control of inflammation and pain. J Dent Med 1964;19:73-77. 46. Tassman GC, Zafran JN, Zayon GM. A double-blind crossover study of a plant proteolytic enzyme in oral surgery. J Dent Med 1965;20:51-54. 47. Seltzer AP. Minimizing post-operative edema and ecchymoses by the use of an oral enzyme preparation (bromelain). EENT Monthly 1962;41:813-817. 48. Gutfreund A, Taussig S, Morris A. Effect of oral bromelain on blood pressure and heart rate of hypertensive patients. Hawaii Med J 1978;37:143-146. 49. Holmes MA, Ruff CB. Dietary effects on development of the human mandibular corpus. Am J Phys Antropol 2011 Aug;145(4):615-28. 50. Marciani RD. Third molar removal: an overview of indications, imaging, evaluation, and assessment of risk. Oral Maxillofac Surg Clin North Am 2007 Feb;19(1):1-13, v. Review. 51. Shepherd JP, Brickley M. Surgical removal of third molars. BMJ 1994;309:620-621. 52. Bouloux GF, Steed MB, Perciaccante VJ. Complications of third molar surgery. Oral Maxillofac Surg Clin North Am 2007 Feb;19(1):117-28, vii. 53. Barden J, Edwards JE, McQuay HJ, Wiffen PJ, Moore RA. Relative efficacy of oral analgesics after third molar extraction. Br Dent J 2004 Oct 9;197(7):407-11; discussion 397. 54. Inchingolo F, Tatullo M, Marrelli M, Inchingolo AM, Picciariello V, Inchingolo AD, Dipalma G, Vermesan D, Cagiano R. Clinical trial with bromelain in third molar exodontia. Eur Rev Med Pharmacol Sci 2010 Sep;14(9):771-4. 55. Hotz G, Frank T, Zöller J, Wiebelt H. Antiphlogistic effect of bromelaine following third molar removal. Dtsch Zahnarztl Z 1989 Nov;44(11):830-2.