• Marcello Maddalone*
• Marcos Maggiani*
• Simone Bramati**
• Giuseppe Giltri**
• Susanna Del Nero***
• Marco Baldoni*
* Università degli Studi Milano Bicocca, Clinica Odontoiatrica, direttore prof. Marco Baldoni
** Ospedale S. Gerardo Monza, Laboratorio di Microbiologia
*** CEFLA Dental Group
Riassunto
In diversi lavori presenti in letteratura, è stato evidenziato che l’acqua in circolo
nei riuniti odontoiatrici può raggiungere una concentrazione batterica di gran lunga superiore a quella consentita per legge nell’acqua potabile. Le ragioni ritenute responsabili di questo fenomeno sono la contaminazione diretta dei circuiti idrici da parte di batteri provenienti dalla rete dell’acqua potabile o aspirati, per reflusso o capillarità, dalla superficie esterna della testina dei manipoli. Lo scopo di questo lavoro è di valutare, con analisi microbiologiche in vivo, le capacità di controllo della contaminazione batterica delle linee idriche dei riuniti odontoiatrici offerte da un sistema combinato basato su cicli periodici di disinfezione e immissione in continuo di perossido di idrogeno a 300 e 600 ppm all’interno delle linee idriche. I risultati ottenuti hanno evidenziato che il sistema adottato consente - con una concentrazione di 600 ppm di perossido di idrogeno erogato in continuo nei circuiti idrici del riunito testato, combinata con un ciclo di disinfezione quotidiano - di portare la carica batterica contaminante al di sotto della soglia di rilevabilità dei test culturali microbiologici adottati.
Parole chiave: perossido di idrogeno, sistemi di disinfezione, riuniti odontoiatrici
Summary
Bacterials counts in dental chair water lines: evaluation of the possibilities offered by decontamination protocol based on different concentrations of hydrogen peroxid Different papers showed that bacterial contamination of dental unit waterlines can reach much higher concentrations than allowed for potable water, according to European Community Standards. Reasons for that are recognized in direct contamination from bacteria present in potable water that supplies dental units or aspirated from the outer surface of dental handpieces. Data obtained show that a daily disinfection cycle in combination with concentrations of 600 ppm of hydrogen peroxide continuously supplied in dental unit waterlines allowed to reduce bacterial contamination under the level of sensitivity of the adopted microbiological assay.
Key words: hydrogen peroxide, dental units, disinfection systems
È noto a tutti come la salute del cavo orale sia in stretto rapporto con il benessere generale ed è stato anche dimostrato come alcuni operatori odontoiatrici presentassero un’alterazione della flora batterica nasale, con colonizzazione di batteri congruenti con quelle trovate nei loro riuniti1. Nonostante questo, persiste in tanti operatori odontoiatrici l’idea, sbagliata, che la qualità dell’acqua in entrata al riunito sia uguale a quella in uscita e, di conseguenza, si tende a concentrarsi sulla sterilizzazione di tutto il materiale utilizzato per le diverse pratiche odontoiatriche, trascurando il fatto che, di routine, si immettono nel cavo orale dei pazienti quantità rilevanti di batteri contenuti nell’acqua2. Infatti, l’acqua di rete con una carica batterica bassa, conforme alle norme in vigore per l’acqua potabile, passando attraverso i tubi interni del riunito si contamina con il biofilm e, in uscita, si possono riscontrare3 risultati variabili da centinaia a milioni di CFU/ml. Si consideri, poi, che la maggior parte dei batteri che formano il biofilm contenuto nel sistema idrico del riunito odontoiatrico derivano dall’acqua e, comunemente, non rappresentano un rischio elevato per pazienti immunocompetenti, ma lo stesso non può dirsi per pazienti immunodepressi4.
Questi pazienti, così come gli operatori, possono ingerire l’acqua o inalare l’aerosol formatosi durante le manovre odontoiatriche, anche se non esiste un’evidenza scientifica che abbia sufficientemente dimostrato che questo possa provocare direttamente una malattia, è chiaro che le caratteristiche dell’acqua degli spray utilizzati per il raffreddamento degli strumenti rotanti debbano comunque rispettare gli standard minimi richiesti dalla Comunità Europea e, possibilmente, raggiungere requisiti di qualità anche superiori, comprimendo la carica batterica identificabile dall’acqua in uscita al riunito a livelli non rilevabili3-5. Nel 1963, Blake ha per primo descritto la contaminazione batterica dei sistemi idrici dei riuniti odontoiatrici2,6, ma soltanto recentemente è diventato un argomento di attenzione generale, soprattutto in seguito alla pubblicazione di rapporti che riferivano della contaminazione dei riuniti odontoiatrici e della possibilità di contrarre infezioni nel corso di procedure che si svolgono di routine nello studio odontoiatrico. Negli Stati Uniti hanno avuto moltissima risonanza due casi di contenzioso riguardanti la presunta infezione crociata derivante dall’acqua dei riuniti odontoiatrici. Entrambe le cause sono state risolte fuori dai tribunali, ma con un’ampia ripercussione nell’opinione pubblica7, tale da determinare comunque una forte sensibilizzazione a proposito di questa tematica utile ai fini di un miglioramento dell’igiene pubblica. La qualità dell’acqua erogata da un riunito odontoiatrico dipende essenzialmente da due fattori:
• presenza del biofilm all’interno dei tubi;
• qualità dell’acqua in entrata.
Formazione del biofilm
Nonostante la qualità dell’acqua in entrata rispetti gli standard della Comunità Europea per l’acqua potabile, la presenza del biofilm, che funge da serbatoio di batteri8,9, provoca sempre la contaminazione dell’acqua in uscita2. Il biofilm e i batteri che lo compongono si trovano ovunque in natura, dove un liquido entra in contatto con una superficie dura. In ambiente acquoso, i nutrienti sono più abbondanti vicino a superfici solide, di conseguenza, i batteri tendono ad aderire alle superfici come strategia di sopravvivenza. Il biofilm può essere definito come: “una comunità strutturata di cellule batteriche incluse in una matrice polimerica di produzione autoctona e aderente a una superficie inerte o tissutale”8. La colonizzazione dei circuiti idrici dei riuniti odontoiatrici avviene tramite la contaminazione già presente nell’acqua di rete (seppur minima) o anche tramite l’aspirazione dei fluidi orali dagli strumenti dinamici che funzionano con l’aria o l’acqua, quando le valvole anti-aspirazione non funzionano correttamente. Recenti studi dimostrano, tuttavia, che essa si verifica anche quando queste valvole funzionano o il riunito è dotato di un sistema idrico separato che lavora con acqua sterile2,4. Altra eventuale causa d’infezioni crociate è la qualità dell’aria.
L’aria può essere contaminata a causa del sistema d’aria compressa utilizzato o dall’acqua del riunito nei punti dove questi entrano in contatto. Questo tipo di trasmissione viene normalmente trascurato, nonostante sembri che si verifichi più spesso di quanto si creda3. Per attuare la disinfezione e, di conseguenza, raggiungere gli standard di erogazione, l’acqua di rete pubblica viene trattata con il cloro. Il residuo di cloro che rimane nell’acqua distribuita tramite la rete pubblica non è sufficiente a bloccare la crescita dei batteri rimasti nell’acqua e, tanto meno, a eliminare i batteri aspirati dalla cavità orale2. In letteratura, è stato descritto come, indipendentemente dal fatto che ci sia o meno circolazione d’acqua, dopo qualche settimana di contatto con una superficie si verifichi sempre e comunque la formazione di biofilm. In più, indipendentemente dalla fonte di acqua in entrata, in un determinato riunito odontoiatrico la formazione del biofilm si verificherà anche se nessun paziente viene trattato su quel riunito2.
Qualità dell’acqua
Non esistono linee guida proposte dalla Comunità Europea concernenti le caratteristiche dell’acqua in uscita dai riuniti odontoiatrici; di conseguenza, sarebbe importante per la salute pubblica che la CE stabilisse regole certe circa la qualità dell’acqua e, soprattutto, sui controlli da effettuare sui riuniti odontoiatrici9. Dal 1994, esistono, invece, delle linee guida della CE per l’acqua potabile, che stabiliscono come la concentrazione batterica non debba superare i 100 CFU/ml4,9,16. Negli Stati Uniti, l’ADA aveva stabilito, per l’anno 2000, che l’acqua in uscita dai riuniti odontoiatrici dovesse presentare una concentrazione batterica inferiore a 200 CFU/ml4,5. L’ADA, a luglio del 2004, ha unificato il criterio a quello dei CDC (Center for Disease Control) e dell’EPA (Environmental Protection Agency) per l’acqua potabile, stabilendo il limite massimo in 500 CFU/ml10,17. Studi sulla contaminazione dei riuniti odontoiatrici dimostrano la presenza, nell’acqua in uscita, di batteri ambientali, quindi non patogeni, ma anche di batteri tipici del cavo orale3,9. Tra questi si includono Actinomyces spp., Fusobacterium spp., Peptostreptococcus spp., batteri patogeni opportunistici come Pseudomonas, Moraxella, Klebsiella che sono stati ritrovati nell’acqua dei riuniti odontoiatrici7,18.
Fattori come l’età e il tipo di circuito idrico del riunito si crede che possano influenzare lo sviluppo e l’aumento della contaminazione batterica9. I riuniti odontoiatrici di nuova generazione presentano circuiti idrici studiati per ridurre o addirittura risolvere tale problema. La conversione dei vecchi riuniti odontoiatrici può rappresentare un costo particolarmente oneroso e, di conseguenza, la ricerca dovrebbe indirizzarsi sulle tecniche e sui prodotti in grado di ridurre la carica batterica a meno di 100 CFU anche nei riuniti odontoiatrici di vecchia generazione che non dispongono di sistemi automatizzati per questo fine6. Si è visto, inoltre, che i circuiti idrici chiusi, che utilizzano acqua distillata senza l’aggiunta di disinfettanti, non rispettano comunque le norme dell’ADA, perché la carica batterica rimane elevata e si verifica comunque la formazione di biofilm6 e, pertanto, un sistema di disinfezione dell’acqua dei riuniti odontoiatrici deve comunque essere previsto per ridurre la carica batterica a concentrazioni accettabili. Per combattere la proliferazione batterica e la formazione di biofilm è possibile intervenire, teoricamente, in tre modi:
• sostituzione dei tubi;
• prevenzione della fase di adesione batterica (fase reversibile);
• eliminazione dei batteri dall’acqua.
La sostituzione dei tubi di vario diametro in cui circola l’acqua dei riuniti non rappresenta, di per sé, una soluzione definitiva, in quanto non sarebbe possibile sostituire tutti i componenti e, di conseguenza, non sarebbe possibile decontaminare compiutamente il riunito odontoiatrico. Quindi, non rimane che lavorare sull’adesione e la proliferazione batterica8.
Disinfezione del riunito odontoiatrico
Negli ultimi anni, diversi lavori sulla disinfezione dei riuniti odontoiatrici sono stati proposti utilizzando diversi sistemi di disinfezione e diversi prodotti (tabella 1). Come si può evincere dai dati di letteratura espressi in tabella 1, gran parte dei lavori si sono concentrati su sistemi di disinfezione basati sull’utilizzo di perossidi di idrogeno, in varie formulazioni commerciali e differenti sistemi di erogazione. I tempi di analisi sono sempre stati limitati, eccetto in un caso in cui la sperimentazione si è prolungata per circa un anno.
Proprietà disinfettanti del perossido di idrogeno
Quando il perossido di idrogeno al 3% viene a contatto con tessuti viventi, le catalasi e le perossidasi presenti ne inducono la decomposizione e successivamente si verifica una rapida scomparsa dell’effetto battericida. Ne deriva la difficoltà nel definire il potere antisettico del perossido di idrogeno, che è da considerarsi un prodotto ad azione blanda, ma che rende l’ambiente inadatto alla crescita di batteri anaerobi. Il potere di detersione delle molecole di ossigeno gassoso favorisce il distacco di tessuti necrotici e di ammassi di batteri. Usato a concentrazioni superiori al 3% su superfici inerti e libere da inattivanti della catalasi e perossidasi si verifica un’azione battericida, attiva in tempi brevi su anaerobi Gram-, compreso Pseudomonas aeruginosa, Gram+ e su funghi, mentre nei confronti di alcuni virus è attivo, ma con un’azione più lenta. Per ottenere un effetto sporicida sono consigliate concentrazioni tra 6 e 30%22.
L’ossigeno, liberato dal perossido di idrogeno, e la stessa molecola di perossido sono ossidanti a lenta azione; l’effetto battericida del prodotto sarebbe mediato dal radicale –OH. Il radicale idrossilico presenta un’elevata reattività con effetto ossidativo su membrane lipidiche, DNA e altri componenti essenziali dei microrganismi. Le soluzioni di perossido di idrogeno si decompongono a contatto con sostanze organiche ossidabili; questa decomposizione è poi favorita anche dal calore. Gli effetti indesiderati dell’azione topica sono solo leggermente lesivi sui tessuti. In alte concentrazioni è caustica per cute e mucose. Un impiego continuato nell’igiene del cavo orale può provocare ipertrofia delle papille linguali, ma una soluzione di perossido di idrogeno al 3% in tre-otto parti d’acqua può essere tranquillamente utilizzato come collutorio o gargarismo11.
Obiettivi della ricerca
Il presente lavoro si propone di testare l’efficacia, durante la routine clinica, di due sistemi di disinfezione dell’acqua dei riuniti accoppiati e di semplice utilizzo verificando:
• l’efficacia del sistema automatico di disinfezione per portare la qualità dell’acqua in uscita a norma con le linee guida CE per l’acqua potabile;
• l’ottimale frequenza dei cicli e la percentuale di disinfettante utile a ridurre la rilevazione di CFU/ml entro i limiti di tollerabilità.
Materiali e metodi
Presso la Clinica Odontoiatrica dell’Ospedale San Gerardo di Monza è stato installato un riunito odontoiatrico messo a disposizione da Cefla Dental Group appositamente per realizzare la ricerca. Il riunito era dotato di dei sistemi di disinfezione Bioster e WHE (Water Hygienisation Equipment) (figura 1). La poltrona test, utilizzata nella ricerca, è una Anthos A7 Plus Continental con i sistemi di disinfezione sopraccitati (figura 2). Per evitare la retrocontaminazione provocata dall’aspirazione di liquidi dalla cavità orale, questo riunito è dotato di un sistema che blocca il flusso d’acqua dello strumento quando si interrompe l’utilizzo e invia un flusso d’aria per togliere le gocce di acqua residua presenti sulla testa del manipolo22. La poltrona è collegata all’acqua di rete pubblica tramite un filtro a membrane. L’acqua filtrata raggiunge direttamente la bacinella e il sistema di lavaggio cannule dell’aspirazione. La poltrona è stata utilizzata per la routine clinica senza l’applicazione di nessun ciclo per tre mesi prima dell’inizio del test. Come disinfettante per i circuiti idrici è stato utilizzato il perossido di idrogeno al 3%.
La poltrona controllo, una Anthos A5, è stata utilizzata normalmente per molteplici trattamenti odontoiatrici cinque giorni a settimana per sei o sette ore al giorno, esattamente come la poltrona test. Non è stato realizzato nessun trattamento di disinfezione su questa poltrona (figura 3). La poltrona controllo e la poltrona test sono state messe in funzione nello stesso periodo e collegate alla stessa rete idrica. Il bicchiere, la siringa assistente e gli strumenti sulla tavoletta del medico sono alimentati da un sistema di disinfezione in continuo (WHE) che, attraverso una miscela di perossido d’idrogeno, produce un effetto batteriostatico nei circuiti idrici del riunito. Il ciclo di disinfezione (Bioster) utilizza il perossido di idrogeno al 3% per la disinfezione dei tubi. Il ciclo prevede la selezione delle linee idriche da disinfettare come l’acqua del bicchiere, la siringa assistente e tutti gli strumenti della tavoletta del medico. Il sistema, una volta selezionato il tempo, procede in automatico a realizzare le seguenti operazioni:
• svuotamento di tutte le linee idriche selezionate per la disinfezione utilizzando aria compressa;
• riempimento delle stesse linee con perossido d’idrogeno;
• permanenza del disinfettante per il tempo selezionato;
• svuotamento dei circuiti;
• lavaggio delle tubature con acqua di rete.
Prima di iniziare la sperimentazione, il riunito test è stato decontaminato con una serie ravvicinata di cicli di disinfezione e con l’attivazione del sistema WHE per una settimana. La valutazione del sistema di autodisinfezione è stata divisa in due fasi ripetendo sempre lo stesso schema sperimentale. La prima fase è stata compiuta con una concentrazione di perossido d’idrogeno per il sistema WHE di 600 ppm, e la seconda fase con 300 ppm. Il protocollo prevedeva la realizzazione dei cicli di disinfezione dopo ogni giornata di lavoro, con un tempo di contatto del disinfettante con le tubature di 6 minuti e il prelievo dei campioni d’acqua una volta a settimana. La possibilità di effettuare il ciclo di disinfezione tutti i giorni è favorita dal relativo impegno richiesto da parte dell’operatore. Gli step automatici di svuotamento, riempimento con il disinfettante, svuotamento e risciacquo dei tubi durano circa otto o nove minuti; se a questo si somma il tempo di permanenza scelto, corrispondente a sei minuti, si ottiene come risultato un tempo totale di circa quindici minuti.
A questo va addizionato il tempo necessario per l’avvio del programma Bioster, il tempo necessario a posizionare gli strumenti nell’apposito recipiente e riposizionarli alla fine del ciclo che può essere, in totale, di circa 2 o 3 minuti; è solo quest’ultimo il tempo effettivo durante il quale l’operatore è direttamente impegnato nella realizzazione del ciclo, in quanto nel restante periodo il processo prosegue in modo autonomo. I campioni d’acqua dei circuiti idrici sono stati prelevati in provette sterili e portati al laboratorio di microbiologia dell’Ospedale San Gerardo immediatamente dopo il prelievo. L’analisi dei campioni è stato eseguito sui seguenti terreni di coltura12:
TRYPTIC SOY BLOOD AGAR BASE (TSA)
Piastra incubata a venti e a trentasei gradi centigradi per 5 giorni. Terreno di base con l’aggiunta di sangue animale adatto alla coltivazione dei microrganismi patogeni più comuni.
Formula:
Triptone 14,5 g/l
Peptone di soia 5,0 g/l
Sodio cloruro 5,0 g/l
Agar 14,0 g/l
Fattori di crescita 1,5 g/l
CHOCOLATE AGAR ENRICHED (Cioc)
Piastra incubata a trentasei gradi centigradi per 5 giorni in atmosfera al 5% di CO2. Terreno d’uso generale per la coltivazione di microrganismi esigenti.
Formula:
GC Medium Base 1000 ml
Sangue defibrinato sterile di cavallo 70 ml
Biovitex 10 ml
GC Medium Base:
Pepetocomplex 15,0 g/l
Amido 1,0 g/l
Potassio fosfato bibasico 4,0 g/l
Potassio fosfato monobasico 1,0 g/l
Sodio cloruro 5,0 g/l
Agar 12,0 g/l
SCHAEDLER BLOOD
AGAR (SCH)
Piastra con emina vitamina K1 e sangue di montone per l’isolamento degli anaerobi incubata in anaerobiosi a trentasei gradi centigradi per 5 giorni.
Formula:
Schaedler Agar 1000 ml
Sangue defibrinato di montone 50 ml
Vitamina K1 10 ml
Schaedler Agar:
Tryptic Soy Broth 10,00 g/l
Triptone 5,00 g/l
Estratto di lievito 5,00 g/l
Glucosio 5,00 g/l
L-Cisteina HCL 0,40 g/l
Emina 0,01 g/l
Tampone Tris 0,75 g/l
Agar 13,50 g/l
Risultati
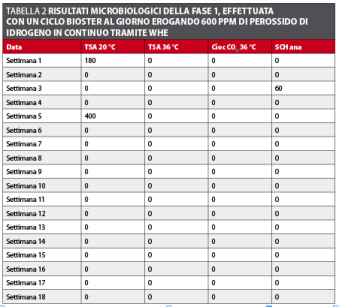
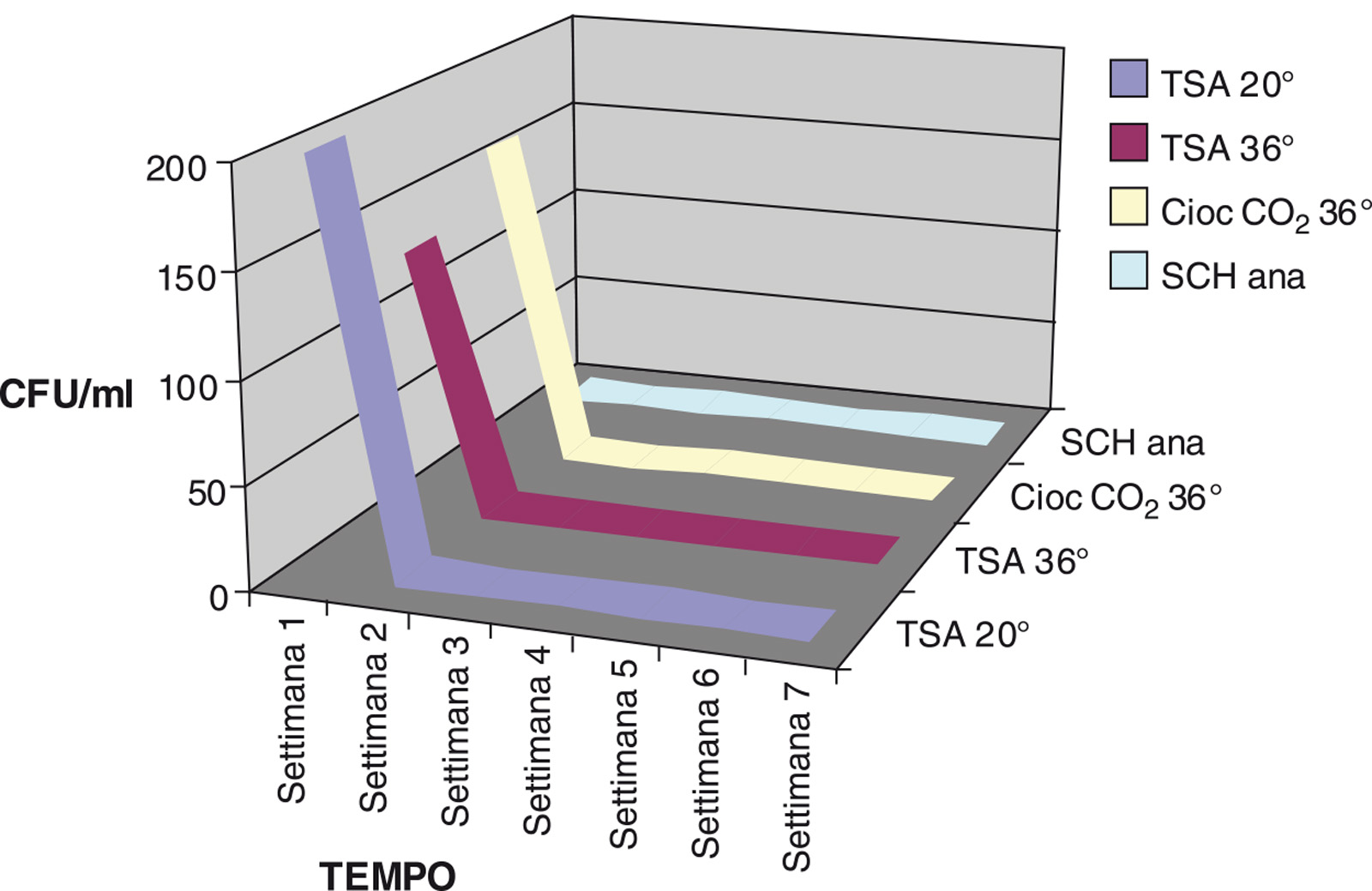
Fase 1 (WHE a 600 ppm) Durante la prima settimana l’effettuazione di cicli di disinfezione più ravvicinati si è dimostrata efficace nel ridurre la carica batterica dell’acqua del riunito. La carica batterica totale dei circuiti idrici si è subito ridotta a meno di 10 CFU/ml nei primi cicli e si è mantenuta tale per tutto il periodo della sperimentazione (tabella 2 e figura 3). Dopo la prima settimana i cicli di disinfezione sono stati realizzati solo a fine giornata secondo il protocollo stabilito con risultati che rispettano le linee guida sia della Comunità Europea per l’acqua potabile sia dell’ADA per l’acqua erogata dai riuniti odontoiatrici.
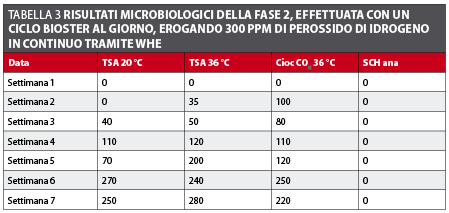
Fase 2 (WHE a 300ppm) Il primo prelievo ha prodotto un risultato paragonabile a quelli della Fase 1 con una carica batterica minore di 10 CFU/ml. I risultati successivi hanno mostrato un’evidente tendenza all’aumento della carica batterica (tabella 3 e figura 4).
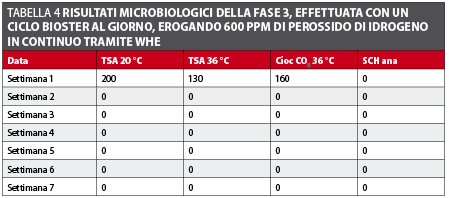
Fase 3 A questo punto, il sistema WHE è stato tarato di nuovo a 600 ppm e, in due settimane, i risultati sono tornati a meno di 10 CFU/ml (tabella 4 e figura 5).
Acqua di rete
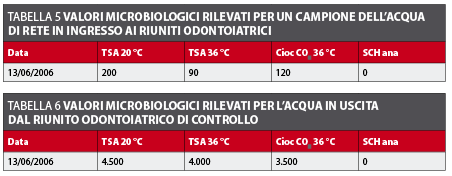
Per verificare la qualità del acqua in entrata al riunito odontoiatrico è stato prelevato un campione dell’acqua di rete per rilevare la carica batterica. Il risultato evidenzia una carica media lievemente superiore alle linee guida della CE per l’acqua potabile, ma accettabile per il periodo estivo (tabella 5).
Poltrona controllo
La carica batterica media dell’acqua in uscita dal riunito odontoiatrico di controllo risulta molto elevata. In questa poltrona non è stato effettuato alcun tipo di trattamento di disinfezione ed è alimentato dalla stessa acqua di rete che alimenta la poltrona test (tabella 6).
Discussione
Dalla disamina della letteratura internazionale sull’argomento, è noto che i cicli di disinfezione devono essere realizzati tutti i giorni, per riuscire a mantenere nel tempo una carica batterica bassa13. La scelta di effettuare i cicli dopo ogni giornata di lavoro e per un tempo ridotto di contatto con il disinfettante (il range, previsto dal sistema Bioster, va da minimo 5 minuti a un massimo di 30 minuti) è stata motivata dalla revisione della letteratura internazionale sull’argomento. In quasi tutti i lavori selezionati, infatti, i disinfettanti erano capaci di portare la carica batterica dell’acqua del riunito entro i valori proposti dall’ADA, ma tanti fallivano nell’inibizione della crescita del biofilm. È stato ipotizzato, infatti, che se il sistema di disinfezione continuo WHE con effetto batteriostatico nell’acqua manteneva la carica batterica a bassi livelli e se il ciclo di disinfezione Bioster con effetto battericida eliminava dopo ogni giornata lavorativa la maggior parte di biofilm in formazione (dato che una volta che si stabilizza e si organizza nei tubi è molto più difficile da rimuovere) la quantità di biofilm nei tubi sarebbe stata ridotta e la qualità dell’acqua si sarebbe mantenuta nel tempo. I riuniti odontoiatrici di vecchia generazione, non predisposti per tale trattamento, rendono la procedura molto impegnativa e non trovano una buona compliance negli operatori dello studio odontoiatrico che devono realizzare tale procedura14.
Nel caso di riuniti odontoiatrici dotati di queste procedure automatizzate, tale problema non si presenta, in quanto la realizzazione del ciclo di disinfezione tutti i giorni non è impegnativa e il tempo in cui l’operatore è direttamente occupato è minimo e, di conseguenza, non interferisce con la normale operatività di chiusura della giornata lavorativa dello studio odontoiatrico. In particolare, la poltrona in esame realizza le operazione automatiche di svuotamento, riempimento con il disinfettante, svuotamento del disinfettante e risciacquo dei circuiti idrici in circa otto - nove minuti. A questo va aggiunto il tempo di contatto scelto (sei minuti nel presente studio) e si arriva a un totale di circa 15 minuti per tutte le operazione automatiche. Il tempo in cui l’operatore è impegnato nell’avvio del sistema di disinfezione, che consiste nel posizionare gli strumenti nell’apposito recipiente e riportarli alla fine al loro posto, può essere calcolato in un totale di circa 2 - 3 minuti, quindi l’unico tempo in cui l’operatore incaricato della disinfezione è occupato direttamente nella realizzazione dei processi è molto ridotto, non interferendo così nelle procedure abituali in cui l’assistente è impegnato a fine giornata. Un’altra questione da risolvere, per riuscire a effettuare il trattamento di disinfezione quotidianamente, è il costo dei disinfettanti specifici per riuniti odontoiatrici. A tale proposito, l’uso del perossido di idrogeno presenta un ulteriore vantaggio, per il basso costo e la sua facile reperibilità. L’analisi dell’acqua di rete pubblica (tabella 5) e l’analisi della carica batterica totale della poltrona controllo (tabella 6) dimostrano che i circuiti idrici del riunito odontoiatrico sono un mezzo ideale per la crescita batterica.
La loro disinfezione deve essere incorporata alle procedure di routine effettuate in uno studio odontoiatrico. L’efficacia del perossido di idrogeno come disinfettante è stata ampiamente dimostrata, quando utilizzata nelle concentrazioni adeguate. Ulteriori indagini dovrebbero realizzarsi al fine di valutare gli effetti a lungo termine sull’integrità dei tubi del riunito odontoiatrico. Per quanto riguarda l’utilizzo del sistema di disinfezione in continuo dell’acqua del riunito, dal momento che il perossido di idrogeno viene utilizzato diluito in acqua e in concentrazioni ancora maggiori come collutorio da molto tempo senza provocare effetti indesiderati11, si ritiene che non sussistano rischi per i pazienti. I risultati dell’analisi dei campioni sono stati omogenei, tranne che per il prelievo della settimana 5 che è stato di 400 CFU/ml. Questo valore non uniforme potrebbe essere imputato a una contaminazione del campione proveniente dalla testina del manipolo. Questi fattori sarebbero confermati dal riscontro che simili valori non si sono più ripetuti per tutta la durata della Fase 1. I risultati della Fase 2, con un’evidente tendenza alla crescita, possono essere spiegati non solo a causa della minore concentrazione di perossido di idrogeno, ma anche dalle temperature elevate del periodo estivo, che accelerano la moltiplicazione batterica. Un altro fattore che può avere influenzato la comparsa di questi risultati elevati è rappresentato dal fatto che le soluzioni di perossido di idrogeno si decompongono a contatto con sostanze organiche ossidabili e che questa decomposizione è favorita dal calore11.
Va considerato, inoltre, che in estate la carica batterica originalmente presente nell’acqua di rete pubblica è maggiore. Il trattamento di disinfezione in continuo (WHE) si è rilevato molto più efficace se tarato a 600 ppm. Questo coincide con i dati riportati da O’Donnell et al.15 nel 2006, che hanno verificato migliori risultati nella disinfezione dei circuiti idrici del riunito odontoiatrico utilizzando un prodotto con una concentrazione maggiore di perossido di idrogeno rispetto ad altri. Il fatto che i cicli di disinfezione siano sempre stati eseguiti in modo identico, accoppiati con il sistema di disinfezione in continuo sempre attivo, sia a 300 ppm sia a 600 ppm, dimostra che il solo ciclo di disinfezione non è sufficiente a mantenere livelli accettabili di contaminazione delle acque del riunito. Questo riscontro trova supporto nella letteratura internazionale, in cui i cicli di disinfezione a fine giornata fallivano nel mantenere la carica batterica entro i valori stabiliti dall’ADA. I due precedenti riscontri comprovano la tesi, proposta all’inizio della sperimentazione, sulla necessità di utilizzare un trattamento di disinfezione batteriostatico in continuo per inibire la crescita batterica e, contemporaneamente, effettuare trattamenti di disinfezione a fine giornata per la rimozione del biofilm in formazione.
Conclusioni
Dai risultati ottenuti e dalle considerazioni compiute, è possibile concludere che i cicli di disinfezione giornalieri senza un efficace sistema di disinfezione in continuo non garantiscono il rispetto dei valori consigliati dall’ADA né delle linee guida della CE per l’acqua potabile. Il ciclo a 300 ppm, pur non portando il valore di CFU/ml sotto una soglia rilevabile, ha dimostrato anche in condizioni di temperatura sfavorevoli (estate) la capacità di mantenere il valore di CFU rilevato al di sotto della metà del valore soglia oggi individuato dall’ADA per i riuniti odontoiatrici. Il ciclo a 600 ppm ha ridotto costantemente sotto la soglia di rilevazione (meno di 10 CFU/ml) la quantità di microrganismi presenti nei circuiti idrici del riunito in tutte le condizioni climatiche testate normalizzando, nell’arco di 7 giorni, anche valori alterati. Anche se la contaminazione delle DUWL (Dental Unit Water Lines) non rappresenta un’emergenza di salute pubblica, un’acqua che non presenta i requisiti minimi di potabilità non dovrebbe essere usata in odontoiatria e, pertanto, per operare in condizioni di assoluta sicurezza il ciclo che prevede l’utilizzo di concentrazioni a 600 ppm è altamente consigliabile.
Si consideri, anche, che questa concentrazione è pari a un quarto di quella minima normalmente utilizzata per confezionare soluzioni di perossido di idrogeno per sciacqui orali e, di conseguenza, senza alcun effetto irritante sulle mucose orali. In conclusione, è poi necessario sottolineare che se è vero, come appurato da questa ricerca, che ai fini preventivi sono di primaria importanza sia l’utilizzo di sistemi di disinfezione combinati (sistema di disinfezione in continuo accoppiato a di cicli di disinfezione a fine giornata) è altrettanto doveroso sottolineare come l’efficacia di questi mezzi assuma particolare rilevanza solo in presenza di un apporto fondamentale, quale un’adeguata compliance del personale incaricato con le procedure da ottemperare. Sicuramente, il fatto di poter attuare protocolli semplici e automatizzati, come quelli descritti, potrà consentire di raggiungere agevolmente gli obiettivi di miglioramento delle condizioni igieniche in cui operano i professionisti odontoiatrici.
Ringraziamenti
Si ringrazia CEFLA Dental Group (Imola, BO) per avere fornito il riunito su cui è stata eseguita l’indagine.
Corrispondenza
dott. Marcello Maddalone Università degli Studi Milano Bicocca, Clinica Odontoiatrica via Pergolesi 33 - 20052 Monza (MI) e-mail marcello.maddalone@unimib.it
bibliografia
1. Porteous NB, Redding SW, Thompson EH, Grooters AM, De Hoog S, Sutton DA. Isolation of unusual fungus in treated dental unit waterlines. J Am Dent Assoc 2003 Jul;134(7):853-8.
2. Lee TK, Waked EJ, Wolinsky LE, Mito RS, Danielson RE. Controlling biofilm and microbial
contamination in dental unit waterlines. J Calif Dent Assoc 2001 Sep;29(9):679-84.
3. Walker RJ, Burke FJ, Miller CH, Palenik CJ. An investigation of the microbial contamination of
dental unit air and water lines. Int Dent J 2004 Dec;54(6):438-44.
4. Monarca S, Garusi G, Gigola P, Spampanato L, Zani C, Sapelli PL. Decontaminazione del sistema idrico del riunito mediante disinfezione e filtrazione. Min Stomat 2002 Oct;51(10):451-9.
5. ADA Council on Scientific Affairs. Dental unit waterlines: Approaching the year 2000. J Am Dent Assoc 1999;130:1653-64.
6. Kettering JD, Muñoz-Viveros CA, Stephens JA,
Naylor PA, Zhang W. Reducing bacterial counts
in dental unit waterlines: distilled water vs.
antimicrobial agents. J Calif Dent Assoc 2002 Oct;30(10):735-41.
7. Kettering JD, Stephens JA, Muñoz-Viveros CA, Naylor PA. Reducing bacterial counts in dental unit waterlines: tap water vs. distilled water. J Contemp Dent Pract 2002 Aug 15;3(3):1-9.
8. Porteous NB, Cooley RL. Reduction of bacterial levels in dental unit waterlines. Quintessence Int 2004 Sep;35(8):630-4.
9. Forde A, O’Reilly P, Fitzgerald G, O’Mullane D,
Burke FM, O’Sullivan M. Microbial contamination of dental unit water systems. J Ir Dent Assoc 2005 Autumn;51(3):115-8.
10. ADA. Statement on dental unit waterlines. luglio 2004. www.ada.org
11. Curti C. I disinfettanti in ospedale. Roma: Il Pensiero Scientifico Editore, 1992.
12. Manuale Biolife. Terza Ed. Milano: Biolife Italiana.
13. Zanetti F, De Luca G, Tarlazzi P, Stampi S. Decontamination of dental unit water systems
with hydrogen peroxide. Lett Appl Microbiol 2003;37(3):201-6.
14. Wirthlin MR, Marshall GW Jr, Rowland RW. Formation and decontamination of biofilms in dental unit waterlines. J Periodontol 2003 Nov;74(11):1595-609.
15. O’Donnell MJ, Shore AC, Coleman DC. A novel automated waterline cleaning system that
facilitates effective and consistent control of microbial biofilm contamination of dental chair unit
waterlines: a one-year study. J Dent 2006 Jan 23; [epub ahead of print].
16. Direttiva 98/83/CE del Consiglio del 3 novembre 1998 concernente la qualità delle acque destinate
al consumo umano (GUCE 5 dicembre 1999 n. L 330) consultabile su: http://eur-lex.europa.eu/LexUriServ/site/it/oj/1998/l_330/l_33019981205it00320054.pdf
17. Guidelines for infection control in dental
health-care settings MMWR recommendations and reports. December 19, 2003;52(RR17):1-61 consultabile su: http://www.cdc.gov/mmwr/preview/mmwrhtml/rr5217a1.htm
18. Orrù G, Orrù G, Cuisa ML, Pusceddu G, Piras V, Del Nero S, Montaldo C. Valutazione dell’attività antimicrobica di un sistema decontaminante a base di perossido d’idrogeno. Risultati in vitro e su riunito odontoiatrico. Dent Mod 2006;10:60-71.
19. Panagakos FS, Lassiter T, Kuman E. Dental unit waterlines: review and product evaluation. J N J Dent Assoc 2001 Spring;72(2):20-5,38.
20. Palenik CJ, Miller CH. The effect of distillation
and line cleaning on the quality of water emitted from dental units. Am J Dent 2003 Dec;16(6):385-9.
21. Shepherd PA, Shojaei MA, Eleazer PD, Van
Stewart A, Staat RH. Clearance of biofilms from dental unit waterlines through the use of hydroperoxide ion-phase transfer catalysts. Quintessence Int 2001;32(10):755-61.
22. Savino et al. Decontaminazione batterica dei riuniti odontoiatrici. Dent Mod 2003;8:79-102.