Le malattie parodontali sono un possibile fattore di rischio modificabile per la morbilità e mortalità in numerose malattie sistemiche1-4 con un evidente impatto sulla qualità della vita del paziente5,6. Complessivamente colpiscono più dell’80% della popolazione adulta in tutto il mondo e circa il 13% mostra gravi malattie concomitanti con la perdita precoce dei denti7. Nella parodontite i cambiamenti nocivi che avvengono sui tessuti di sostegno dei denti sono il risultato di specifici assalti microbici8-10. Queste situazioni in un ospite suscettibile alla malattia distruggono l’integrità funzionale e strutturale dell’apparato di supporto del dente11. È noto che la struttura e le proprietà dei tessuti parodontali sono strettamente legate alle cruciali interazioni tra cellule e matrice12-16. I meccanismi con cui questi microrganismi minacciano e compromettono la modulazione di tali eventi sinergici non sono del tutto noti. La regolazione corretta di queste interazioni in un ambiente meccanicamente dinamico, come il parodonto, determina la risposta adattiva dento-alveolare, coordinando la funzione di importanti proteine bioattive quali i fattori di crescita, citochine e proteasi (Figura 1)17-20. Le proteine che regolano queste interazioni sono complessivamente note come molecole matricellulari21-24. L’obiettivo di questo studio è di presentare e discutere le evidenze a riguardo della molecola matricellulare periostina nel contesto del parodonto.
Cos’è la periostina?
La periostina è una proteina dalla funzione relativamente poco conosciuta, che ha analogie con la fasciclina-I, una proteina del sistema nervoso centrale degli insetti, presente in modo significativo negli organismi superiori25. La proteina è omologa a βig-h3, una molecola indotta da TGF-β che promuove l’adesione e la diffusione dei fibroblasti. Quindi si crede che la periostina funzioni come una molecola di adesione durante la formazione dell’osso e possa supportare l’attacco e la diffusione di una linea di cellule osteoblastiche26. È stato dimostrato che la periostina purificata e ricombinata è un legante per le integrine αvβ3 e αvβ5, promuovendo l’adesione e la mobilità integrinodipendente27. Numerosi report hanno mostrato livelli elevati di periostina in neuroblastoma28, cancro ovarico epiteliale27 e carcinoma polmonare29 non a piccole cellule che ha subito una trasformazione mesenchimale epiteliale (EMT) e metastasi. Inoltre, è stato dimostrato che la periostina promuove notevolmente la sopravvivenza cellulare attraverso il percorso Akt/PKB30. È stata inoltre associata con il deposito della matrice extracellulare (ECM) successivo all’infarto miocardico ed è stato riportato che, a seguito di una tale patologia acuta, la proteina risulta essere essenziale per la guarigione31,32.
Perché la periostina?
Inizialmente è stato mostrato che la periostina si trova nei denti in fase di sviluppo nei siti di interazione epitelio mesenchimale, elemento che suggerisce che questa proteina potrebbe giocare diversi ruoli come molecola di risposta principale durante lo sviluppo del dente e potrebbe essere legata al deposito e all’organizzazione di altre molecole di adesione durante il mantenimento del parodonto33. Si è trovato che l’mRNA della periostina era regolato negativamente dal Fattore di Crescita Epidermico (EGF) e 1,25-(OH)2 D3 era sovraregolato da TGF-β1 e BMP- 225,26,34. È interessante segnalare come le analisi immunoistochimiche hanno mostrato che, in esemplari di topi adulti, la proteina periostina è di preferenza localizzata nel periosto e nel PDL26, suggerendo ruoli potenziali nel mantenimento e nel rimodellamento di queste strutture. Si è scoperto che tra tutte le proteine conosciute espresse nel PDL, la periostina è quella che mostra la più grande specificità e per questa ragione è comunemente usata come marcatore per il PDL.
La periostina, nel contesto parodontale, è espressa specificamente dai fibroblasti del PDL, suggerendo così un ruolo potenziale nella funzione del PDL26,33 (Figura 2).
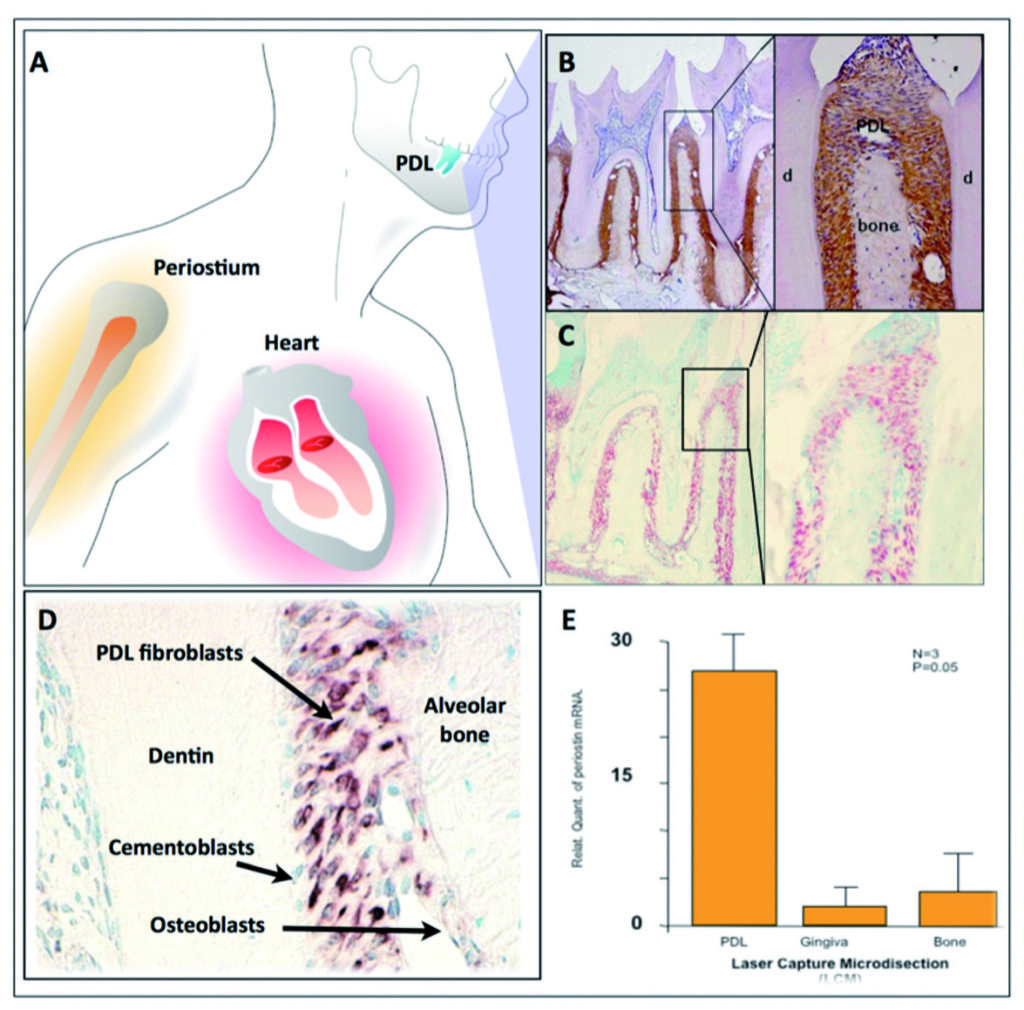
Recentemente è stato sottolineato che le attività promotrici della periostina erano potenziate dalla iperespressione di Twist, risultando in una maggiore espressione di periostina in vitro35. Inoltre, in vivo, Twist e periostina sono risultati co-espressi e strettamente regolati dai cambiamenti delle forze occlusali36, elemento che ha portato i ricercatori a ritenere il Twist il fattore trascrittore della periostina. Inoltre la periostina presenta una distribuzione diversa durante il movimento ortodontico dei denti; è sovraregolata nelle aree di compressione e sottoregolata in quelle di tensione37. L’osservazione attraverso immunoelettromicroscopia del PDL maturo ha confermato la localizzazione di periostina tra i processi citoplasmatici dei fibroblasti e cementoblasti parodontali e le fibrille collageniche adiacenti38. Quindi la periostina potrebbe esercitare un controllo sulle proprietà strutturali39 e funzionali dei tessuti del PDL in condizioni di salute o di malattia. Queste scoperte suggeriscono che la periostina sia presente nei siti di interazione tra cellule e matrice, dove agisce come fattore adesivo per sostenere le forze meccaniche, incluse quelle occlusali.
La periostina è necessaria per la normale funzione parodontale?
Abbiamo dimostrato inizialmente l’importante ruolo della periostina nell’integrità funzionale e strutturale del parodonto40. Gli animali deficitari di periostina mostrano chiaramente gravi deterioramenti alle strutture di supporto del dente40,41. Il nostro lavoro ha dimostrato che eliminando la periostina il parodonto si deteriora rapidamente nel tempo e non è più in grado di sostenere lo stimolo meccanico fisiologico, chiarendo quindi come sia necessaria questa molecola per la funzione del PDL e, di conseguenza, per l’integrità parodontale (Figura 3).
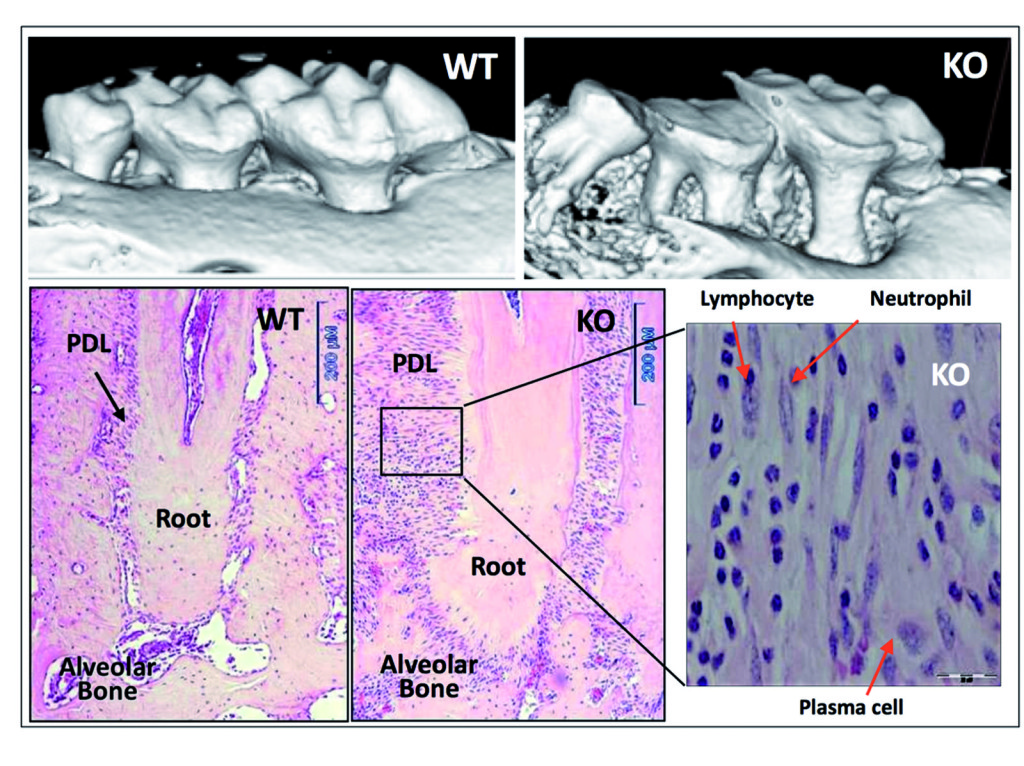
Inoltre, abbiamo mostrato come la periostina sia necessaria durante la funzione occlusale e che in caso di topi con periostina KO, il legamento parodontale non sia in grado di sostenere il normale carico occlusale fisiologico, evento che causa quindi in questo caso uno stimolo traumatico per il parodonto. Mentre la letteratura suggerisce che i traumi occlusali primari portano a una risposta adattativa dove non si genera alcuna distruzione dei tessuti di sostegno, nel caso di periostina KO lo stimolo meccanico può essere classificato come un trauma secondario che, a causa della mancanza della suddetta proteina, genera un effetto nocivo nel parodonto. Questo porta a una grave perdita di osso alveolare, a una perdita severa di CAL e a un significativo aumento dell’ampiezza dello spazio del PDL.
Che cosa fa la periostina nella matrice extracellulare?
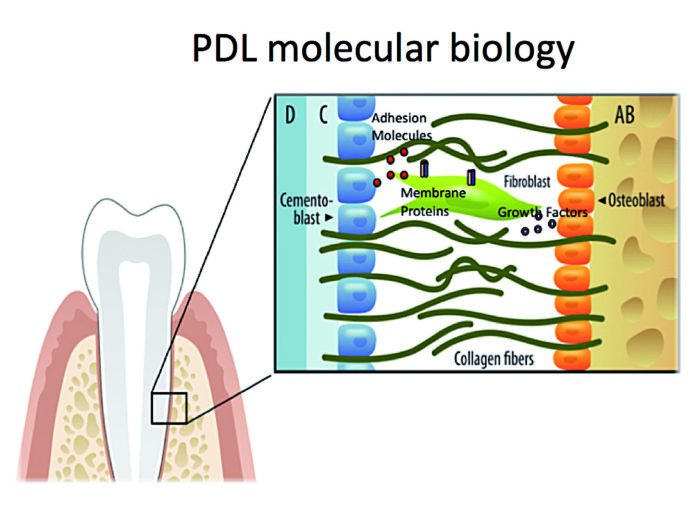
La periostina interagisce con le molecole strutturali extracellulari, come il Collagene Tipo I, e le proteine di membrana cellulare, quali le integrine αvβ3 e αvβ5.
Si è detto che queste interazioni matricellulari influenzano sia il comportamento della cellula che la fibrillogenesi del collagene6. Il diametro della fibra di collagene si riduce in assenza di periostina, generando un decremento nel modulo di elasticità nel KO. Inoltre, l’interazione tra periostina e αvβ5 attiva la trasduzione del segnale per la sopravvivenza cellulare. Il nostro gruppo ha dimostrato che la periostina è strettamente legata ai fasci di fibre del PDL provenienti dal cemento della superficie della radice all’osso alveolare che sostengono l’apparato di supporto del dente. Quindi, nel caso di eliminazione della periostina il parodonto si deteriora rapidamente nel tempo e non è in grado di sostenere lo stimolo meccanico fisiologico. Riassumendo, questa dimostrazione mostra il ruolo critico della proteina adattatrice matricellulare periostina come potenziale modulatore di importanti proprietà meccaniche del tessuto parodontale. È stato riportato che importanti cambiamenti molecolari avvengono durante la progressione della malattia periodontale. Livelli alterati di Transforming Growth Factorβ (TGF-β) appaiono coinvolti nella progressione della malattia parodontale42-45. Livelli ridotti di TGF- β-1nelle malattie parodontali in stato avanzato sono stati associati con attività alterate di metalloproteinasi (MMP’s) e interleuchina-1β (IL1-β)42,44. I livelli di TGF-β-1 aumentano sotto tensione meccanica e regolano l’espressione della periostina26,41,46. Queste molecole sono espresse in diversi stadi della guarigione della ferita.
Riportiamo in seguito le nuove scoperte riguardanti la sua rilevanza nella funzione del PDL40,41. I nostri dati suggeriscono che il TGF-β potrebbe influenzare l’integrità del parodonto attraverso la regolazione dell’espressione e della funzione della periostina. Il rilievo della periostina in altri tessuti specializzati, come il cuore, evidenzia chiaramente la sua importanza nella riparazione, rigenerazione e guarigione dopo l’infarto miocardico. La periostina è normalmente secreta da fibroblasti del PDL in risposta a lesioni e interagisce con i ricettori di integrine su cellule target per modulare il rimodellamento cellulare e della matrice.
Recentemente, con i progressi nella tecnologia e la disponibilità di modelli animali, è risultato possibile ricostruire un modello meccanicistico di patogenesi della malattia parodontale. A partire dalla eliminazione convenzionale dei geni parodontopatici “specifici”, abbiamo identificato fattori chiave che sembrano determinare la stabilità funzionale e strutturale dei tessuti di supporto del dente. I topi a cui manca l’integrina transmembrana αvβ6, una molecola espressa nell’epitelio giunzionale sano, perdono rapidamente attacco e mostrano una significativa migrazione apicale dell’epitelio sulculare, favorendo la formazione di tasche parodontali47. Questi cambiamenti sono associati a una segnalazione alterata di TGFβ-1, molecola coinvolta in numerose funzioni di regolazione, inclusi la riparazione del tessuto e il sistema immunitario. TGFβ-1 è secreto dalla cellula come un precursore latente del complesso ed è legato alla matrice extracellulare attraverso una proteina di legame detta TGFβ-1 latente(LTBP1)48. Il legame tra integrina αvβ6 e il peptide latente associato è stato implicato nell’attivazione e nel rilascio del αvβ-1 latente49,50 che invece favorisce la formazione e la maturazione della matrice extracellulare (ECM) attraverso la regolazione di MMP-8 e MMP-1342,51. L’esame dei tessuti prelevati da pazienti con malattia parodontale avanzata mostrano consistenti cambiamenti caratterizzati da un lato dalla diminuzione di TGFβ-1 e integrina αvβ 6 e dall’altro da maggiori livelli di collagenasi tissutale, gelatinasi e citochine proinfiammatorie quali IL1-β44,47,52,53. L’epitelio giunzionale durante la malattia parodontale è la prima barriera critica di tessuto che viene rotta dai batteri orali. La sua invasione stimola una robusta reazione di difesa immunologica dei leucociti all’interno dei tessuti gengivali. Tale reazione infiammatoria può essere contenuta entro questo livello oppure, in caso di individui predisposti, può progredire fino a compromettere l’integrità del PDL e dell’osso alveolare.
Discussione
Le malattie parodontali colpiscono gran parte della popolazione mondiale. L’identificazione delle variabili nella predisposizione genetica e il loro ruolo nell’insorgenza e nella progressione della malattia sono stati l’obiettivo di numerosi studi. Considerando le prove riportate, la periostina rappresenta un nuovo agente biologico con un significativo potenziale diagnostico e terapeutico che potrebbe migliorare la cura del paziente. Gli studi preclinici e meccanicistici attualmente disponibili nel campo della biologia parodontale hanno proposto nuove intuizioni sulla regolazione della funzione del PDL sia in condizioni di salute che di malattia. Comprendere il ruolo della periostina nel PDL aiuta a meglio definire la natura dinamica degli eventi biochimici matricellulari coinvolti nel passaggio tra salute e malattia parodontale (Figura 4).
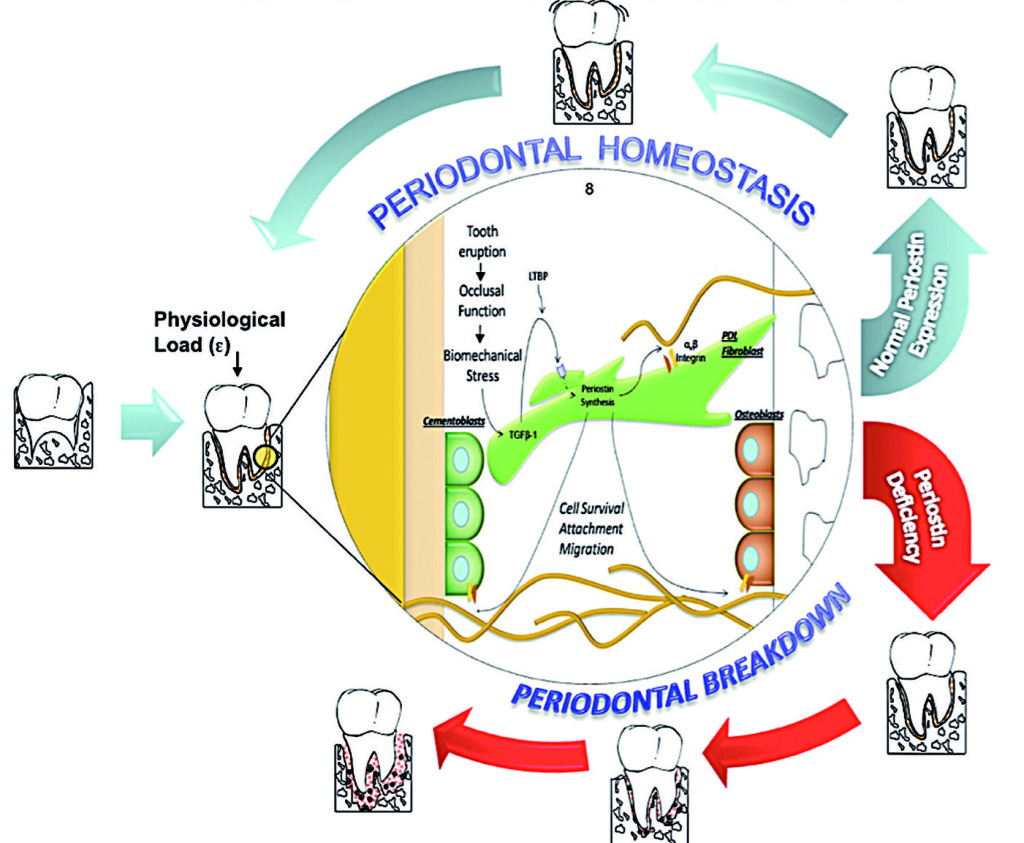
Queste informazioni contribuiscono ad aggiungere dettaglio nella descrizione degli agenti basilari coinvolti nel nuovo modello di patogenesi della malattia parodontale. Questo tipo di modello strutturale introduce geni, proteine e dati metabolici in una rete biologica dinamica che include meccanismi di inizio, di predisposizione e di soluzione della malattia. In definitiva questi dati aiuteranno la comprensione della biologia parodontale significativa per le dinamiche cellule-matrice e l’omeostasi, e quindi per nuovi percorsi di segnalazione cellulare che possano determinare la predisposizione verso la malattia parodontale ed essere sfruttati per il trattamento di tale patologia. Occorre ancora determinare nell’uomo le differenze fisiologicamente rilevanti nei livelli di periostina. Dai nostri esperimenti sugli animali, abbiamo riportato un chiaro fenotipo parodontale che si sviluppa nei topi che presentano totale mancanza di periostina (KO), mentre si sono avuti cambiamenti minori, o non si sono verificati per niente, in caso di diminuzione del 30-50% di periostina (Het). In ogni caso le osservazioni non riflettono una condizione microbica cronica come quella riscontrata nella malattia parodontale umana. Il modello proposto considera quindi solo parzialmente la questione. Tuttavia l’impossibilità di indurre la formazione di un complesso biofilm come nella parodontite umana è una limitazione dello studio. Attualmente le condizioni parodontali sono diagnosticate basandosi sulla presentazione clinica della malattia. La classificazione corrente ci guida a identificare “diverse” forme di malattia che si manifestano con una normale presentazione clinica e a dividerle in gruppi (i.e. cronica, aggressiva, necrotica ecc.). Per questo è nostra responsabilità riconoscere la complessità e l’eterogeneità di questo gruppo di condizioni. La limitazione della mancanza di una classificazione basata sull’eziologia compromette l’accuratezza di una diagnosi specifica e, quindi, l’identificazione della terapia più appropriata. Ulteriori studi dovrebbero essere mirati a identificare le condizioni determinanti della patologia, come l’espressione della periostina che può essere associata a un aumento della gravità e dell’estensione della malattia periodontale.
Ringraziamenti
Gli Autori ringraziano Chris Jung per averli assistiti con la preparazione delle immagini. Questo progetto è stato supportato dal National Institute of Health/National Institute of Dental e Craniofacial Research grants NIH/NIDCR K23DE019872 (HFR).
Corrispondenza
Hector F. Rios
Department of Periodontics and Oral Medicine
University of Michigan, School of Dentistry
1011 N. University, Ann Arbor, MI 48109-1078
Tel. 734-763-3383 – Fax: 734-936-0374 – hrios@umich.edu
Hector F. Rios
Department of Periodontics & Oral Medicine, School of Dentistry, University of Michigan, Ann Arbor, MI, USA
2. Persson GR, Persson RE. Cardiovascular disease and periodontitis: an update on the associations and risk. Journal of clinical periodontology 2008;35:362-379. 3. Lin D, Moss K, Beck JD, Hefti A, Offenbacher S. Persistently high levels of periodontal pathogens associated with preterm pregnancy outcome. Journal of periodontology 2007;78:833-841. 4. Boehm TK, Scannapieco FA. The epidemiology, consequences and management of periodontal disease in older adults. Journal of the American Dental Association (1939) 2007;138 Suppl:26S-33S. 5. Cunha-Cruz J, Hujoel PP, Kressin NR. Oral health-related quality of life of periodontal patients. Journal of periodontal research 2007;42:169-176. 6. Needleman I, McGrath C, Floyd P, Biddle A. Impact of oral health on the life quality of periodontal patients. Journal of clinical periodontology 2004;31:454-457. 7. Pihlstrom BL, Michalowicz BS, Johnson NW. Periodontal diseases. Lancet 2005;366:1809-1820. 8. Socransky SS, Haffajee AD, Cugini MA, Smith C, Kent RL Jr. Microbial complexes in subgingival plaque. Journal of clinical periodontology 1998;25:134-144. 9. Socransky SS, et al. Use of checkerboard DNA-DNA hybridization to study complex microbial ecosystems. Oral microbiology and immunology 2004;19:352-362. 10.Loesche WJ, Syed SA, Stoll J. Trypsin-like activity in subgingival plaque. A diagnostic marker for spirochetes and periodontal disease? Journal of periodontology 1987;58:266-273. 11.Dzink JL, Tanner AC, Haffajee AD, Socransky SS. Gram negative species associated with active destructive periodontal lesions. Journal of clinical periodontology 1985;12:648-659. 12.Takahashi I. et al. Expression of genes for gelatinases and tissue inhibitors of metalloproteinases in periodontal tissues during orthodontic tooth movement. Journal of molecular histology 2006;37:333-342. 13.Gotz W, Heinen M, Lossdorfer S, Jager A. Immunohistochemical localization of components of the insulin-like growth factor system in human permanent teeth. Archives of oral biology 2006;51:387-395. 14. Lee A, Schneider G, Finkelstein M, Southard T. Root resorption: the possible role of extracellular matrix proteins. Am J Orthod Dentofacial Orthop 2004;126:173-177. 15. Reichenberger E, et al. Collagen XII mutation disrupts matrix structure of periodontal ligament and skin. Journal of dental research 2000;79:1962-1968. 16. Gao J, Jordan TW, Cutress TW. Immunolocalization of basic fibroblast growth factor (bFGF) in human periodontal ligament (PDL) tissue. Journal of periodontal research 1996;31:260-264. 17. Yang YQ, Li XT, Rabie AB, Fu MK, Zhang D. Human periodontal ligament cells express osteoblastic phenotypes under intermittent force loading in vitro. Front Biosci 2006;11:776-781. 18. Tsuji K, Uno K, Zhang GX, Tamura M. Periodontal ligament cells under intermittent tensile stress regulate mRNA expression of osteoprotegerin and tissue inhibitor of matrix metalloprotease-1 and -2. Journal of bone and mineral metabolism 2004;22:94-103. 19. Sato R, Yamamoto H, Kasai K, Yamauchi M. Distribution pattern of versican, link protein and hyaluronic acid in the rat periodontal ligament during experimental tooth movement. Journal of periodontal research 2002;37:15-22. 20. Long P, Liu F, Piesco NP, Kapur R, Agarwal S. Signaling by mechanical strain involves transcriptional regulation of proinflammatory genes in human periodontal ligament cells in vitro. Bone 2002;30:547-552. 21. Kyriakides TR, Bornstein P. Matricellular proteins as modulators of wound healing and the foreign body response. Thrombosis and haemostasis 2003;90:986-992. 22. Bornstein P, Sage EH. Matricellular proteins: extracellular modulators of cell function. Current opinion in cell biology 2002;14:608-616. 23. Bornstein P. Matricellular proteins: an overview. Matrix Biol 2000;19:555-556. 24. Bornstein P. Diversity of function is inherent in matricellular proteins: an appraisal of thrombospondin 1. The Journal of cell biology 1995;130:503-506. 25. Takeshita S, Kikuno R, Tezuka K, Amann E. Osteoblast-specific factor 2: cloning of a putative bone adhesion protein with homology with the insect protein fasciclin I. The Biochemical Journal 1993;294 (Pt 1):271-278. 26. Horiuchi K, et al. Identification and characterization of a novel protein, periostin, with restricted expression to periosteum and periodontal ligament and increased expression by transforming growth factor beta. J Bone Miner Res 1999;14:1239-1249. 27. Gillan L, et al. Periostin secreted by epithelial ovarian carcinoma is a ligand for alpha(V)beta(3) and alpha(V)beta(5) integrins and promotes cell motility. Cancer research 2002;62:5358-5364. 28. Sasaki H, et al. Expression of the periostin mRNA level in neuroblastoma. Journal of pediatric surgery 2002;37:1293-1297. 29. Sasaki H, et al. Serum level of the periostin, a homologue of an insect cell adhesion molecule, as a prognostic marker in nonsmall cell lung carcinomas. Cancer 2001;92:843-848. 30. Bao S, et al. Periostin potently promotes metastatic growth of colon cancer by augmenting cell survival via the Akt/PKB pathway. Cancer cell 2004;5:329-339. 31. Dorn GW 2nd. Periostin and myocardial repair, regeneration, and recovery. The New England journal of medicine 2007;357:1552-1554. 32. Shimazaki M, et al. Periostin is essential for cardiac healing after acute myocardial infarction. The Journal of experimental medicine 2008;205:295-303. 33. Kruzynska-Frejtag A, et al. Periostin is expressed within the developing teeth at the sites of epithelial-mesenchymal interaction. Dev Dyn 2004;229:857-868. 34. Ji X, et al. Patterns of gene expression associated with BMP-2-induced osteoblast and adipocyte differentiation of mesenchymal progenitor cell 3T3-F442A. Journal of bone and mineral metabolism 2000;18:132-139. 35. Oshima A, et al. A novel mechanism for the regulation of osteoblast differentiation: transcription of periostin, a member of the fasciclin I family, is regulated by the bHLH transcription factor, twist. Journal of cellular biochemistry 2002;86:792-804. 36. Afanador E, et al. Messenger RNA expression of periostin and Twist transiently decrease by occlusal hypofunction in mouse periodontal ligament. Archives of oral biology 2005;50:1023-1031. 37. Wilde J, Yokozeki M, Terai K, Kudo A, Moriyama K. The divergent expression of periostin mRNA in the periodontal ligament during experimental tooth movement. Cell and tissue research 2003;312:345-351. 38. Suzuki H, et al. Immunohistochemical localization of periostin in tooth and its surrounding tissues in mouse mandibles during development. The anatomical record 2004;281:1264-1275. 39. Norris RA, et al. Periostin regulates collagen fibrillogenesis and the biomechanical properties of connective tissues. Journal of cellular biochemistry 2007;101:695-711. 40. Rios H, et al. Periostin null mice exhibit dwarfism, incisor enamel defects, and an early-onset periodontal disease-like phenotype. Molecular and cellular biology 2005;25:11131-11144. 41. Rios HF, et al. Periostin is essential for the integrity and function of the periodontal ligament during occlusal loading in mice. Journal of periodontology 2008;79:1480-1490. 42. Yan C, Boyd DD. Regulation of matrix metalloproteinase gene expression. Journal of cellular physiology 2007;211:19-26. 43. Atilla G, Emingil G, Kose T, Berdeli A. TGF-beta1 gene polymorphisms in periodontal diseases. Clinical biochemistry 2006;39:929-934. 44. Agarwal S, et al. Regulation of periodontal ligament cell functions by interleukin-1beta. Infection and immunity 1998;66:932-937. 45. Skaleric U, Kramar B, Petelin M, Pavlica Z, Wahl SM. Changes in TGF-beta 1 levels in gingiva, crevicular fluid and serum associated with periodontal inflammation in humans and dogs. European journal of oral sciences 1997;105:136-142. 46. Hamilton DW. Functional role of periostin in development and wound repair: implications for connective tissue disease. Journal of cell communication and signaling 2008;2(1-2):9-17. 47. Ghannad F, et al. Absence of alphavbeta6 integrin is linked to initiation and progression of periodontal disease. The American journal of pathology 2008;172:1271-1286. 48. Taipale J, Miyazono K, Heldin CH, Keski-Oja J. Latent transforming growth factor-beta 1 associates to fibroblast extracellular matrix via latent TGF-beta binding protein. The Journal of cell biology 1994;124:171-181. 49. Annes JP, Chen Y, Munger JS, Rifkin DB. Integrin alphaVbeta6-mediated activation of latent TGF-beta requires the latent TGF-beta binding protein-1. The Journal of cell biology 2004;165:723-734. 50. Munger JS, et al. The integrin alpha v beta 6 binds and activates latent TGF beta 1: a mechanism for regulating pulmonary inflammation and fibrosis. Cell 1999;96:319-328. 51. Kiili M, et al. Collagenase-2 (MMP-8) and collagenase-3 (MMP-13) in adult periodontitis: molecular forms and levels in gingival crevicular fluid and immunolocalisation in gingival tissue. Journal of clinical periodontology 2002;29:224-232. 52. Gemmell E, Seymour GJ. Immunoregulatory control of Th1/Th2 cytokine profiles in periodontal disease. Periodontology 2000 2004;35:21-41. 53.Silva N, et al. Characterization of progressive periodontal lesions in chronic periodontitis patients: levels of chemokines, cytokines, matrix metalloproteinase-13, periodontal pathogens and inflammatory cells. Journal of clinical periodontology 2008;35:206-214.





Excellent post! We will be linking to this particularly great article on our site. Keep up the great writing.|