Release of bisphenol A from sealants
I materiali a base resinosa sono la scelta predominante tra i sigillanti dentali. Attraverso un’analisi della letteratura recente e un contributo sperimentale è stato valutato il loro potenziale rilascio di BPA nella saliva.
Obiettivi. Rilevare e quantificare le concentrazioni di bisfenolo A (BPA), molecola dalle note proprietà estrogeniche, in campioni di saliva umana raccolti prima e dopo l’applicazione di un sigillante dentale commerciale.
Metodi. Sono stati prelevati campioni salivari di 20 soggetti adulti; il primo campione è stato prelevato un minuto prima della posa di un sigillante (20 controlli) e il secondo un minuto dopo la posa dello stesso (20 test). Nei campioni è stata ricercata la presenza di BPA: la caratterizzazione quali-quantitativa è stata effettuata in gascromatografia accoppiata con spettrometria di massa (GC-MS).
Risultati. Tutti i campioni hanno dimostrato la presenza di BPA, con valori, nei casi controllo, sempre inferiori agli 0,5 ng/ml. Nei 20 campioni test il valore medio è stato di 56,1±68,4 ng/ml. Il sesso femminile e i non fumatori hanno mostrato le maggiori concentrazioni medie, il pH salivare ha mostrato una correlazione inversa con le concentrazioni di BPA.
Conclusioni. Le quantità di BPA rilasciate dal sigillante e riscontrate nell’eluato sono in linea con i valori indicati in letteratura e presumibilmente insufficienti per esplicare effetti estrogenici in vivo.
Objectives. This work pretend to demostrate and estimate presence and concentration of bisphenol A, substance with known estrogenic activity, in saliva samples collected before and after the pose of a dental sealing.
Methods. We have collected saliva samples from 20 healthy adult subjects; from all subjects we have collected saliva one minute before (baseline samples) and one minute after (samples tests) positioning of a dental sealing. To determine the concentrations of BPA gaschromatography-mass spectrometry (GC-MS) was used.
Results. The BPA was detectable in all saliva specimens, in baseline specimens the concentration was always lower than 0.5 ng/ml. In sample tests BPA was found with a mean concentration of 56.1±68.4 ng/ml. Female and non smoker subjects have shown the major mean concentrations. A statistically significant reverse correlation was found with pH of saliva.
Conclusions. BPA concentrations found in eluate agree with literature data and seem to be lower than those necessary to cause estrogenic effects in vivo.
L’utilizzo dei sigillanti nei solchi e nelle fessure dei denti permanenti è una delle misure protettive maggiormente utilizzate nei molari dei bambini, avendo dimostrato efficacia sia nel prevenire1,2 sia nell’arrestare la progressione della carie dentale3-6.
Sin dal momento dell’introduzione dei sigillanti nell’odontoiatria clinica, il numero dei bambini nel mondo che riceve questa misura preventiva durante la pratica odontoiatrica pediatrica di routine sta crescendo continuamente7-9.
Allo stato attuale, tre tipi di materiali sono disponibili come sigillanti di solchi e fessure: cementi vetro-ionomerici (GICs), compomeri e resine10. Dal momento che la ritenzione dei cementi vetro-ionomerici è relativamente bassa11-13, questi sono considerati più come una sorgente di fluoro che come sigillanti veri e propri14; dall’altra parte, per quanto riguarda i compomeri, la letteratura disponibile è scarsa10.
Per queste ragioni i materiali a base resinosa sono la scelta predominante tra i sigillanti dentali10.
Nonostante i sigillanti a base resinosa (RBDS) non contengano bisfenolo A puro come componente chimico iniziale, si ritiene che BPA compaia come materiale in tracce, come risultato del processo di produzione del bisfenolo A-glicidil metacrilato (bis-GMA), oppure come prodotto di degradazione di bis-GMA polimerizzato negli stessi RBDS15-18.
Numerosi studi hanno riscontrato che sigillanti dentali polimerizzati possono effettivamente rilasciare BPA nella saliva19,20. Una recente revisione sistematica10 afferma: “Dalla sintesi qualitativa e quantitativa degli studi, è ragionevole concludere che BPA è effettivamente rilasciato nella cavità orale dopo posizionamento di alcuni sigillanti nei solchi e nelle fessure. La maggior quantità è rilevata nella saliva immediatamente e dopo un’ora dal loro posizionamento”.
In generale, è disponibile un’ampia letteratura che dimostra che il BPA ad alte dosi può agire come un perturbatore endocrino (Endocrine Disruptor – ED), essendo in grado di legare numerosi recettori ormonali facenti capo al sistema endocrino e ad altri sistemi21-23. Il BPA – a causa della sua attività perturbativa, ossidativa, mutagenica, ipometilante – in alte dosi può alterare la funzione di vari ormoni, inclusi quelli sessuali, l’insulina, la leptina, la tirosina e causare effetti epatotossici, mutagenici e carcinogenici24-30. Altri autori hanno inoltre suggerito che l’esposizione al BPA può aumentare il rischio di malattie cardiache, diabete, obesità e di disturbi dello sviluppo31-34.
Il BPA è stato, infine, sospettato di essere neurotossico e teratogeno35,36, ma tali affermazioni non hanno avuto a tutt’oggi conferme sperimentali (per una revisione completa della letteratura in ambito medico generale22).
In odontoiatria, però, le quantità di BPA rilasciate dagli RBDS sono molto basse37, e alcuni autori nel recente passato hanno concluso che il rischio clinico stimabile è minimo o nullo38-42.
Tuttavia, “la discussione sul BPA, sia in odontoiatria che in generale, non ha raggiunto una conclusione”23: alcuni autori affermano che basse dosi di BPA (e altri ED del sistema endocrino) possono generare effetti non monotonici, ovvero che non rispettano il principio della “dose-risposta”, chiamati “effetti ormetici” e che non sono riscontrabili ad alte dosi43,44.
Benché gli effetti di BPA alle più basse dosi siano ancora da verificare, l’Accademia americana di odontoiatria pediatrica (AAPD)45, la Federazione dentale internazionale46 e molti studi di revisione della letteratura47-49 chiedono agli odontoiatri di minimizzare l’esposizione dei loro pazienti al BPA che può provenire da sigillanti (e compositi). Partendo dalle suddette acquisizioni della letteratura, il presente contributo sperimentale, che replica un precedente lavoro38 effettuato, però, su un altro prodotto commerciale, ha avuto lo scopo di evidenziare e quantificare la presenza di BPA in campioni di saliva umana raccolti dopo un minuto dall’applicazione di un sigillante.
Materiali e metodi
Ottenuti il consenso informato dai singoli volontari e l’approvazione alla ricerca da parte del Comitato etico dell’università di Perugia, si è proceduto come di seguito descritto.
Raccolta campioni
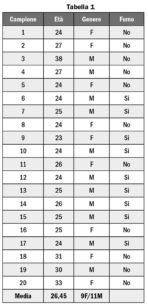
Sono stati analizzati 40 campioni di saliva umana ottenuti da 20 volontari di età compresa tra i 21 e i 38 anni (11 maschi e 9 femmine, età media 26,5). Di questi, 9 (5 maschi e 4 femmine) erano fumatori. I dati dei volontari sono riassunti in Tabella 1.
I singoli campioni iniziali erano costituiti da 4 ml di saliva raccolti per caduta in tubi da 16 ml in Falcon di polistirene. Dopo la raccolta i campioni sono stati conservati a 4 °C sino al momento dell’analisi, effettuata entro 24 ore dal campionamento.
Dei 40 campioni:
- 20 (numerati progressivamente da 1 a 20 con l’aggiunta della lettera A) fungevano da controlli essendo costituiti da saliva raccolta prima dell’applicazione del sigillante;
- 20 erano i campioni-test (numerati progressivamente da 1 a 20 con l’aggiunta della lettera B) in quanto costituiti da saliva raccolta dopo un minuto dall’applicazione e polimerizzazione con lampada alogena BluePhase (Ivoclar-Vivadent, Schaan, Liechtenstein) (20”) di 50 mg di sigillante Fissurit F (VoCo, Cuxhaven, Germania).
L’applicazione è avvenuta, previo isolamento del campo, sulla superficie vestibolare dell’elemento 4.3, senza previa mordenzatura (per non creare danni smaltei e permettere il facile distacco del sigillante).
Preparazione dei campioni e analisi
Ogni campione di saliva è stato omogeneizzato con vortexatura e da esso è stato prelevato 1 ml cui è stato aggiunto 0,1 ml di Internal Standard (IS), costituito da 3-idrossi-fenil-etil-alcool in etanolo (Sigma Aldrich, Steinheim, Germania).
Il campione di 1,1 ml è stato purificato con cromatografia a dispersione su matrice solida (MSPD):
- addizionandolo di 0,4 g di NaCl e di 100 microlitri di HCl 1M;
- inserendolo in colonna di vetro con setto a porosità G2, impaccata con 1,5 g di gel di silice (70-230 mesh, Merck, Darmstadt, Germania) quale fase solida disperdente e facendolo percolare attraverso la fase stazionaria;
- procedendo all’eluizione del BPA e dell’IS con 6 ml di diclorometano e 5 ml di etilacetato;
- raccogliendo l’eluato in cono di concentrazione in vetro e portandolo a secco con flusso di azoto riscaldato (30 °C).
Data la natura polare dell’analita è stata attuata derivatizzazione per silanizzazione del BPA come trimetilsilano (BPA-TMS) per aumentarne la volatilità: il residuo secco del campione è stato, quindi, addizionato di 100 microlitri di una soluzione BSTFA all’1% in trimetilclorosilano (TMCS) (Superchrom, Milano, Italia) e 100 microlitri di piridina.
Il tutto è stato lasciato reagire a 24 °C per 40 minuti e si è, quindi, proceduto all’analisi gascromatografica-spettroscopica di massa (GC-MS) di 1 microlitro della soluzione ottenuta mediante un gascromatografo Varian CP 3800 (Palo Alto, Ca, USA) interfacciato con uno spettrometro di massa a trappola ionica Varian 2000.
L’identificazione del BPA è avvenuta per confronto dei suoi tempi di ritenzione nei singoli 40 campioni con quelli di eluizione di una soluzione standard di BPA e per confronto diretto del suo spettro di massa con quelli riportati nelle banche dati NIST 92 e Wiley 5.
Le soluzioni standard di BPA e IS sono state ottenute per solubilizzazione di 5 mg di ognuno in etanolo al 100%. Per la quantificazione del BPA è stata costruita una retta di calibrazione riportando sulle ascisse il rapporto area BPA/area IS impiegato e sulle ordinate la corrispondente concentrazione espressa in microgrammi/ml. Dall’equazione di tale retta è stato possibile estrapolare i valori incogniti di concentrazione del BPA.
Risultati e discussione
Dal punto di vista qualitativo tutti i campioni, compresi i 20 controlli, hanno manifestato la presenza di BPA, ma le concentrazioni evidenziate nei controlli erano sempre inferiori a 0,5 ng/ml. Dal punto di vista quantitativo, i risultati ottenuti nei 20 campioni-test sono riportati in Tabella 2 e nel Grafico 1.
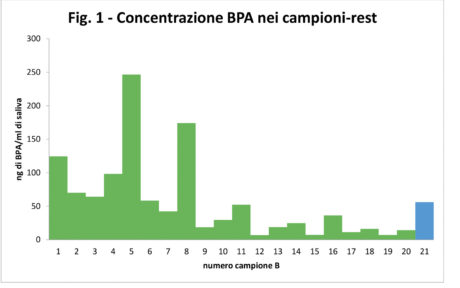
Il valore medio di BPA rilasciato in saliva dopo un minuto dall’applicazione del sigillante è stato di 56,1±68,4 ng/ml. L’elevata deviazione standard è legata all’ampio range dei dati analitici che vanno da un minimo di 6,8 ng/ml (soggetto 12B) a un massimo di 246,6 ng/ml (soggetto 5B).
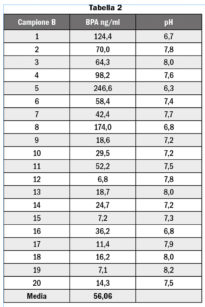
I valori di BPA riscontrati appaiono in linea con quelli presenti in letteratura10,19,38,39,47.
Al fine di un’analisi più dettagliata, sono stati calcolati i valori medi e le relative deviazioni standard delle concentrazioni di BPA in:
- soggetti di sesso maschile (valore medio di 33,5±29,6 ng/ml);
- soggetti di sesso femminile (valore di 83,6±81,7 ng/ml);
- soggetti fumatori (valore di 24,2±20,5 ng/ml);
- soggetti non fumatori (valore di 83,9±78,3 ng/ml).
Tali valori sono stati comparati con quello medio dei 20 campioni-test (Grafico 2).
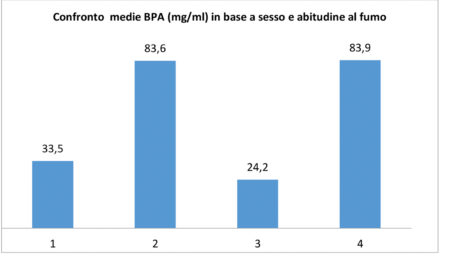
I valori medi di BPA più alti sono a carico dei soggetti di sesso femminile e dei non fumatori; abbiamo già suggerito38 che le basse concentrazioni rilevate nei soggetti fumatori potrebbero essere associate alla presenza nella saliva di particelle carboniose e/o cineree derivanti dal fumo in grado di adsorbire parte del BPA.
Abbiamo poi tentato di correlare la forte variabilità dei dati analitici con i valori di pH relativi ai campioni analizzati (compresi in un intervallo da 6,3 a 8,2): applicando il t di Student si è evidenziato che i valori di pH e le concentrazioni di BPA presentano una correlazione inversa statisticamente significativa (p<0,05).
Conclusioni
I 20 campioni di saliva raccolti nei volontari dopo un minuto dall’applicazione del sigillante commerciale testato presentano concentrazioni medie di BPA di 56,1±68,4 ng/ml, comparabili con i dati della letteratura, inferiori a quelle necessarie a esplicare attività simil-estrogenica in vivo, ma sufficienti per una reazione di tipo ormetico. Il BPA è presente in tracce anche nei campioni di controllo, sottolineandone la natura ubiquitaria. Il sesso maschile e l’abitudine al fumo appaiono correlati a minori concentrazioni di BPA. È stata evidenziata una correlazione inversa statisticamente significativa tra i valori del pH e le concentrazioni di BPA.
Corrispondenza
Beatrice Pomili
beatrice.pomili@gmail.com
1Gnatologia e protesi dentaria
(tit. prof. G. Barraco), Corso di laurea magistrale in odontoiatria e protesi dentaria. Dipartimento di scienze chirurgiche e biomediche, università di Perugia.
2Dipartimento di ingegneria civile e ambientale UdR INSTM, università di Perugia, sede di Terni.
3Odontoiatria conservatrice (tit. prof. S. Eramo), Corso di laurea magistrale in odontoiatria e protesi dentaria. Dipartimento di scienze chirurgiche e biomediche, università di Perugia.