Riassunto
Il progressivo invecchiamento della popolazione e il miglioramento della qualità e delle aspettative di vita dei pazienti in età avanzata, si traducono in un incremento delle richieste di trattamenti implantologici riabilitativi delle edentulie parziali e totali. Tale fascia d’età della popolazione compresa tra la quinta e la settima decade di vita è anche, dal punto di vista epidemiologico, la più frequentemente interessata dal lichen planus delle mucose orali (LPO). La conoscenza dei meccanismi biomolecolari che caratterizzano la patogenesi del LPO e delle mucositi perimplantari/perimplantiti, integrati dalla valutazione organicistica del paziente giocano un ruolo chiave nel condizionamento del management terapeutico-restaurativo personalizzato.
Scopo del seguente studio è l’analisi delle variabili locali e sistemiche indotte dal LPO che, più di altre, possono influenzare l’iter programmatico riabilitativo dell’implantologo nell’indirizzo di una condotta teoreticamente olistica, tesa ad affrontare un quadro clinico-patologico di tale complessità.
Summary
Gingival lichen planus: preliminary considerations in implantologic surgical planning
The progressive population aging associated with the improvement of the life quality and expectation of the advanced age patients, themselves traduce in increased of the implantologic rehabilitative treatment of the both total and partial edentulate. The fifth and seventh life decade are the population age more frequently interested by oral lichen planus (OLP) from epidemiologic point of view. The bio-molecular mechanisms knowledge which characterize the OLP and mucositis/perimplantitis pathogenesis, united at the organic patient valuation, both play a key role to conditioning of the restorative-therapeutic individual management. Aim of this study is to analyze the local and systemic variables OLP induced, which, more of other, can influence the programmatic rehabilitative process of the implantologist, in the address of a theoretically holistic behaviour, in order to approach a clinic-pathologic picture of such complexity.
Le tecniche chirurgiche attuali nell’ambito dell’implantologia osteointegrata sono in grado di soddisfare in larga parte le aspettative di reintegro gnatologico dei pazienti che a esse fanno ricorso. Ad oggi, l’obiettivo e la sfida del chirurgo orale in campo implantologico consistono nella realizzazione di soluzioni riabilitative protesicamente guidate, che associno funzionalità ed estetica.
A tal proposito al chirurgo orale è richiesta, oltre che un’adeguata training-curve, anche la necessaria competenza teorico-pratica in merito alla risoluzione delle incompetenze morfologiche delle basi ossee del paziente.
Tutto ciò comporta da parte dell’implantologo un percorso decisionale clinico-operativo complesso, che contempla, sulle basi dell’evidenza scientifica, l’utilizzo di sofisticate metodiche morfocorrettrici finalizzate alla ricostruzione e/o rigenerazione ossea nell’ambito canonico dell’osteointegrazione avanzata. Il ricorso a materiali alloplastici o eterologhi, alle membrane riassorbibili in acido polilattico o poliglicolico o a quelle in politetrafluoroetilene (PTFE) rinforzate in titanio, agli innesti di osso autologo, possono agevolare il reintegro della quota ossea deficitaria e di conseguenza l’inserimento di fixtures implantari posizionate secondo precise coordinate, rendendo più predicibile il risultato estetico-funzionale.
Degna di nota è, però, la considerazione di carattere demografico sul progressivo invecchiamento della popolazione e sul miglioramento della qualità e delle aspettative di vita dei pazienti in età avanzata, che si traduce in un incremento delle richieste di trattamenti implantologici riabilitativi delle edentulie parziali e totali. Tale fascia d’età della popolazione compresa tra la quinta e la settima decade di vita è anche, dal punto di vista epidemiologico, la più frequentemente interessata dal lichen planus delle mucose orali (LPO).
Pertanto, rientra tra le competenze del chirurgo orale, oltre alla pianificazione dell’approccio operativo più efficace, la piena consapevolezza dell’evoluzione temporale della patologia e del relativo management clinico-terapeutico.
La diretta conseguenza si tradurrà inevitabilmente in un condizionamento decisionale nella scelta dei materiali e delle tecniche adottate, mirate al raggiungimento degli obiettivi di reintegrazione funzionale, unitamente alla minima invasività chirurgica nel rispetto delle condizioni patologiche dei tessuti nei pazienti affetti da LPO.
L’intento di questo studio è l’analisi delle variabili locali e sistemiche indotte dalla patologia in esame che, più di altre, possono influenzare l’iter programmatico riabilitativo dell’implantologo nell’indirizzo di una condotta teoreticamente olistica, tesa ad affrontare un quadro clinico-patologico di tale complessità.
Caratteri clinici e patogenetici
Il lichen planus (LP), è una malattia infiammatoria cronica mucocutanea a patogenesi immuno-cellulo-T-mediata, che comunemente coinvolge le mucose orali, ma può interessare in ordine di frequenza decrescente la cute, i genitali, le unghie, il cuoio capelluto, l’esofago, gli occhi1.
La prevalenza del LPO è stimata essere compresa tra lo 0,1 e il 3,8% della popolazione generale, con maggior frequenza tra la quinta e la settima decade e nel sesso femminile, nel quale si ritiene che l’assetto ormonale svolga un ruolo nel favorire l’insorgenza2.
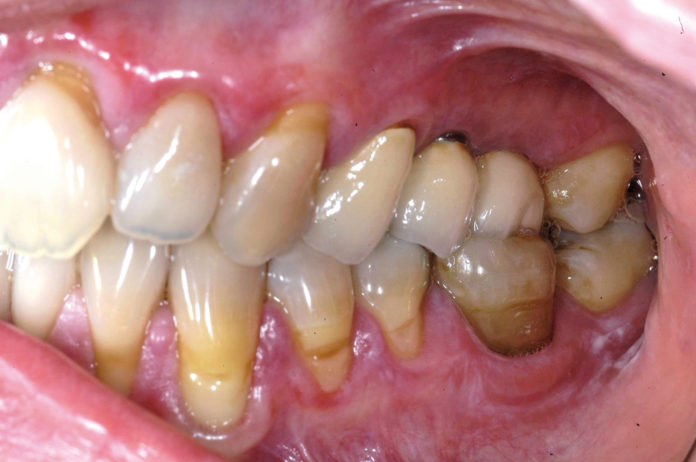
Delle sette varianti cliniche descritte dalla WHO (World Health Organization), ovvero reticolare, a placca, papulare, atrofica, erosiva, bollosa e ulcerativa, il comparto gengivale risulta essere colpito con maggior frequenza dalla variante atrofico-erosiva3 (figura 1).
La distribuzione prevalentemente simmetrica delle lesioni e la presenza quasi costante delle tipiche irradiazioni ipercheratosiche reticolari (strie di Wickhman), costituiscono un carattere patognomonico distintivo dell’obiettività clinica. L’esame bioptico è discriminante, evitando nel prelievo tessutale l’inclusione di aree ulcerate dalle caratteristiche potenzialmente fuorvianti ai fini del referto istomorfologico, considerando che le lesioni iniziali possono esibire un modello istopatologico aspecifico, rappresentato da infiltrato infiammatorio cronico4. Il LPO è definito dalla WHO come lesione potenzialmente maligna, ossia uno stato generalizzato associato a un rischio significativo di lesione neoplastica5.
La frequenza rilevante con cui tale stato morboso si manifesta e il ragguardevole panorama di casi di degenerazione carcinomatosa squamocellulare in lesioni da LPO riportati in letteratura, costituiscono un giustificato motivo di interesse e di approfondimento per i possibili risvolti prognostici, in seno alle diverse branche dell’odontostomatologia ivi compresa la chirurgia implantare.
Considerazioni locali
Il contesto clinico-patologico in cui si trova a operare l’implantologo gioca un ruolo nodale nella scelta delle possibili soluzioni terapeutiche. Numerosi studi presenti in letteratura pongono l’accento sulla salute dei tessuti perimplantari quale presupposto per la prevenzione di processi patologici a carico dell’interfaccia osso-impianto. La scarsa popolazione fibroblastica del connettivo e l’assenza del legamento parodontale dei suddetti tessuti espone la compagine ossea sottostante a più probabili processi infiammatori placca-correlati rispetto al dente naturale.
La tonicità della mucosa perimplantare possibilmente associata a un’adeguata quota di tessuto cheratinizzato (pur non essendo considerata quest’ultima una discriminante) possono costituire, a fronte di un’igiene ottimale, una barriera fisiologica alla colonizzazione batterica6. Quando l’integrità tessutale viene meno, il processo disgregativo conseguente ai periodici stati infiammatori acuti favorisce l’estensione apicale della mucosite perimplantare evolvendo in perimplantite. La combinazione dei fattori ora esposti con un quadro clinico di lichen orale atrofico-erosivo gengivale riveste di per sé un ruolo aggravante di indubbio significato sfavorevole ai fini prognostici circa la salute del comparto osso-impianto7. Il meccanismo patogenetico del LPO ad oggi più condiviso descrive il ruolo chiave delle metalloproteinasi di matrice (MMPs) nel processo di distruzione della membrana basale sia esso a opera diretta (chimasi che attiva le MMP-9) o indiretta (degranulazione mastocitaria che libera TNF-alpha il quale stimola i linfociti-T a liberare le MMP-9) da parte dei mastociti stessi8. Le MMPs sono un gruppo di collagenasi la cui espressione viene incrementata considerevolmente durante le patologie infiammatorie, la crescita neoplastica e metastatica e rivestono un ruolo marcato nella distruzione tessutale nelle patologie orali. Alti livelli di MMP-9 sono stati rilevati anche nell’epitelio giunzionale e nelle tasche gengivali affette da periodontite9. Intuitivamente tali processi tendono ad autoalimentarsi montando uno stato infiammatorio cronico il cui grado di severità è proporzionalmente legato sia alla contemporanea presenza di LPO e mucosite perimplantare/perimplantite, sia allo stato di controllo terapeutico in entrambe le patologie. Si ricorda inoltre che un’iniziale diagnosi di LPO che non coinvolge il comparto gengivale non è predittiva dell’evoluzione clinica delle lesioni, in quanto il divenire della patologia potrebbe interessare tale distretto in un secondo momento.
Considerazioni sistemiche
Sempre più frequentemente viene discussa la necessità di una valutazione organo-sistemica del paziente in corso di pianificazione terapeutica e/o riabilitativa nell’ambito della pratica odontoiatrica. Tale principio risulta incontrovertibile in presenza di patologie orali. I pazienti affetti da LPO possono manifestare quadri clinici più aggressivi in presenza di un’infezione da virus dell’epatite C (HCV). L’associazione tra le due affezioni sembra essere, almeno nella popolazione italiana e inglese, correlata alla regione allelica codominante HLA-DR6 la quale risulta più frequentemente espressa nei pazienti OLP-HCV10. Inoltre, il riscontro intralesionale nell’OLP di linfociti-T CD8 HCV-specifici come conseguenza della presenza di RNA virale alla base dell’attivazione linfocitaria, suggerisce il ruolo patogenetico del virus nell’aggressività delle lesioni11. Il monitoraggio dell’enzimogramma epatico, in pazienti affetti da LPO, sarà quindi particolarmente utile sia per verificare lo stato di controllo dell’epatopatia di base, sia per accertare l’efficienza metabolica dell’organo in prospettiva di eventuali terapie sistemiche versus-lichen.
L’indice glicemico è anch’esso un parametro ematochimico significativo in corso di LPO poiché non raramente si registra la concomitante associazione con una diatesi iperglicemica e un diabete scompensato a latere potrebbe aggravarsi anche in fase di terapia topica con clobetasolo. Il reflusso gastro-esofageo (RGE) è un’altra delle condizioni che possono complicare la gestione clinica del LPO, in quanto l’acidificazione dell’ecosistema orale predispone a un’indesiderata sovrapposizione mico-patogena da Candida albicans nelle lesioni, già favorita dall’eventuale terapia cortisonica in atto. L’anamnesi farmacologica riveste un significato potenzialmente diagnostico nei pazienti LPO, in quanto, specialmente nei quadri patologici limitati al cavo orale, orientano il clinico a delineare un panorama di fattori che potrebbe giocare un ruolo eziologico diretto o indiretto nel controllo e nell’aggravamento della malattia.
Le lesioni lichenoidi farmaco indotte riconoscono quali fattori eziologici putativi un elevato gruppo di molecole farmacologiche12.
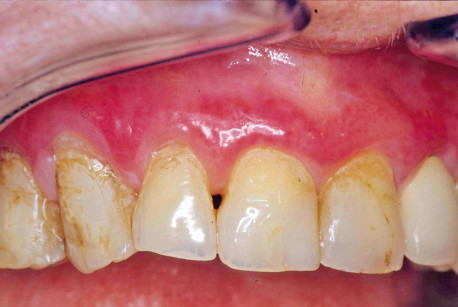
Nel panorama dei materiali dentari sostanze come oro, palladio, rame, argento, acrilati, possono generare eventi d’ipersensibilità ritardata, la cui espressione clinica mima le lesioni da LPO, con un modello patogenetico molto simile13 (figura 2).
Ampiamente dibattuto è il ruolo immuno-attivante delle amalgame dentarie, specificatamente individuato nel mercurio inorganico ivi contenuto, la cui liberazione insieme ad altri prodotti di corrosione dalla superficie dei restauri in amalgama potrebbe esitare, in individui suscettibili caratterizzati da un particolare determinante antigenico HLA, in un’attivazione linfocitaria con il montaggio di una risposta autoimmune cellulo-mediata diretta contro le cellule basali e clinicamente simile al LPO14.
Discussione
Un’ampia gamma di patologie sistemiche può esprimersi con lesioni gengivali, ma di queste il LPO è tra le più frequenti e la possibilità che il chirurgo orale debba pianificare la terapia implantologica in presenza di tali lesioni appare piuttosto elevata. La diagnosi di certezza può non rivelarsi agevole nel caso l’affezione interessi esclusivamente il comparto gengivale. Clinicamente il LPO atrofico-erosivo gengivale si caratterizza con diffuse aree eritematose che possono, o non, essere costellate da foci desquamativi e/o ulcerativi. La distribuzione segue solitamente il profilo gengivo-marginale e l’eventuale irradiazione ipercheratosica periferica costituisce un reperto adiuvante la diagnosi. L’osservazione del quadro di gengivite desquamativa non è patognomonico di LPO gengivale, ma è riscontrabile anche in presenza di malattie come il pemfigoide cicatriziale, pemfigo volgare, lupus eritematoso, epidermiolisi bollosa acquisita, malattia da immunoglobuline A lineare. Disfunzioni ormonali, candidosi, lesioni lichenoidi e la sindrome vulvo-vaginale-gengivale possono a loro volta essere incluse nella diagnosi differenziale nei confronti del LPO gengivale15. La difficoltà clinica nel formularne la diagnosi aumenta laddove al LPO gengivale si sovrappongono quadri di gengivite e/o parodontite16. In aggiunta, un contesto lesionale iniziale può apparire in corso di accertamento istopatologico con un modello di infiltrato infiammatorio cronico. In tal caso è raccomandabile una seconda biopsia che non includa aree ulcerate e che preveda un supplemento d’indagine con immunofluorescenza diretta per differenziare la diagnosi da altre patologie sistemiche che possono mimare il LPO gengivale17. Infine, non è ancora chiaro se le forme atrofico-erosive di LPO siano caratterizzate da un maggiore potenziale intrinseco di trasformazione maligna, oppure se la soluzione di continuità epiteliale predisponga al processo neoplastico per contatto connettivale diretto con carcinogeni esogeni18. È stato anche ipotizzato che ceppi di Candida albicans possano catalizzare la formazione di carcinogeni come N-nitrosobenzilmetilamina19.
Conclusioni
Appare evidente, come dimostrato da studi su modello animale e umano, che il sub-strato mucoso perimplantare sia meno efficiente, rispetto ai tessuti parodontali, nell’arginare lo stimolo irritativo placca-correlato20,21.
Il processo flogistico derivante è in grado, progredendo apicalmente, d’innescare una perimplantite con seria compromissione dell’osteointegrazione dell’impianto stesso. Il controllo scrupoloso della placca batterica costituisce quindi una delle prerogative imprescindibili per il mantenimento della stabilità secondaria dell’impianto osteointegrato.
Nei pazienti affetti da LPO gengivale il mantenimento di un’igiene orale domiciliare ottimale si dimostra spesso problematico, a fronte dell’estrema sensibilità agli stimoli fisico-chimici dei tessuti gengivali.
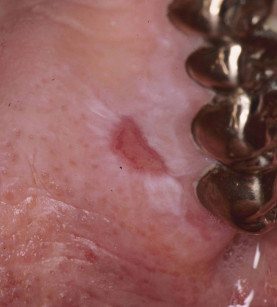
Sovente, questi pazienti mostrano elevati indici di placca con diffusa esacerbazione di gengivite paramarginale. Tale condizione, solo temporaneamente controllabile mediante sedute d’igiene orale professionale, induce a limitare il ricorso, nei pazienti in questione, all’utilizzo di membrane biologiche per la rigenerazione ossea. La medesima precauzione si dovrebbe riservare nel contenere al minimo il numero delle unità implantari da inserire nell’osso, preferendo soluzioni implantoprotesiche meno complesse e più facilmente gestibili dal paziente in ambito igienico domiciliare22 (figura 3).
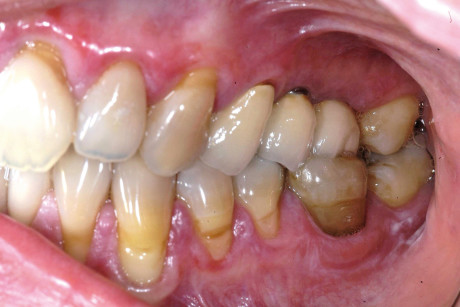
Si rammenta, inoltre, che il ricorso a sostanze antisettiche locali come la clorexidina dovrebbe essere limitato nel tempo e con preparati privi di alcool. Raccomandabili i test allergologici epicutanei in presenza di restauri metallici e/o otturazioni in amalgama in particolare quando le lesioni sono confinate al solo cavo orale e in vicinanza dei restauri, eseguendo la lettura anche in differita al settimo-ottavo giorno per intercettare reazioni ritardate, altrimenti misconosciute. Va segnalato, infatti, che l’aumento di permeabilità delle mucose affette da lesioni erosive può favorire la sensibilizzazione a sostanze restaurative che in una prima lettura risultino negative23.
Dovrà essere prestata attenzione all’anamnesi farmacologica per indagare l’eventuale nesso causale tra assunzione della molecola e comparsa delle lesioni e, se presente, individuare in collaborazione con lo specialista di riferimento una possibile molecola alternativa. A fronte di un interessamento muco-cutaneo è raccomandabile la collaborazione con il dermatologo e/o immunologo curante in modo da provvedere all’eventuale integrazione terapeutica di tipo topico nei periodi di acuzie delle lesioni. L’interazione con gli specialisti indicati permetterà anche di essere aggiornati circa le molecole utilizzate nel controllo della patologia. Giova ricordare che i casi gravi, o refrattari alle molecole topiche, vengono trattati con molecole cortisoniche sistemiche anche per lunghi periodi. In tal caso va considerato il corteo di effetti collaterali che segue la pratica terapeutica come la riduzione dell’assorbimento di calcio a livello intestinale, l’aumento dell’escrezione renale di calcio, l’incremento dell’attività osteoclastica di riassorbimento osseo e riduzione dell’apposizione di nuovo osso, per citare quelli più strettamente legati ai processi osteointegrativi. In ultimo, ma non meno importante, il richiamo programmato dei pazienti affetti da LPO atrofico-erosivo con frequenza almeno semestrale da incrementare durante i periodi di terapia, finalizzato all’individuazione precoce di possibili alterazioni tessutali in senso neoplastico24.
Corrispondenza
Giampaolo Bombeccari
Via Cervino, 30
24068 Seriate BG
gpbombeccari@libero.it
• Gianpaolo Bombeccari1
• Federico Gualini
• Sara Gualini1
• Francesco Spadari2
1Ambulatorio di Patologia e Medicina Orale.Dipartimento di Scienze Chirurgiche Ricostruttive e Diagnostiche , Università degli Studi di Milano
2Professore Associato dell’Università degli Studi di Milano – Ambulatorio di Patologia e Medicina Orale Dipartimento di Scienze Chirurgiche Ricostruttive e Diagnostiche , Università degli Studi di Milano
2. Silverman S Jr, Bahl S. Oral Lichen Planus Update: Clinical Characteristics, Treatment Responses, and Malignant Transformation. Am J Dent 1997;10:259-63.
3. Axell T, Rundquist L. Oral lichen planus: a demographic study. Community Dent Oral Epidemiol 1987;15:52-6.
4. van der Waal I. Potentially malignant disorders of the oral and oropharyngeal mucosa; terminology, classification and present concepts of management. Oral Oncol 2009;45(4-5):317-23.
5. Axell T, Pindborg JJ, Smith CJ, Van der waal I. Oral white lesions with special reference to precancerous and tobacco-related lesions: conclusions of an international symposium held in Uppsala, Sweden, International Collaborative Group on Oral White Lesions. J Oral Pathol Med 1994 May;18-21.
6. Artzi Z, Tal H, Moses O, Kozlovsky A. Mucosal considerations for osseointegrated implants. J Prosthet Dent 1993 Nov;70(5):427-32.
7. Hemmings K, Griffiths B, Hobkirk J, Scully C. ABC of oral health: Improving occlusion and orofacial aesthetics: tooth repair and replacement. BMJ 2000;321;438-441.
8. Zhou XJ, Sugerman PB, Savage NW, Walsh LJ, et al. Intra-epithelial CD8+ T cells and basement membrane disruption in oral lichen planus. Journal of Oral Pathology & Medicine 2002;31(1):23-27.
9. Smith PC, Munoz VC, Collados L, Oyarzun AD. In situ detection of matrix metalloproteinase-9 (MMP-9) in gingival epithelium in human periodontal disease. J Periodontal Res 2004 Apr;39(2):87-92.
10. Carrozzo M, Brancatello F, Dametto E, Arduino P, Pentenero M, Rendine S, Porter SR, Lodi G, Scully C, Gandolfo S. Hepatitis C virus-associated oral lichen planus: is the geographical heterogeneity related to HLA-DR6? J Oral Pathol Med 2005 Apr;34(4):204-8.
11. Pilli M, Penna A, Zerbini A, Vescovi P, Manfredi M, Negro F, Carrozzo M, et al. Oral lichen planus pathogenesis: A role for the HCV-specific cellular immune response. Hepatology 2002 Dec; 36(6):1446-52.
12. Abdollahi M, Radfar M. A Review of Drug-Induce Oral Reactions.The J of Contemporary Dental Practice 2002; vol. 3 n. 4 nov. 15.
13. Laeijendecker R, Van Joost T. Oral manifestations of gold allergy. J Am Acad Dermatol 1994;30:205-209.
14. Laine J, Konttinen YT, Beliaev N, Happonen RP. Immunocompetent cells in amalgam-associated oral lichenoid contact lesions. J Oral Pathol Med 1999;28(3):117-121.
15. Pelisse M. The vulvo-vaginal-gingival syndrome: a new form of erosive lichen planus. Int J Dermatol 1989;28:381-384.
16. Rubira IR, Gobetti JP. Gingival lichen planus: a diagnostic problem. J Mich Dent Assoc 1994;76:44-48.
17. Markopoulos AK, Antoniades D, Papanayotou P, Trigonidis G. Desquamative gingivitis: a clinical, histopathologic, and immunologic study. Quintessence Int 1996;27:763-767.
18. Kilpi A, Rich AM, Reade PC, Konttinen YT. Studies of the inflammatory process and potential of oral mucosal lichen planus. Aust Dent J 1996;41:87-90.
19. Krogh P, Hald B, Holmstrup P. Possible mycological etiology of mucosal cancer catalytic potential of infecting Candida albicans and other yeasts in production of N nitrosobenzylmethylamine. Carcinogenesis 1987;8:1543-1548.
20. Leonhardt A, Berglundh T, Ericsson I, et al. Putative periodontal pathogens on titanium implants and teeth in experimental gingivitis and periodontitis in beagles dogs. Clin Oral Implants Res 1992;3:112-119.
21. Pontoriero R, Tonelli MP, Carnevale G, et al. Experimentally induce peri-implant mucositis. A clinical study in humans. Clin Oral Implants Res 1992;3:104-111.
22. Esposito S.J , Camisa C, Morgan M. Implant retained overdentures for two patients with severe lichen planus: A clinical report. The Journal of Prosthetic Dentistry 2003;1(89):6-10.
23. Dunsche A, Kastel I, Terheyden H, Springer IN, Christophers E, Brasch J. Oral lichenoid reactions associated with amalgam: improvement after amalgam removal. Br J Dermatol. 2003 Jan;148(1):70-6.
24. Van der Meij EH, Schepman KP, Van der Waal I. The possible premalignant character of oral lichen planus and oral lichenoid lesions: a prospective study. Oral Surg, Oral Med, Oral Pathol, Oral Radiol end Endod 2003;96(2):164-171.